针刺通过调控AMPK-mTOR-细胞自噬改善瘦素抵抗
李 茜, 龚美蓉
(南京中医药大学 针药结合教育部重点实验室,江苏 南京 210023)
肥胖症是指身体内所含的脂肪组织超出了维持生理正常功能的比例,是一种常见的代谢症候群。我国肥胖病的发生率亦呈现逐年增高的趋势[1],现在肥胖人数已居世界首位,国家卫计委报告中国超过 4.1 亿(30%)的成年人超重,其中有1.6亿人(11.9%)为肥胖。肥胖正像流行病一样蔓延,已经成为国内外的公共卫生焦点问题[2],对人类的健康构成了巨大的威胁[3]。
瘦素是一种主要由脂肪细胞分泌的,具有167个氨基酸的蛋白质。其主要生物功能是减少能量摄入,增加能量消耗。大多数肥胖患者并不缺乏瘦素,而且其血清瘦素水平是较高的,提示瘦素抵抗可能是肥胖症的重要发病机制之一[4]。如何改善患者的瘦素抵抗是解决肥胖症的一个关键步骤。
1 针刺改善肥胖患者的瘦素抵抗
临床实验观察到针刺治疗后,肥胖患者的体重、BMI与腰臀围比均显著下降,其脂代谢的紊乱表现为明显的改善[5]。在动物实验中,针刺肥胖大鼠后,可明显降低大鼠的体重、Lee's 指数、体脂量,提示针刺减肥具有确切的疗效[6]。瘦素是白色脂肪细胞分泌的一种蛋白质,其主要生物功能是抑制脂肪合成,促进脂肪酸的氧化分解。临床实验与动物实验中均发现,针刺可显著降低人和动物血清中瘦素含量,提高瘦素的敏感性,改善瘦素抵抗[7-8]。可见改善瘦素抵抗是针刺减肥的重要机制。
2 细胞自噬障碍导致肥胖患者瘦素抵抗
瘦素是脂肪细胞分泌的一种蛋白质,它的生理作用主要是减少进食,增加活动量,从而使脂肪消耗[9]。瘦素抵抗指血浆瘦素水平升高,但作用减弱或消失。表现为食欲旺盛、能量消耗减少、肥胖等症状。相关研究显示有许多因素可导致肥胖患者瘦素抵抗,如:高瘦素血症,炎症,内质网应激,自噬障碍等。因细胞自噬是机体应对各种外界刺激及内在变化而产生的细胞内自我更新、自我修复的机制,自噬在细胞分化、物质代谢和能量平衡中起重要作用[10-11]。当细胞自噬障碍时会导致肥胖患者瘦素抵抗。
自噬(autophagy) 是真核细胞中普遍存在的一种物质降解途径,能介导细胞内脂肪的储存,该作用被称为脂自噬[12]。近年来,瘦素抵抗与细胞自噬之间关系的研究受到越来越多的关注,已成为研究热点[13]。实验发现特异性敲除自噬相关基因(autophagic related gene,Atg7) 的小鼠,自噬活动下降,导致能量失衡而肥胖,同时表现为瘦素抵抗[14]。研究发现,在遗传性肥胖小鼠和高脂饮食所致的肥胖小鼠中,自噬相关蛋白 LC3、Atg5、Atg6 和 Atg7 水平均显著下降。电镜分析发现,肥胖小鼠组织内自噬体形成明显减少,肝脏的内质网压力较正常小鼠升高。当恢复肥胖小鼠的细胞自噬水平后,其瘦素抵抗症状减缓,内质网压力减小[15]。可见细胞自噬障碍可导致肥胖患者瘦素抵抗,激活自噬可改善瘦素抵抗的症状。
3 AMPK-mTOR信号通路介导细胞自噬
细胞自噬是细胞内溶酶体降解自身受损的细胞器及大分子物质的一种程序化的细胞内降解过程[11]。细胞自噬的过程受多种信号转导通路的调控[16]。由于腺苷酸激活蛋白激酶(AMP-activated protein kinase,AMPK)通过哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)途径调控细胞能量与细胞自噬关系最为密切,现已成为目前研究最多的信号通路[17]。
AMPK是一种丝/苏氨酸蛋白激酶,在机体中广泛存在。因其被AMP/ATP比值调控,准确的开启ATP的分解,关闭ATP的合成,因此被比喻为“细胞能量调节器”[18]。mTOR是一种典型丝氨酸/苏氨酸蛋白激酶,是氨基酸与ATP的感受器,作为AMPK下游的作用底物,在自噬过程中发挥门控作用,即为自噬的负调控分子[19]。ULK1是自噬相关蛋白Atg1在哺乳动物细胞中的同源蛋白之一,ULK1与mAtg13(Atg13同源物)、FIP200形成ULK1-mAtg13-FIP200复合体是mTOR的直接靶分子,也是自噬的正调控分子[20]。
mTOR形成两种功能的复合物:mTORC1和mTORC2,mTORC1在控制应答营养状况方面发挥着主要作用,包括mTOR、mLST8/GβL、PPAS40和raptor(对雷帕霉素敏感部位)。当mTORC1被激活,可直接磷酸化ULK1(Ser757)及mATG13的抑制位点,抑制ULK1激酶的活性,从而抑制细胞自噬[21]。当细胞内能量下降时,AMPK被激活,可直接磷酸化mTORC1的关键结合亚基raptor,致使mTORC1活性下降,mTORC1 与ULK1复合体分离,使得ULK1与mATG13抑制性磷酸化位点去磷酸化。去磷酸化的 Atg13 与 ULK1 形成 mAtg13-ULK1复合物,同时,活化 ULK1 并与 FIP200 相互作用,最终加强 mAtg13-ULK1的作用,从而诱导自噬体的核的形成于延伸,最终激活细胞自噬[22]。同时,活化的AMPK可直接磷酸化ULK1的Ser317、377位点直接激活ULK1,从而诱导细胞自噬的发生[23]。自噬得到诱导后,由 PI3 Kinase ClassⅢ-Beclin-1(Atg6同系物)复合物启动细胞膜泡的成核[24](图1)。
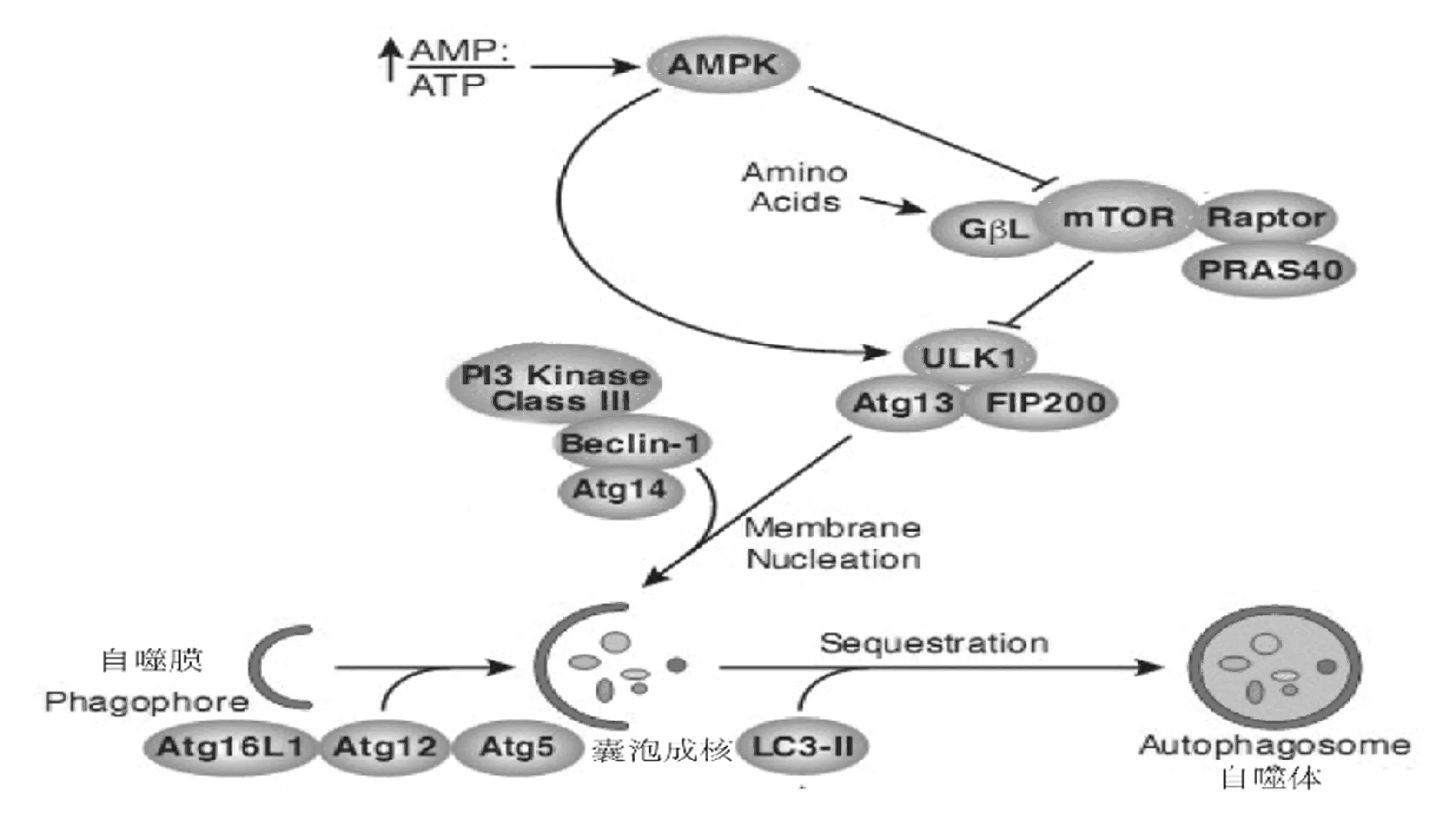
图1 AMPK-mTOR信号通路介导细胞自噬
4 针刺对AMPK-mTOR-细胞自噬的调控作用
新近有研究显示电针可以激活自噬的相关标志蛋白Beclin-1、LC3表达,从而上调自噬的活性[25]。Egan等观察到激活AMPK可升高肝细胞自噬水平,促进能量平衡[26]。哺乳动物雷帕霉素靶蛋白(mTOR)是氨基酸与ATP的感受器,作为AMPK下游的作用底物,在自噬过程中发挥门控作用,即为自噬的负调控分子[19]。何坚等研究发现电针可通过mTOR信号通路调控细胞的自噬[27]。综上所述,针刺能够激活AMPK,介导mTOR发挥其调节作用,进一步影响细胞自噬的发生,进而参与调控瘦素抵抗。但其具体的调控过程仍未明确,需要进一步探究。

