部分扣除Lys、Met及Thr对6~9月龄荷斯坦生长母牛瘤胃内环境的影响
■李 媛 孔凡林 毕研亮 刁其玉 屠 焰
(中国农业科学院饲料研究所奶牛营养学北京市重点实验室,北京100081)
对反刍动物而言,氨基酸营养不仅支撑动物机体生长,也是保证瘤胃微生物生长及瘤胃内环境稳定必不可缺的因素。Lys及Met是反刍动物的主要限制性氨基酸,二者也是瘤胃生长和微生物的蛋白(MCP)合成的必需氨基酸。Guliye 等(2007)[1]研究表明,培养基中去除Met 会导致瘤胃发酵效率下降。王洪荣等(2010)[2]指出Met 和Lys 对瘤胃细菌和原虫的生长具有一定的限制性,其中任一种氨基酸缺乏都会限制瘤胃细菌和原虫的生长。MCP 主要氨基酸组成除受日粮氨基酸水平影响外,也受瘤胃微生物种类的影响。Rodríguez 等(2000)[3]和周勃等(2000)[4]结果发现固相菌中Lys 含量高于液相菌。王洪荣等(2009)[5]进一步证实原虫、细菌和微生物的氨基酸组成存在一定的差异,细菌和微生物的Lys 含量高于原虫。6 月龄的生长母牛的瘤胃已基本发育,瘤胃微生物较丰富,已具备较强的消化功能[6],此时小肠的氨基酸便主要来源于瘤胃MCP 和日粮过瘤胃蛋白。但MCP 的氨基酸组成存在不稳定性,不能确定其是否满足生长母牛对氨基酸的需要,所以为保证生长,应增加进入小肠的日粮真蛋白中氨基酸的量。根据已知或预测的氨基酸适宜模型,通过向日粮中添加过瘤胃氨基酸来实现日粮氨基酸平衡,可减少瘤胃降解,提升小肠理想真蛋白量及氨基酸吸收率的有效方法。本研究基于以上研究背景,通过扣除理论氨基酸平衡组30%的Lys、Met 及Thr研究其对瘤胃发酵及微生物区系的影响,探究扣除日粮过瘤胃氨基酸水平是否会对6~9 月龄生长母牛瘤胃内环境产生影响,也为6~9 月龄生长母牛氨基酸适宜模式的建立提供理论支撑。
1 材料与方法
1.1 试验材料
试验采用氨基酸部分扣除法,选用Lys、Met 及Thr 3种过瘤胃氨基酸产品。其中过瘤胃Met(蛋氨酸羟基类似物,HMBi)购于安迪苏有限公司,Met 含量44.4%,过瘤胃率50%;过瘤胃Lys(RPLys)购于亚禾生物有限公司,Lys含量36%,过瘤胃率80%;过瘤胃Thr(RPThr)购于浙江康德权有限公司,Thr 含量40%,过瘤胃率90%。
1.2 试验设计与日粮
本试验于2017 年9 月~12 月在山东省银香伟业国际第三牧场开展。随机选取72 头(5.5±0.5)月龄、体重(200±9)kg 的荷斯坦生长母牛,按体重、日龄相近的原则分为4 组,每组18 头,每头为1 个重复。试验以Lys、Met及Thr的水平为试验因子,参照Wang等(1989)提出的氨基酸部分扣除法,采用单因素完全随机设计分为理论氨基酸平衡(PC)组、扣除30%Lys(PD-Lys)组、扣除30%Met(PD-Met)组和扣除30%Thr(PD-Thr)组。参照美国NRC(2001)中体重为250 kg的奶牛生长母牛日增重1 000 g的营养需要量配制基础全混合日粮(TMR)。在基础TMR 中分别添加3 种过瘤胃氨基酸以达到各处理组试验日粮氨基酸的水平。PC 组母牛日粮的氨基酸水平根据Zinn(1998)[7]等提出的生长牛Met 需要量公式METR=1.956+0.029 2×ADG×[268-(29.4×0.055 7BW0.75×ADG1.097)÷ADG]+0.112×BW0.75,按体重250 kg及日增重1 kg/d计算得到小肠Met需要量。并参照仔猪氨基酸适宜比例Lys∶Met∶Thr=100∶30∶65(Chung 等,1992)[8],确定Lys 及Thr 的添加量。PD-Lys、PD-Met和PD-Thr 组试验日粮中RP-Lys、RP-Met、RP-Thr 添加量分别比PC 组降低30%。各组TMR 的原料组成、营养水平及氨基酸水平如表1 和表2 所示。试验期105 d,前15 d为预饲期,正试期90 d。

表1 基础日粮组成及营养水平(干物质基础,%)
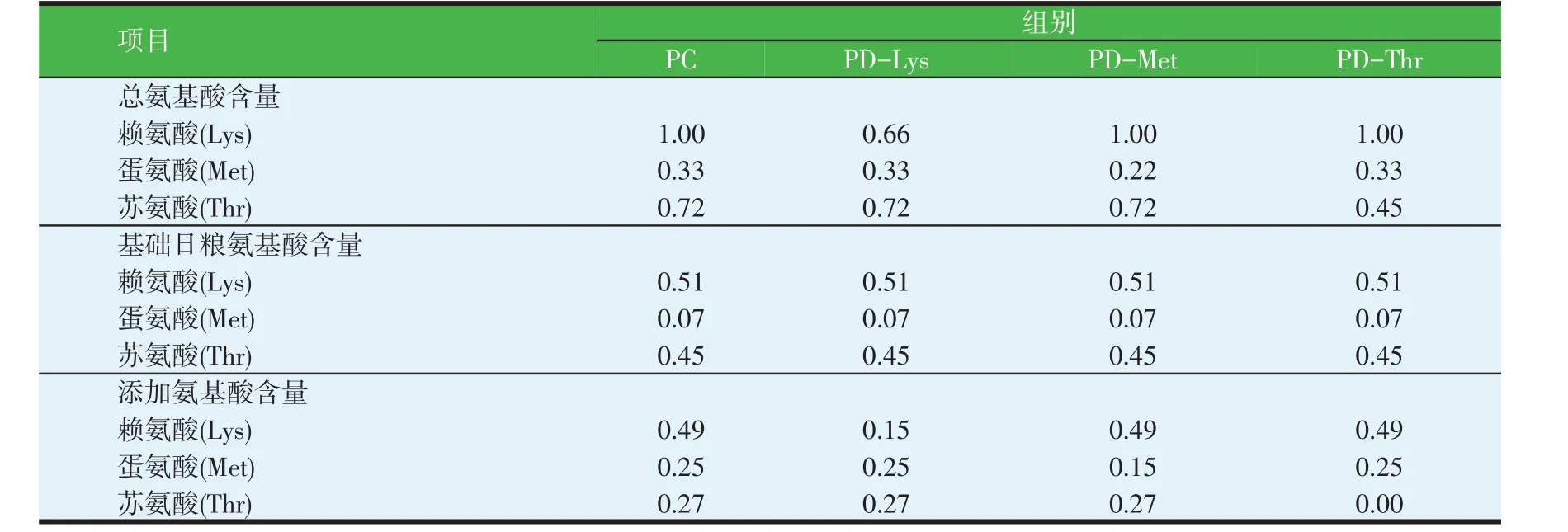
表2 试验日粮的氨基酸水平(干物质基础,%)
1.3 饲养管理
试验生长母牛均采用单栏单饲(每头牛3 m×2.2 m,铺有稻壳和发酵牛粪混合垫料),TMR 每日饲喂两次(8:00 和16:00),自由饮水,TMR 饲喂量根据采食量变化每30 d 调整1 次。各组氨基酸添加量根据生长母牛日增重及采食量变化每30 d 调整1次。所有试验牛均按牛场正常的免疫程序进行免疫,本次实验中,于正试期30 d 时全部牛注射布病疫苗。
1.4 样品采集和测定方法
正试期开始及结束当天晨饲后2 h,每组选取接近组平均体重的6头牛,采用灭菌口腔采样器采集瘤胃液,立即用便携pH计(Testo-206-pH2)测定瘤胃液pH值,分装于15 ml离心管及2 ml冻存管中,用于测定NH3-N、MCP及VFA等发酵参数以及瘤胃微生物相关指标。
1.5 统计方法
试验数据采用Excel 2016 进行初步整理,以SAS 9.4 软件进行统计分析。瘤胃微生物组成(门、属水平)采用单因素方差分析(one-way ANOVA)进行统计,差异显著时采用Duncan's进行多重比较。其余数据采用Mixed 模型进行分析,用LSD 法进行多重比较。统计结果以(P<0.05)表示差异显著,(0.05≤P<0.10)表示有差异显著的趋势。
2 结果与分析
2.1 瘤胃发酵参数
由表3 可知,4 个处理组间全期平均pH 值、NH3-N 浓度和MCP 含量均无显著差异。其中,瘤胃液pH值均在6.6~7.0 之间,7 月龄时,PD-Lys 及PD-Met 组瘤胃pH值显著高于PC组,但8及9月龄pH值各组间差异不显著(P>0.05);扣除3 种氨基酸对生长母牛瘤胃液NH3-N 浓度均没有显著影响(P>0.05);8 月龄时PD-Met 的MCP 浓度显著低于PC 组(P<0.05),9 月龄时PD-Met的MCP浓度与各组间比没有显著差异(P>0.05),数值上较PC组低。
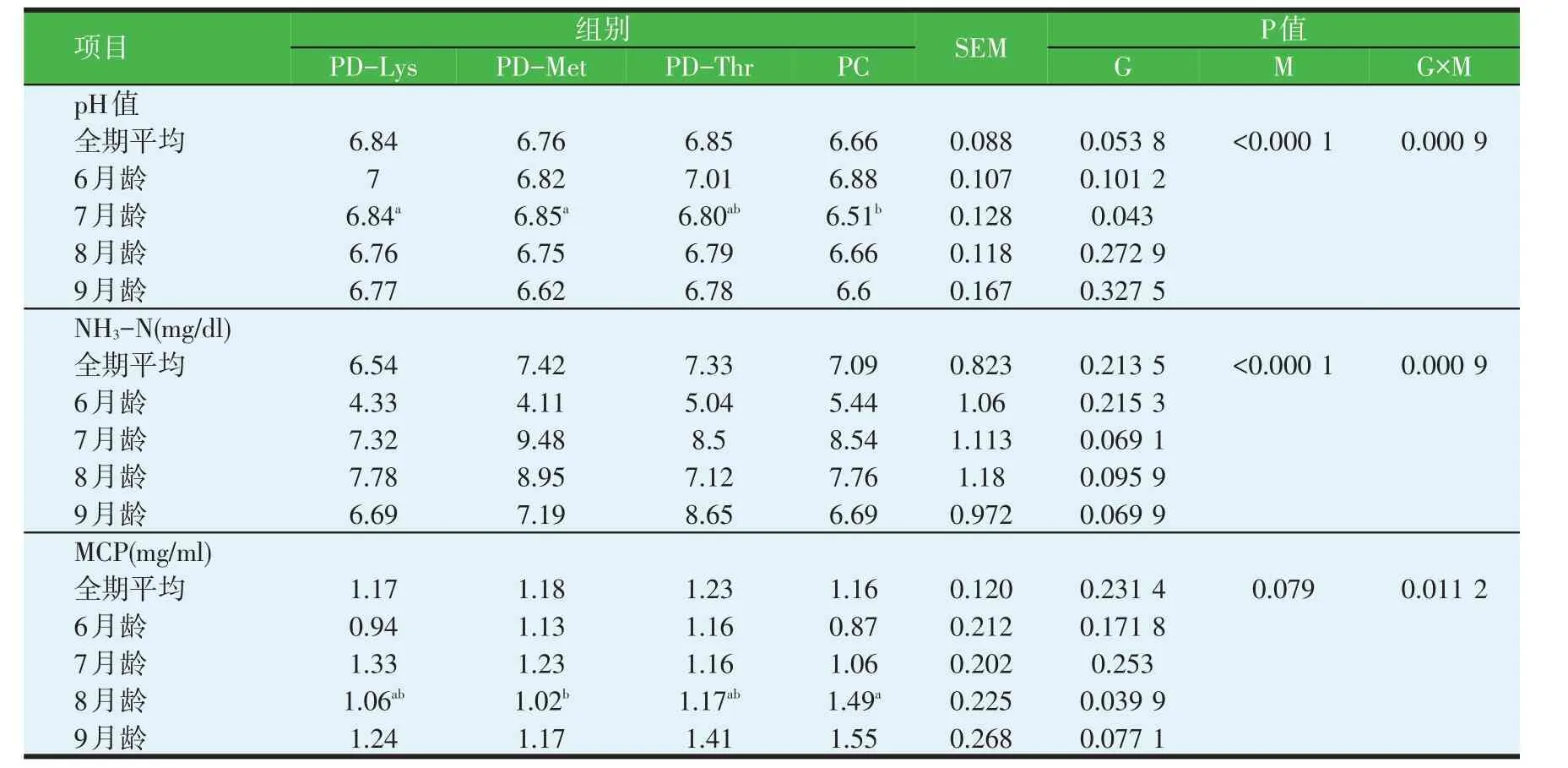
表3 部分扣除Lys、Met及Thr对6~9月龄生长母牛瘤胃发酵参数的影响
表4给出了试验期内各处理组瘤胃VFA的变化,其中PD-Met 组全期平均TVFA 浓度显著低于PC 组(P<0.05),7月龄时,PD-Lys及PD-Met组瘤胃TVFA浓度显著低于PC组(P<0.05);但9月龄时,各处理组间总VFA 浓度无显著差异(P>0.05)。9 月龄时,PD-Lys组、PD-Met 组及PD-Thr 组与PC 组相比,乙酸和丁酸占TVFA 的百分比均无显著差异(P>0.05)。但9 月龄时,PD-Met 组的丙酸含量显著高于PC 组(P<0.05),从而导致该组乙丙比显著低于PC 组(P<0.05);PD-Lys 组和PD-Thr 组的丙酸浓度较PC 组比无显著差异(P>0.05)。
2.2 瘤胃微生物区系
从表5 可知,扣除Met 后,瘤胃微生物Shannon、Ace 及Chao 指数全期平均值较PC 组显著下降(P<0.05),此外,PD-Met组9月龄时生长母牛瘤胃微生物Ace 及Chao 指数均显著低于PC 组(P<0.05),但扣除Lys 及Thr 未对生长母牛微生物多样性指数产生显著影响(P>0.05)。
图1 为对门及属水平的微生物丰度进行主成分分析的结果,发现在门及属水平上PD-Lys 组(Lys)、PD-Met组(Met)、PD-Thr组(Thr)及PC组在PCA图中距离相近,表明4 个处理组门、属水平的物种组成和丰富相似,差异较小未达到组间显著分离的程度。
在PCA分析的基础上,对门水平物种组成进一步分析(见图2)。结果表明,拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)及变形菌门(Proteobacteria)为9月龄生长母牛的3 种主要优势菌门。此外,PD-Lys(Lys)、PD-Met(Met)及PD-Thr(Thr)与PC 组相比,门水平各菌群组成均没有显著差异(P>0.05)。
图3给出了试验期内,9月龄生长母牛属水平的瘤胃微生物组成情况。结果表明,Prevotella_1 及Ruminococcus_2是主要优势菌属。扣除Met后,9月龄生长母牛瘤胃Prevotella_7 的丰度显著高于PC 组(P<0.05)。除此外,PD-Lys(Lys)、PD-Met(Met)及PD-Thr(Thr)与PC组相比,各菌群属水平微生物组成均没有显著差异(P>0.05)。

表4 部分扣除Lys、Met及Thr对6~9月龄生长母牛瘤胃挥发酸浓度的影响

表5 部分扣除Lys、Met及Thr对6~9月龄生长母牛瘤胃液微生物多样性的影响

图1 门(左)及属(右)水平物种组成主成分分析

图2 9月龄生长母牛瘤胃液微生物门水平组成(top 8)
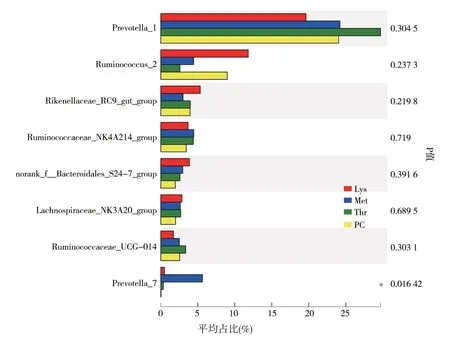
图3 9月龄生长母牛瘤胃液微生物属水平组成(top 8)
3 讨论
3.1 瘤胃发酵参数
瘤胃pH 值是酸碱调控水平的直接体现,影响着瘤胃健康及饲料的消化吸收。当pH 值在6.2~7.0 之间时,瘤胃微生物的活性最高[9]。瘤胃pH 值过高或过低时均会增加过瘤胃氨基酸在瘤胃内的降解,导致过瘤胃率的下降。本研究中瘤胃pH 值在6.8~7.0之间,能满足瘤胃微生物有较高的生物活性和过瘤胃要求。杨维仁等(2004)[10]向肉牛瘤胃投入RPMet,未发现pH 值的变化。Campbell 等(1997)[11]研究也发现,肉牛日粮中添加不同水平的混合氨基酸,对瘤胃pH 值没有影响。但在体外培养条件下,Lys 缺乏会导致培养液pH 值升高[2]。本研究中,7 月龄时Lys 及Met 扣除组pH 值和VFA 出现了显著变化的原因,可能是由于突然更换日粮和扣除蛋氨酸的刺激,影响了生长母牛的发酵,但随着试验周期的延长和对日粮的适应,生长母牛的瘤胃发酵又恢复稳定,8 月龄及9 月龄的pH 值没有出现显著变化,进一步说明添加或扣除过瘤胃氨基酸未达到影响生长母牛瘤胃酸碱调控的水平。
NH3-N 是合成瘤胃MCP 的主要氮源,浓度应不低于2.5 mg/100 ml[12]。本研究中,NH3-N 的浓度范围在4~11 mg/100 ml 左右,满足微生物合成MCP 的需要。韩继福等(2003)[13]研究表明添加RPLys并未改变奶牛的瘤胃内环境,对奶牛瘤胃NH3-N浓度没有显著影响。本研究中,扣除30%的Lys 及Thr 对本试验中NH3-N及MCP浓度未产生较显著的影响,可能原因是过瘤胃氨基酸瘤胃降解量较低,不足以影响到瘤胃液NH3-N的含量和MCP的合成量。另外,瘤胃液NH3-N浓度变化反映了微生物对蛋白的降解速度和瘤胃微生物对NH3-N 的利用速度。瘤胃微生物的N 代谢是循环过程,除利用NH3-N 合成MCP 外,近50%的MCP 也会被降解为NH3-N。所以也可能是MCP的降解和合成间的相互转化,导致了扣除30%的Lys及Thr后9 月龄生长母牛NH3-N 含量的相对稳定。燕磊(2005)[14]及Windschitl 等(1988)[15]的研究表明小尾寒羊日粮中添加蛋氨酸羟基类似物,对瘤胃NH3-N浓度和MCP 含量没有显著影响,但Firkins(2015)[16]和Va'zquez-Anon 等(2001)[17]通过研究发现添加蛋氨酸羟基类似物可打破Met不足对微生物生长的限制,增加MCP 的合成效率。本试验中使用的HMBi,50%可被瘤胃壁吸收,在特定酶的作用下转化为L-Met进入肝脏被代谢利用,余下的在瘤胃降解被瘤胃微生物利用,用于改善瘤胃内环境。本研究中扣除30%的Met后,NH3-N 浓度未出现显著变化,但MCP 合成量有降低的趋势,表明扣除HMBi 影响了MCP 的合成速率,但此过程可能并非通过影响瘤胃影响NH3-N 介导MCP的合成,而是直接由Met的量来调控瘤胃MCP合成代谢,也进一步说明Met是MCP代谢的限制性氨基酸。反刍动物氨基酸需要模式的研究,可以通过使用过瘤胃氨基酸来减少瘤胃蛋白的降解和调控MCP 合成量,保证到达小肠的真蛋白供应,以最终实现理想的氨基酸平衡模式[18]。Maiga 等(1998)[19]等指出过瘤胃氨基酸可提高使小肠代谢氨基酸量,使蛋白质利用率提高。本研究中,也是通过添加过瘤胃氨基酸产品来保证平衡组正常氨基酸水平,并在其基础上扣除相应的过瘤胃氨基酸。从本研究生长母牛瘤胃pH 值、NH3-N及MCP浓度看,扣除过瘤胃氨基酸并未对瘤胃发酵产生较大影响,虽然扣除RPMet后MCP合成量有降低趋势,但不显著,表明小肠吸收的蛋白差异可能并非主要来自于MCP,而是来源于日粮蛋白。Noftsger 等(2005)[20]的研究也指出到达瓣胃中的N 不受来源于微生物N 的影响。但瘤胃微生物间的复杂关系使MCP 的氨基酸含量并不固定,不能确定MCP 合成量与其氨基酸组成的关系,所以本研究中MCP 的氨基酸组成是否对到达小肠的氨基酸量有影响有待进一步确定。
在理论氨基酸平衡组的基础上,扣除瘤胃保护Lys、Met 及Thr 对本研究中的瘤胃TVFA 浓度没有显著影响。这与Campbell 等(1997)[11]、杨维仁(2004)[10]及Robinson等(2000)[21]提出的日粮过瘤胃Lys水平对肉牛瘤胃VFA 浓度没有影响基本一致。可能是由于Lys和Thr过瘤胃率较高,对瘤胃乙酸及丙酸的影响程度均较小,虽然丙酸浓度有所改变,但未出现显著差异。相较于其余2 种氨基酸,过瘤胃HMBi 过瘤胃率较低,瘤胃降解部分较多,其水平的降低对瘤胃丙酸浓度和乙丙比的影响显著。Noftsger 等(2003)[22]研究表明添加蛋氨酸羟基类似物后未影响瘤胃液TVFA含量,但丙酸浓度降低。本研究结果与之类似,蛋氨酸羟基类似物水平降低导致瘤胃丙酸浓度升高,乙丙比下降。但蛋氨酸羟基类似物影响VFA 的原理尚不明确,因为HMBi 在瘤胃水解过程中除生成Met 类似物外,还会产生异丙醇,而异丙醇对瘤胃发酵是否会产生影响还未见报道。有学者提出可能是其通过影响瘤胃微生物的作用,从而影响了瘤胃发酵,但具体机制仍不清楚,还需进一步探究。
3.2 瘤胃微生物区系
瘤胃内的发酵过程无法由单一菌完成,需多种细菌、微生物间相互协调,共同作用于饲料底物,所以瘤胃微生物的密度及多样性尤为重要[23]。日粮和月龄是影响瘤胃微生物的两个主要因素。本研究中,微生物多样性指数随月龄变化较大,也表明了随月龄生长,瘤胃发育趋于成熟,瘤胃微生物趋于丰富。不同的氨基酸模式会引起微生物区系发生变化,进而使得微生物氨基酸组成发生变化[24]。本研究中,扣除Lys及Thr 对瘤胃优势菌群也没有显著影响,表明瘤胃可降解的部分的Lys 及Thr 较少,不足以影响瘤胃微生物区系及优势菌群的结构,因而未对瘤胃发酵产生显著影响。相较于Lys 和Thr,HMBi 的瘤胃降解部分较高,扣除30%的Met 后Ace 及Chao 指数显著低于氨基酸平衡组,表明扣除Met 影响了瘤胃微生物的丰富度,但从门水平菌群分布看,扣除Met 对瘤胃微生物组成并没有显著影响。Karnati 等(2007)[25]指出添加HMBi 对瘤胃微生物总数和分布没有产生显著影响,同时也发现瘤胃和小肠微生物的微生物PCR 条带分布有相似性[26]。Met 是瘤胃微生物生长的必须氨基酸,有促进瘤胃微生物生长的作用[27],其含量高低会刺激瘤胃分解菌的生长。普雷沃氏菌属是目前已知蛋白分解活性最强的瘤胃菌株之一[28],其生长需要Met,Met缺少会抑制普雷沃氏菌的生长[29]。但在本研究中,扣除Met后,Prevotella_7丰度反而增加,可能是为了加强蛋白分解代谢,以补充Met 的不足。Met 对Prevotella_7含量影响的原因和机理尚未见报道,可能需要进一步探索Met、瘤胃丙酸发酵与瘤胃普雷沃氏菌属间的关系。
4 小结
在理论氨基酸平衡组的基础上扣除30%的过瘤胃Lys 及Thr 对瘤胃pH 值、NH3-N 浓度、MCP 含量及总VFA 浓度未产生显著影响,Lys 和Thr 过瘤胃率较高,未影响瘤胃微生物的N 代谢,进一步说明扣除过瘤胃氨基酸引起的小肠的氨基酸含量差异不受MCP影响,主要受日粮氨基酸水平差异影响。本研究中扣除Met 抑制了瘤胃微生物的生长,MCP 合成量下降,而且Met水平的降低会引起Prevotella_7丰度增加,丙酸比例升高,表明蛋氨酸羟基类似物在瘤胃内的降解部分会影响瘤胃微生物的生长及代谢,但机理和机制尚不清楚,需要进一步探究。此外,MCP 含量和微生物种类是否对MCP 的氨基酸组成有影响也需进一步验证。

