不同生育期饲料油菜体外发酵特性的研究
■王洪超 穆春玲 刘大森 辛杭书 李忠秋 刘春龙
(1.中国科学院东北地理与农业生态研究所,黑龙江哈尔滨150081;2.珲春市动物卫生监督所,吉林珲春133300;3.珲春市英安镇畜牧兽医站,吉林珲春133300;4.东北农业大学动物科技学院,黑龙江哈尔滨150030;5.黑龙江省农业科学院畜牧研究所,黑龙江哈尔滨150086)
体外发酵技术是模拟瘤胃液对饲料进行体外发酵培养,体外培养环境接近瘤胃内发酵环境。运用此方法的最大优点就是不受试验动物的条件限制,可以很容易的在常规实验室条件下进行,因此得到了广泛的应用。油菜含有双高既高芥酸和高硫代葡萄糖甙这两种物质,导致其含有辛辣味而且如果畜禽过量采食,会引起新陈代谢紊乱引发甲状腺肿大。甚者导致家畜死亡[1]。经过研究,传统油菜改良成含有低芥酸、低硫代葡萄糖甙的油饲兼用品种,又名饲料油菜。饲料油菜具有生长快、产量高的特点,平均鲜草产量为49 747.5 kg/hm2,最高可达74 550 kg/hm2[2],饲用增重效果明显[3]。其蛋白含量为25.6%,粗脂肪2.4%[4],营养价值很高。可以作为优质的青粗饲料[5]。饲料油菜的耐寒性很强[6],易于推广,在晚秋种植,既能延长青绿饲料供给期还能解决牧草生产的季节性与家畜对营养需求的相对均匀性之间存在的供求矛盾[7]。前期试验得到饲料油菜的不同生育时期营养成份,见表1。本试验在前期试验基础上,研究不同生育期饲料油菜的体外发酵特性,旨在为生产中饲料油菜合理的利用提供参考数据。

表1 不同生育期的饲料油菜常规营养成分(%,绝干基础)
1 材料与方法
1.1 试验基地情况
本试验的种子由华中农业大学提供,为“华油杂62”。种植地位于黑龙江省海伦市(45°58′~47°52′N,126°14′~127°45′E),最高气温达37.7 ℃,最低气温达-40.3 ℃,平均气温在2 ℃左右。年均降水量为500~600 mm,主要集中在5~9月份。无霜期在120 d左右,终霜期多在5月中下旬开始。年日照达2 600~2 800 h。
1.2 试验样品准备
饲料油菜分别在现蕾期、盛花期和结荚期进行采集,保证全株距离地面3 cm 刈割。在保证饲料油菜全株的情况下,每个生育期样品分别随机选取3 个代表性样方。样品在105 ℃、15 min 的烘箱内进行杀青处理,接着进行风干样制备,条件控制在65 ℃、48 h。最后样品进行粉碎过1 mm 筛,密封袋保存备用。
1.3 试验动物条件
试验选用3 头体重在(500±50)kg 的中国荷斯坦奶牛,年龄在3.5 岁并装有永久性瘤胃瘘管。在东北农业大学阿城试验基地(45°31′N、127°02′E)实验室内进行体外发酵试验。试验牛饲养按1.3 倍维持水平,日粮精粗比为45∶55。日粮主要成分见表2。保证自由饮水,早6:00和晚18:00饲喂。
1.4 瘤胃液采集
瘤胃液采集工作在早6:00 饲喂结束后开始,保证采集是在瘤胃内的5个不同位点,并将采集到的瘤胃液迅速装入保温瓶内,盖好瓶盖备用。保温瓶应事先39 ℃预热并通入二氧化碳(C02)置换出瓶内的空气。最后将采集到的瘤胃液充分混合后经4 层纱布过滤处理。

表2 基础日粮配方及营养水平(风干基础)
1.5 体外发酵液的配制
1.5.1 缓冲液的配制
体外发酵的培养基按照Menke 等[8]的方法配制,缓冲液需要微量元素A 液、缓冲液B 液、常量元素C液、刃天青溶液D液、还原剂溶液E液,各溶液配方如表3所示。

表3 缓冲液各溶液的配方
1.5.2 人工瘤胃微生物营养培养液的配制
人工瘤胃微生物营养培养液需现用现配,按照下列比例和顺序配制人工瘤胃微生物营养培养液:蒸馏水400 ml+A 液0.1 ml+B 液200 ml+C 液200 ml+刃天青溶液1 ml+还原剂溶液40 ml。当加入刃天青溶液后混合液变为红色,马上将配制好的培养液里通入CO2气体并预热至39 ℃,持续时间约30 min 后,培养液颜色变淡至无色。
1.5.3 混合培养液的配制
将过滤处理的瘤胃液和人工瘤胃微生物营养培养液按1∶2的比例混合,配制足量的混合培养液,此混合培养液接近瘤胃内发酵环境。
1.6 试验发生配制和体外发酵装置
由恒温水浴摇床和培养单位装置构成体外发酵装置。恒温水浴摇床的工作条件为39 ℃;培养单位是带有100 ml刻度的玻璃注射器,并在注射器活塞管上涂抹少量石蜡的方法,来防止漏气和减少阻力。
本试验选用现蕾期、盛花期和结荚期的饲料油菜为3个试验样,在每个注射器内分别放入200 mg试验样,并用注射器准确吸取30 ml 的混合培养液。同时设置空白对照组作为气体校正。将封闭好的发酵注射器全部转入39 ℃恒温摇床进行体外发酵。
1.7 测定指标和方法
分别在2、4、8、12、24、36、48 h 和72 h 进行产气量的测定;在4、12、24、48 h和72 h后取出各组发酵培养液,冷冻保存用于测定NH3-N 含量和VFA 的各组分含量。其中产气量由刻度注射器直接读出。产气量利用SAS9.1 程序,根据Ørskov 和McDonald 的产气模型公式将各组样品在2、4、8、12、24、36、48 h和72 h时间点的产气量代入,计算消化动力参数。NH3-N通过标准曲线绘制来测定。VFA通过气象色谱测定。
1.8 数据处理
用Excel 2003 整理数据和结果换算。用SAS9.1版软件进行方差统计分析,均值多重比较采用Duncan's法,以P<0.05作为差异显著性判断标准。
2 结果与分析
2.1 不同生育期饲料油菜对体外发酵产气量的影响
如表4 所示,随着培养时间的延长,不同生育期饲料油菜体外发酵累计产气量呈递增趋势;培养48 h以前的阶段,气体增加较快,之后产气量变化较平缓,但结荚期在最后的48~72 h产气量增加波动较大。其中现蕾期和盛花期在整个发酵过程中产气曲线趋势基本吻合。72 h 的累计产气量表现为现蕾期显著高于盛花期和结荚期(P<0.05),盛花期高于结荚期,但差异不显著(P>0.05)。随着饲料油菜生育期的增长,理论最大产气量有递减的趋势,但各组之间差异不显著(P>0.05),这与李富娟等[9]研究结果一致。产气速度有随着生育期的增长而增大的趋势(P>0.05)。结荚期的产气延滞期显著低于盛花期(P>0.05)和现蕾期(P<0.05)。
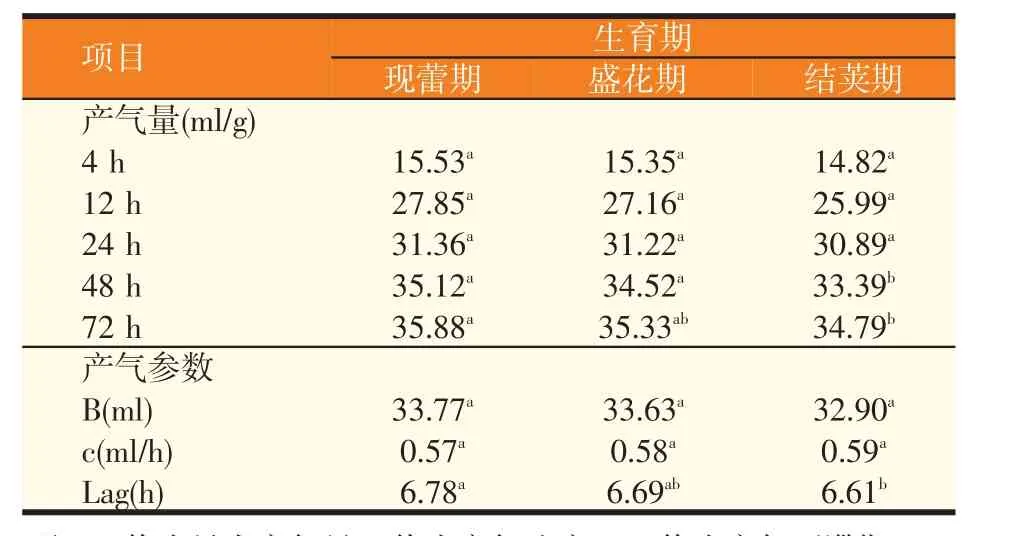
表4 不同生育期饲料油菜对体外产气量及产气参数的影响
2.2 不同生育期饲料油菜对体外发酵NH3-N含量的影响

表5 不同生育期饲料油菜体外培养对NH3-N含量影响(mg/dl)
由表5可知,各组培养液NH3-N浓度随着体外培养时间的延长而逐渐增加。在12~48 h 内,各生育期体外发酵产生的NH3-N增加显著,其中盛花期NH3-N浓度最高。在培养24 h时,NH3-N浓度由高到低依次是盛花期、现蕾期、结荚期(P<0.05)。48 h以后,NH3-N 浓度增加缓慢。在72 h 时盛花期NH3-N 浓度显著高于结荚期(P<0.05),高出3.25 mg/dl。
2.3 不同生育期饲料油菜对体外发酵VFA 含量的影响
如表6 所示,体外培养72 h 后,不同生育期的各VFA 含量变化规律相似,在4~12 h 呈升高趋势,12~24 h有所下降,24 h~48 h逐渐回升。在4 h时间点,现蕾期的乙酸浓度显著高于盛花期(P>0.05)和结荚期(P<0.05),但盛花期和结荚期差异不显著(P>0.05),12 h以后,不同生育期的乙酸浓度差异不显著(P>0.05);在12、24 h和72 h时间点,盛花期丙酸和丁酸浓度最低,但差异不显著(P>0.05);乙酸与丙酸比值的结果表明,4 h时间点现蕾期显高于结荚期(P<0.05),但不显著高于盛花期(P>0.05),在72 h时间点,盛花期显高于结荚期(P<0.05),但不显著高于现蕾期(P>0.05)。

表6 不同生育期饲料油菜对瘤胃体外发酵VFA含量的影响
3 讨论
3.1 不同生育期饲料油菜对体外发酵产气量的影响
在一定时间内,体外发酵累计产气量的多少可以反映出发酵底物中碳水化合物被瘤胃微生物利用的程度,同时发酵底物营养价值的高低也影响产气量。目前预测干物质降解率的最主要指标是体外发酵产气方法[10]。Clark 等[11]指出有机物含量越多会影响瘤胃内微生物活性,从而使产气量多,换言之,饲粮中可发酵的有机物含量和产气量之间存在正相关。本试验结果表明,随着饲料油菜生育期的延长,其体外发酵产气量逐渐下降,这可能是植物的次生细胞壁中不易降解的纤维素和木质素多的原因。随着植物的生长越来越成熟,植物细胞壁成分会由易溶性的初生细胞壁成分转化为不易溶的成熟次生细胞壁[12]。饲料油菜的结荚期含有较高的中性洗涤纤维、酸性洗涤纤维和木质素。试验结果可以看出体外发酵累计总产气量与CP 含量呈正相关,与ADF、NDF 含量呈负相关。这与汤少勋等[13]和Nsahlai等[14]研究结果一致。
3.2 不同生育期饲料油菜对体外发酵NH3-N含量的影响
瘤胃的氮代谢受瘤胃液中NH3-N 浓度的影响,NH3-N 浓度主要受来自瘤胃微生物对氮利用速度和饲料含氮物质在瘤胃降解速率间动态平衡的影响,NH3-N 浓度的高低可反映出瘤胃微生物生成菌体蛋白和饲料日粮中蛋白质降解的情况[15],在特定日粮组成模式下,NH3-N浓度一定程度上反映了蛋白质合成与分解间达到的平衡状态[16]。体外发酵底物中蛋白质的含量、理化特性和降解速率以及发酵底物含氮物和能量载体物的比例等都会影响体外发酵体系中NH3-N浓度,特别是微生物菌体蛋白的合成速率与微生物降解的影响[17]。在一般情况下,都会产生氮的损失和饲料蛋白质的浪费,因为氨的产生速率远超过微生物对他的利用的速率,过量的氨以尿素形式排出体外。本试验NH3-N 浓度在瘤胃微生物生长所需最佳NH3-N 浓度5~28 mg/dl[18]的范围内。试验表明,NH3-N浓度随着体外培养时间的延长,各生育期饲料油菜的累计NH3-N 产量逐渐提高,在48 h 以后,NH3-N 产生速率开始降低,这与程茂基[19]研究结果一致。由于体外发酵底物只有牧草,能量供应不足,瘤胃内微生物在利用氨合成蛋白质的过程无法获得充足能量,导致NH3-N 的积累增加[20]。72 h NH3-N 浓度表现为盛花期显著高于现蕾期和结荚期(P<0.05)。随着生育期的增长,NH3-N 呈降低趋势,与余苗[21]试验结果一致;整个过程,NH3-N 与CP 有正相关关系,与ADF 和NDF有负相关关系,这与Cone等[22]、甘洁[23]和余苗等[24]的研究结果相符。原因可能是,可利用粗蛋白的含量会随着植物生育期的增长而减少,相反细胞壁中的半纤维素、纤维素以及木质素等不可利用部分含量增加,引起消化率下降。饲料蛋白的降解是瘤胃内大部分NH3-N的直接来源,通过测定瘤胃内NH3-N浓度可反映出牧草中蛋白的瘤胃降解特性。NH3-N浓度高低,可以得出蛋白质降解的多少,因此NH3-N浓度含量是评价饲料品质的主要指标之一。本试验结果可以看出结荚期饲料油菜没有现蕾期和盛花期饲料油菜理想。
3.3 不同生育期饲料油菜对体外发酵挥发性脂肪酸含量的影响
挥发性脂肪酸(VFA)是能量代谢的主要能量来源,反刍动物瘤胃中的碳水化合物经微生物作用发酵所产生的VFA 主要包括乙酸、丙酸、丁酸、异丁酸、异戊酸等,其中前三种酸占能源物质的80%。反刍动物乳脂合成的主要前体物质是乙酸[25],葡萄糖合成的主要底物是丙酸,乙酸/丙酸可以间接反映能量利用率的情况。饲草中的不可利用部分,比如半纤维素、纤维素和木质素的含量,会影响瘤胃发酵产生乙酸的含量[21],而纤维素的降解率对乙酸含量的影响更大[26]。本降解试验得出盛花期的NDF有效降解率和NDF快速降解部分大于其他时期,所以72 h发酵试验得出盛花期的乙酸浓度最高(P>0.05)。乙酸/丙酸的值在3以下属于丙酸型发酵,而在3 以上为乙酸型发酵。本试验不同生育期的各时间点乙酸比丙酸的值都大于3。结果说明,饲料油菜的不同生育期发酵类型均趋于乙酸类型。Slianikove 等[27]研究表明单宁可抑制微生物活性,试验发酵72 h以后,盛花期的乙酸/丙酸比值显著高于结荚期(P<0.05),可能是盛花期饲料油菜单宁含量较低的原因,对瘤胃微生物的某些菌群的抑制作用较弱,这与李占明等[28]和马敏等[29]研究规律一致。Wang 等[30]和Ngamsaeng 等[31]研究表明单宁含量对乙酸/丙酸存在影响。
4 结论
随着体外发酵时间的延长,最大产气量逐渐降低,表现出现蕾期最高,结荚期最低;发酵72 h,盛花期的NH3-N浓度、乙酸浓度和乙酸/丙酸浓度最高,结荚期最低。盛花期的饲料油菜发酵效果较好。

