GC-MS测定动物组织中五氯酚钠的不确定度评定
宋迎春,袁娅,王艳敏,周鸿
(江西省疾病预防控制中心,江西省食源性疾病诊断溯源重点实验室,江西 南昌330029)
五氯酚(PCP)是一种有机氯农药,常见的形式为五氯酚及其钠盐,主要作为杀虫剂、灭菌剂、除草剂及木材防腐剂使用,我国很多区域环境介质中均检出有五氯酚钠残留[1-3]。五氯酚可通过吸入、食入和经皮吸收等途径进入体内,并在体内产生蓄积[4-6]。研究表明,五氯酚对人体造成的毒性有急性中毒[7]、生殖毒性[8,9]、致畸毒性[10]、遗传毒性[11-13]、细胞毒性[14,15]、免疫毒性[16,17]等,五氯酚是包括我国在内的许多国家环境优先监测污染物之一,国际癌症研究机构(IARC)也将五氯酚列为第Ⅰ类致癌物。2008年,原国家环保总局将PCP列为“高污染、高环境风险”产品[18]。
依据新版CNAS-CL01:2018《检测和校准实验室能力认可准则》中7.6“测量不确定度的评定”要求,开展检测的实验室应评定测量不确定度。本研究依据JJF 1059.1-2012《测量不确定度评定与表示》技术规范[19],借鉴本实验室化学分析不确定度评定方法[20],拟建立GC-MS测定动物组织中五氯酚钠的不确定度评定方法。通过对测量过程和测量系统的深入分析研究,识别不确定度来源,列出影响测定结果的不确定度因素,同时计算各标准不确定度分量和相对扩展不确定度,最后评估各分量对合成不确定的相对贡献,从而为GC-MS内标法测定动物组织中五氯酚钠的不确定度评定提供参考。
1 材料与方法
1.1 材料与试剂 五氯酚标准储备液(100μg/ml)(农业部环境保护科研监测所);2,4-二溴酚(德国Dr公司);正己烷、乙酸乙酯、乙腈和丙酮(色谱纯,德国Merk公司);吡啶和碳酸钾(分析纯,国药集团);乙酸酐(分析纯,西陇科学);三氯乙酸(分析纯,科密欧公司);SLC固相萃取小柱(500mg/6ml,杭州福裕科技服务有限公司)。
1.2 仪器与设备 7890B-7000C气相色谱-质谱联用仪(美国 Agilent公司);SORVALL LYNX6000 高速冷冻离心机(美国Thermo);AH-30匀浆机(上海睿科)。
1.3 仪器条件 色谱条件:色谱柱:DB-5MS(30m×0.25mm×0.25μm);柱温:初温 80℃,保持 2min,以10℃/min升至 250℃,290℃后运行 4min;进样口温度:230℃;载气流速:1.0ml/min;进样方式:不分流进样;进样量:1μl。质谱条件:电离方式:EI源,70eV;离子源温度:230℃;传输线温度:250℃;溶剂延迟:10min;扫描方式:选择离子扫描(SIM);五氯苯乙酸酯(五氯酚)定性离子 264、268、308,定量离子:266;内标 2,4-二溴苯乙酸酯(2,4-二溴酚)定性离子 250、254,定量离子:252。
1.4 样品前处理 参照《2018年国家食品污染物和有害因素风险监测工作手册》。
步骤1:称样:称取猪肉、鸡肉等动物组织5.00g 绞碎样品入离心管内,加入 30μl 10.0μg/ml 2,4-二溴酚内标液。
步骤2:提取:上述样品中加入5%三氯乙酸溶液进行匀浆,加入10ml提取液(乙酸乙酯:正己烷=1:9,V/V)提取,提取液离心后,取上层有机相氮吹干,加入乙腈复溶后再离心。
步骤3:净化:SLC固相萃取柱活化后,取步骤2离心后的复溶液过柱并洗脱收集,洗脱液氮吹至0.5ml左右。
步骤4:衍生:步骤3残余物中加衍生溶剂(乙酸酐:吡啶=1:1,V/V)0.2ml进行衍生后,加 1ml正己烷提取,再加碳酸钾溶液静置分层,取上层有机相供GC-MS测定。
步骤5:取0.25ml五氯酚标准储备液(100μg/ml)用色谱纯丙酮稀释至 25ml,得到 1.0μg/ml使用液。 再取 10μl、25μl、50μl、100μl、200μl五氯酚标准使用液 (1.0μg/ml), 分别加入 30μl 10.0μg/ml 2,4-二溴酚内标液,同步骤4进行衍生反应。
步骤6:在相同条件下分别测定标准溶液和样品溶液,制作工作曲线。
步骤7:利用工作曲线,按以下公式计算样品中五氯酚钠含量X。五氯酚钠含量测量结果由2次测量的平均值给出。
1.5 计算公式 利用GC-MS方法测定五氯酚钠含量X的表示式为:
式中:X—样品中五氯酚钠含量,μg/kg;
c—从标准曲线中得到的样品溶液中五氯酚含量,μg/L;
V—试样溶液的定容体积,ml;
m—试样质量,g;
1.08—五氯酚转化成五氯酚钠系数。
2 结果与分析
2.1 不确定度来源分析 根据 CNAS-CL01:2018《检测和校准实验室能力认可准则》要求,实验室应识别测量不确定度的贡献,评定测量不确定度时,应采用适当的分析方法考虑所有显著贡献。根据JJF 1059.1-2012[19]技术规范,合成标准不确定度组成包括A类标准不确定度和B类标准不确定度。测量重复性引入的标准不确定度分量采用A类评定方法;标准物质定值、拟合校准曲线、移液器、容量瓶、温度变动、天平和GC-MS仪器等因素引入的标准不确定度分量采用B类评定方法。其它诸如内标物质定值和配制过程引入的不确定度对本实验影响较小,故本文未做讨论。本方法不确定度来源主要组成见图1。

图1 不确定度主要来源分析
2.2 不确定度分量评定
2.2.1 A类标准不确定度UArel评定 在重复性条件下,对同一试样从取样开始独立重复测量7次,测量数据见表1。
方法规定,五氯酚含量由2份样品的测量结果平均值给出为X=3.65μg/kg,所以五氯酚含量测量重复性引入的相对标准不确定度UArel为
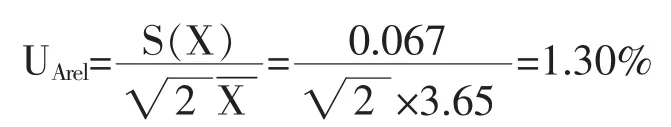
2.2.2 B 类标准不确定度 UBrel评定
2.2.2.1 体积V的标准不确定度评定 容量瓶引入的体积V标准不确定度分量UB1rel(V)实验过程用到25ml容量瓶对五氯酚储备液进行稀释,根据JJG 196-2006《中华人民共和国国家计量检定规程常用玻璃量器》[21]制造商提供的A级容量瓶在20℃时的体积为 25±0.04ml,假设为三角形分布,包含因子 kB1(V)=。由此引入的相对标准不确定度 UB1rel(V)为

表1 7份试样五氯酚含量独立重复测定结果

温度引入的体积V标准不确定度分量UB2rel(V)容量瓶已在20℃校准,而实验室的温度在(20±5)℃之间变化。丙酮的体积膨胀系数为 1.43×10-3℃-1,服从均匀分布,区间半宽度为 5℃×1.43×10-3℃-1=7.15×10-3,包含因子 kB2(V)=,由此引入的相对标准不确定度 UB2rel(V)为
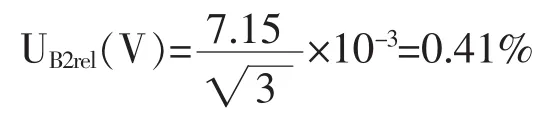
移液器引入的体积V标准不确定度分量UB3rel(V)配制五氯酚使用液时,需要用量程100-1000μl的移液枪移取储备液,根据检定证书,这支移液枪的相对误差为0.4%,假设为三角分布,kB3-1(V)=,因此移取250μl溶液产生的相对标准不确定度 UB3-1rel(V)为

配制五氯酚工作曲线时需要用量程
10-100μl和20-200μl的移液枪移取使用液,根据检定证书,两支移液枪的相对误差分别为1.4%和2.8%,假设为三角分布,kB3-2(V)=,因此移取10μl、25μl、50μl、100μl、200μl溶液产生的相对标准不确定度分别为 0.57%、0.57%、0.57%、0.57%、1.14%。移液枪引入的不确定度分量互不相关,采用方和根方法合成:
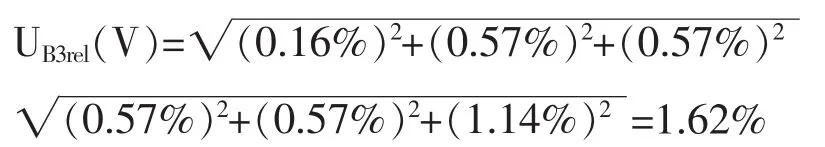
体积 V的 3个不确定度分量 UB1rel(V)、UB2rel(V)和 UB3rel(V)互不相关,采用方和根方法合成
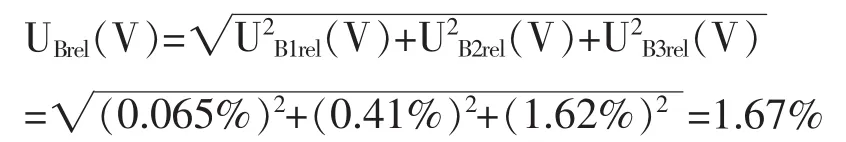
2.2.2.2 标准物质定值 W 的不确定度 UBrel(W)评定由标准物质证书可知,五氯酚不确定度为0.08μg/ml,假设服从均匀分布,包含因子kB(W)=,由此引入的相对标准不确定度UBrel(W)为

2.2.2.3 拟合校准曲线 C 的不确定度 UBrel(C)评定校准曲线采用5个浓度的标准溶液拟合,每个浓度均进行3次平行试验,共n=15个校准点,校准曲线公式为Ai=a+bCi
式中,Ci为标准溶液的浓度,μg/ml;Ai为标准溶液浓度Ci的峰面积与内标峰面积的比值;a为截距;b为斜率。由实验数据计算给出斜率、截距和相关系数如下
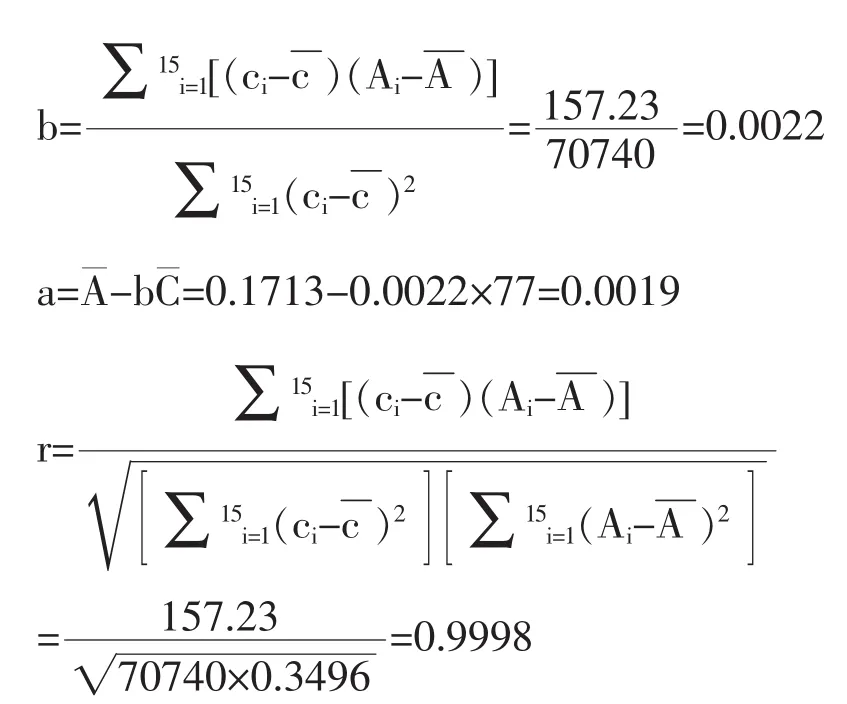
Ai=a+bCi=0.0019+0.0022Ci
对试样进行2次(m=2)平行测量,得到平均峰面积比A0和平均试样浓度C0为


回归的标准偏差
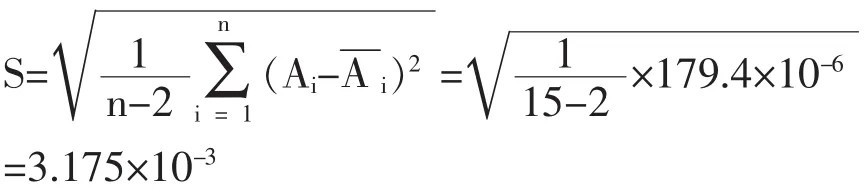
由此可计算出最小二乘法拟合校准曲线引入的相对标准不确定度UBrel(C)为

2.2.2.4 仪器 I的不确定度 UBrel(I)评定 天平引入的标准不确定度UB1rel(I)评定 电子天平经检定合格,由天平检定证书可知其最大允许误差为±1.5mg,服从均匀分布,包含因子 kB1(I)=。由此引起的相对标准不确定度UB1rel(I)为
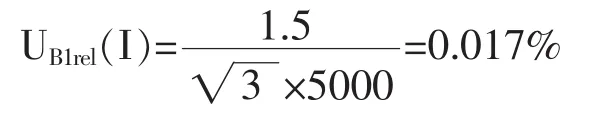
GC-MS引入的标准不确定度UB2rel(I)评定 由GC-MS检定证书可知,取包含因子kB2(I)=2时,GC-MS的相对扩展不确定度为4%。由此引起的相对标准不确定度 UB2rel(I)为

仪器I的2个不确定度分量UB1rel(I)和UB2rel(I)互不相关,采用方和根方法合成
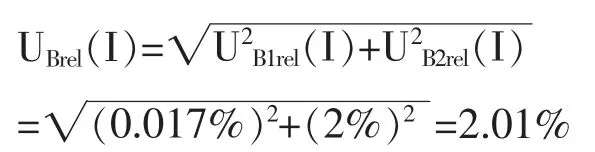
2.2.2.5 合成B类不确定度 本实验过程中各B类不确定度分量互不相关,综合以上分量结果,采用方和根方法合成B类标准不确定度
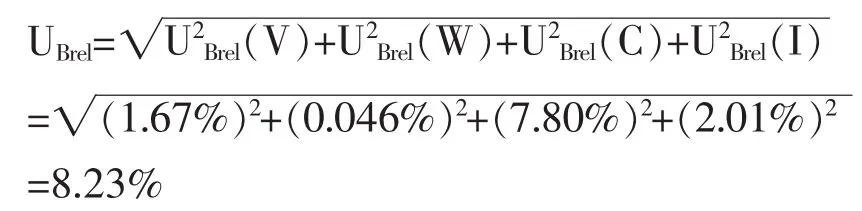
2.3 相对合成标准不确定度评定 将A类和B类标准不确定度采用方和根方法合成,计算五氯酚钠含量的相对合成标准不确定度

2.4 相对扩展标准不确定度评定 取包含因子k=2,包含概率P≈95%,则样品中五氯酚钠含量测量结果的相对扩展不确定度Urel为
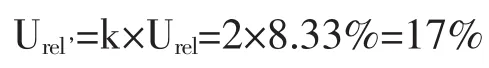
2.5 五氯酚钠含量测量结果及其不确定度报告五氯酚钠含量测量结果由2份试样的平均值给出为X=3.68μg/kg。五氯酚钠含量测量结果的相对扩展不确定度Urel=17%,由合成标准不确定度乘以包含因子k=2给出,提供P≈95%的包含概率。见表2。
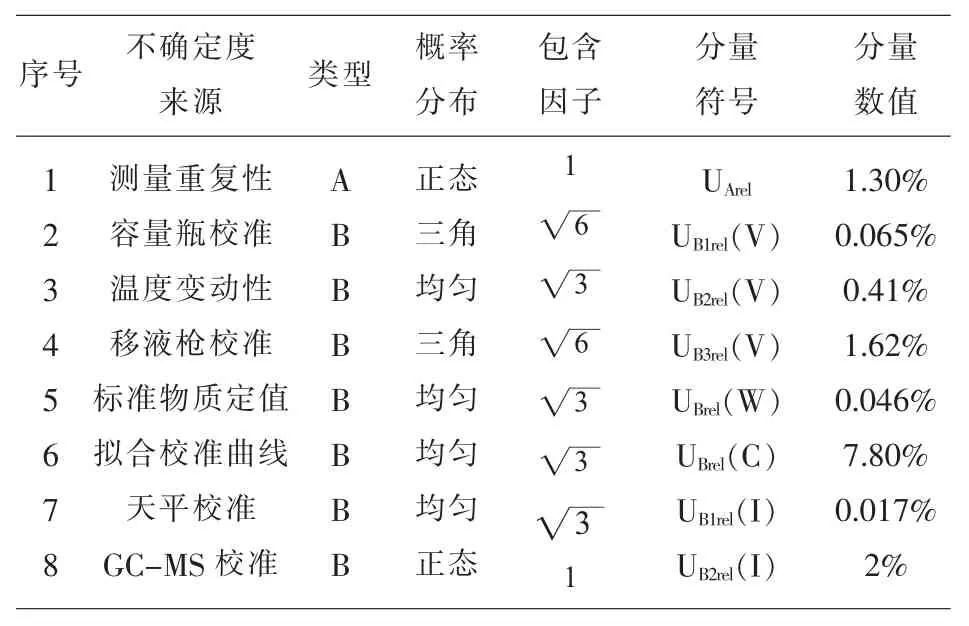
表2 五氯酚钠含量X测量结果的不确定度分量汇总表
3 讨论
本文通过对GC-MS法测定动物组织中五氯酚钠的不确定度进行评定,通过较全面的分析检测过程中的不确定度来源,计算各不确定度分量,从表2来看,拟合工作曲线对本实验过程不确定贡献最大,占58.8%,这与多数评定气相色谱法测量过程不确定度的研究结果一致;其次是GC-MS、移液枪校准和测量重复性引入的不确定度对评定结果的影响, 分别占 15.1%、12.2%和 9.8%。 容量瓶、温度、标准物质和天平等因素对不确定度贡献相对较小。建议通过增加样品和标准曲线每个浓度的测定次数、提高检验人员的操作规范性和熟练程度等措施来降低测量不确定度,提高结果的准确性和可靠性。

