原发性肝癌患者术前评估凝血状况的临床意义
陈玉娟
(福建医科大学附属肿瘤医院输血科,福建 福州 350014)
原发性肝癌(primary hepatocellular carcinoma,PHC)是常见的恶性肿瘤,发病率高,预后差,我国每年原发性肝癌的新发病例及死亡病例占世界新发及死亡病例的50%以上[1,2]。肝脏既是合成凝血酶原、凝血因子和抗凝血酶的器官,也是合成和灭活纤维蛋白溶解物与抗纤溶物质的主要场所,当肝脏发生病变时定会影响机体所维持的凝血和纤溶两系统之间的平衡,所以肝病患者均有不同程度的凝血和纤溶异常[3],因此肝癌较别的肿瘤相比更容易引起止、凝血功能的紊乱[4]。有研究提示,肝癌患者可能出现复杂的凝血、抗凝、纤溶系统的改变,总体的高凝与抗凝功能降低,纤溶功能低下与继发纤溶亢进,可交替出现于疾病的各个阶段[4]。监测原发性肝癌患者的凝血紊乱的状况,可以控制和减少围术期的出血[5],减少临床血液输注量,达到提高肝癌患者的治疗效果。因此本次研究对原发性肝癌患者术前进行TEG各指标以及传统的凝血功能和血小板计数检测,评估原发性肝癌患者术前凝血状态对围术期异体输血、术后1年生存率和复发转移率的临床参考意义。
1 资料与方法
1.1 病例收集 收集福建省肿瘤医院腹部外科2016年1月-2016年12月接受手术治疗的患者103例,其中男性77例,女性 26例;年龄 24~79(54.8±12.1)岁。 患者均依据术后病理学诊断结果为原发性肝癌。术前所有患者进行TEG、血常规以及常规凝血功能检查(PT、APTT、Fg、D-D)。
1.2 术后随访 患者术后接受长期电话随访,每6个月随访一次,103例成功随访,随访率100%。
1.3 研究方法 同时采集2例109mmol/L枸橼酸钠抗凝静脉血标本2ml和1例乙二胺四乙酸二钾抗凝静脉血2ml,前者用于TEG和凝血实验检测,后者用于血常规测。所有标本采集后2h内完成检测。TEG检测采用美国Haemoscope公司TEG分析仪、配套试剂及配套分析软件,检测指标包括凝血反应时间(R值)、凝固角(Angle值)、凝固时间(K值)、血栓最大幅度(MA值)和凝血综合指数(CI值)。凝血实验检测采用法国Stago公司STA-RFVOL-7ION全自动血凝分析仪及配套试剂,检测指标包括凝血酶原时间 (PT)、PT-国际标准化比值 (PTINR)、活化部分凝血活酶时间(APTT)、凝血时间(TT)和纤维蛋白原 (Fg)。血常规检测采用日本Sysmex公司XN-1000型全自动血液分析仪及配套试剂,检测指标为PLT。所有操作严格操作试剂和仪器说明书。
1.4 统计学方法 数据使用SPSS-19软件进行数据处理和统计分析,计量资料若满足正态分布以均数±标准差表示,若不满足正态分布则用中位数±四分位数间距(M±Q)表示;组间差异的比较采用独立样本t检验,应用单因素方差分析进行多组比较;样本数据方差不齐用秩和检验;计数资料以例数(%)表示,组间比较用 χ2检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 一般资料 共入组病例103例, 年龄24~79(54.8±12.1)岁;男性 77 例,女性 26 例;手术时间(358.3±124.5)min;术中出血量(530.4±666.5)ml;住院日(22.2±5.7)d;TNM 分期:I期 28 例、Ⅱ期 24例、Ⅲ期42例、IV期9例;有淋巴结转移者5例、无淋巴结转移者98例。见表1。

表1 围手术期HCC患者基本情况
2.2 肝癌不同性别之间患者的TEG参数 肝癌患者不同性别之间TEG各参数差异无统计学意义(P>0.05),见表 2。
2.3 肝癌不同年龄组之间患者的TEG参数 肝癌患者按年龄段分为<50岁和≥50岁两组,两组之间TEG各参数差异无统计学意义 (P>0.05),见表3。
2.4 肝癌不同病理分期患者手术前的TEG参数、常规凝血功能及血小板计数的比较 在肝癌不同病理分期方面,I期与Ⅲ-Ⅳ期、Ⅱ期与Ⅲ-Ⅳ期TEG 各参数差异有统计学意义 (P<0.05),I期与Ⅱ期TEG各参数差异无统计学意义 (P>0.05),见表4。常规凝血功能及血小板计数指标:I期与Ⅲ-Ⅳ期比较参数Fg、D-D差异有统计学意义 (P<0.05),Ⅱ期与Ⅲ-Ⅳ期比较参数Fg差异有统计学意义(P<0.05),PLT、PT、APTT 指标差异无统计学意义 (P>0.05),见表 5。
2.5 肝癌围手术期有无输注红细胞悬液患者手术前的TEG参数、常规凝血功能及血小板计数的比较 肝癌患者中围手术期有无输注红细胞悬液TEG参数的比较,两组间K、MA值差异有统计学意义(P<0.05),其它各参数无统计学差异(P>0.05),见表6。肝癌患者中围手术期有无输注红细胞悬液常规凝血功能及血小板计数的检测结果比较,两组间 Fg、D-D 值差异有统计学意义(P<0.05),其它各参数比较差异无统计学意义(P>0.05),见表 7。
表2 肝癌患者不同性别之间TEG参数比较/(M±Q)
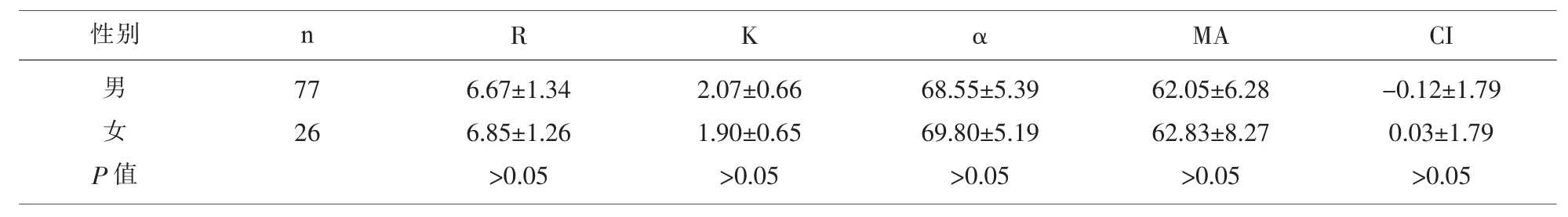
表2 肝癌患者不同性别之间TEG参数比较/(M±Q)
R K αMA CI 6.67±1.34 6.85±1.26>0.05 2.07±0.66 1.90±0.65>0.05 68.55±5.39 69.80±5.19>0.05 62.05±6.28 62.83±8.27>0.05-0.12±1.79 0.03±1.79>0.05性别 n男 女 P值77 26
表3 肝癌患者不同年龄段之间TEG参数比较/(M±Q)
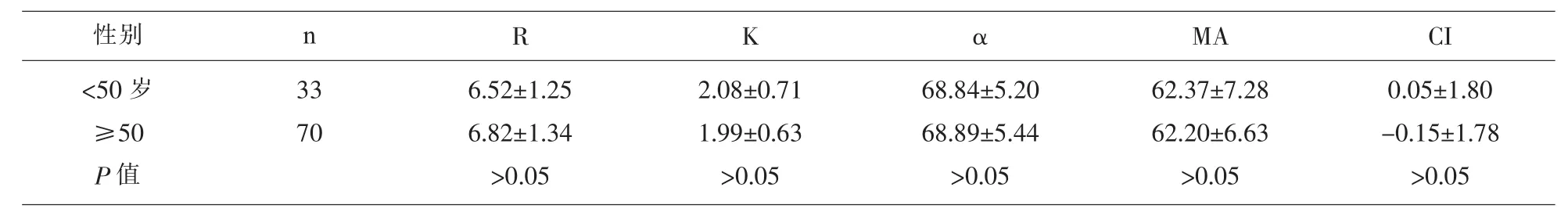
表3 肝癌患者不同年龄段之间TEG参数比较/(M±Q)
R K αMA CI 6.52±1.25 6.82±1.34>0.05 2.08±0.71 1.99±0.63>0.05 68.84±5.20 68.89±5.44>0.05 62.37±7.28 62.20±6.63>0.05 0.05±1.80-0.15±1.78>0.05性别 n<50岁≥50 P值33 70
表4 肝癌不同分期的TEG的检测结果比较/(M±Q)
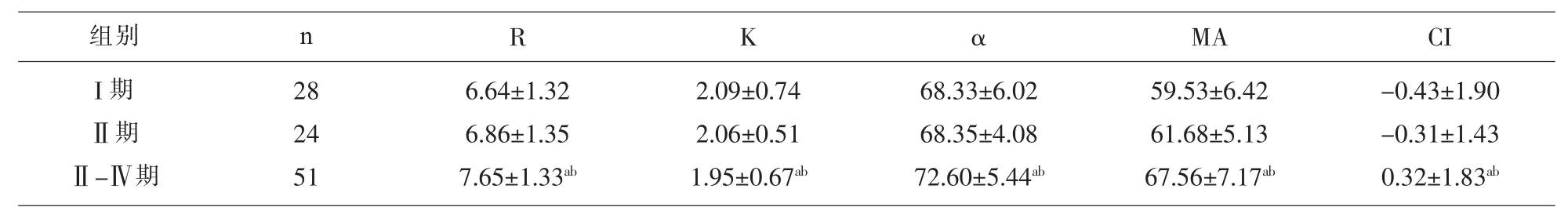
表4 肝癌不同分期的TEG的检测结果比较/(M±Q)
注:aP<0.05,与 I期比较;bP<0.05,与Ⅱ期比较。
R K αMA CI 6.64±1.32 6.86±1.35 7.65±1.33ab 2.09±0.74 2.06±0.51 1.95±0.67ab 68.33±6.02 68.35±4.08 72.60±5.44ab 59.53±6.42 61.68±5.13 67.56±7.17ab-0.43±1.90-0.31±1.43 0.32±1.83ab组别 n I期 Ⅱ期Ⅱ-Ⅳ期28 24 51
表5 肝癌不同分期的常规凝血功能及血小板计数的检测结果比较()/(M±Q)

表5 肝癌不同分期的常规凝血功能及血小板计数的检测结果比较()/(M±Q)
注:aP<0.05,与 I期比较;bP<0.05,与Ⅱ期比较。
PLT(×109/L) PT(S) APTT(S) Fg(g/L) D-D 173.19±70.06 210.47±207.88 210.92±69.11 13.17±0.94 13.33±0.86 13.03±0.87 35.85±3.18 37.85±3.52 36.89±4.49 3.02±0.81 3.14±0.78 3.74±1.13ab 0.54±0.34 0.69±0.44 1.35±1.75a组别 n I期 Ⅱ期Ⅱ-Ⅳ期28 24 51
表6 肝癌患者中围手术期有无输血患者TEG参数的比较/(M±Q)
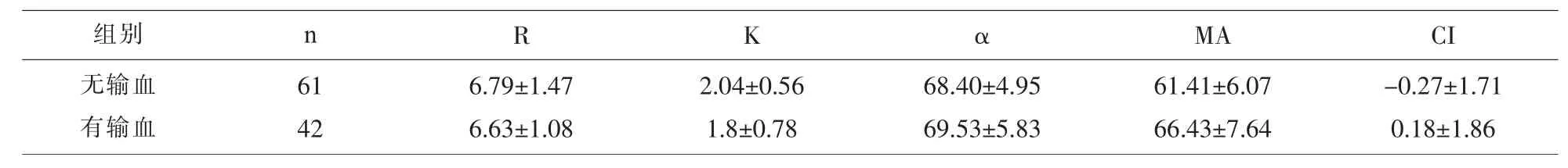
表6 肝癌患者中围手术期有无输血患者TEG参数的比较/(M±Q)
R K αMA CI 6.79±1.47 6.63±1.08 2.04±0.56 1.8±0.78 68.40±4.95 69.53±5.83 61.41±6.07 66.43±7.64-0.27±1.71 0.18±1.86组别 n无输血有输血61 42
表7 肝癌患者中围手术期有无输血患者常规凝血功能及血小板计数的检测结果比较(/(M±Q)

表7 肝癌患者中围手术期有无输血患者常规凝血功能及血小板计数的检测结果比较(/(M±Q)
PLT(×109/L) PT(S) APTT(S) Fg(g/L) D-D 199.97±124.80 198.24±80.95 13.13±0.77 13.12±1.04 37.13±3.8 36.40±4.20 3.15±0.89 3.72±1.16 0.62±0.58 1.42±1.84组别 n无输血有输血61 42
2.6 肝癌手术后1年生存与死亡的患者手术前TEG参数、常规凝血功能及血小板计数的比较 肝癌手术后1年生存与死亡的患者TEG参数的比较,两组间 MA 值差异有统计学意义(P<0.05),其它各参数差异无统计学意义(P>0.05),见表 8。肝癌手术后1年生存与死亡的患者常规凝血功能及血小板计数的检测结果比较,两组间APTT、FIB值差异有统计学意义(P<0.05),其它各参数差异无统计学意义(P>0.05),见表 9。
2.7 肝癌手术后1年有无复发转移的患者手术前的TEG参数、常规凝血功能及血小板计数的比较肝癌手术后1年有无复发转移的患者TEG参数的比较,各参数差异无统计学意义(P>0.05),见表 10。肝癌手术后1年有无复发转移的患者常规凝血功能及血小板计数的检测结果比较,两组间PLT、APTT、FIB 值差异有统计学意义(P<0.05),其它各参数差异无统计学意义(P>0.05),见表 11。
3 讨论
正常人体内的凝血和抗凝血之间保持着平衡状态,多种原因可以打破这种平衡关系,如凝血因子活性和纤维蛋白原功能的强弱、血小板数量和功能的变化、血液中抗凝物质的增减以及纤溶系统活性的强弱等情况,其中恶性肿瘤和机体凝血功能的变化关系非常密切[6]。原发性肝癌患者围手术期常常出现凝血功能障碍的主要原因是肝脏合成的凝血因子减少,脾功能亢进等导致血小板数量减少和功能受抑制,内毒素血症也是加重凝血功能障碍的原因之一[7]。
在本研究中我们发现肝癌患者不同年龄组和性别组之间的凝血状态无明显差异,有文献报道[8],肺癌患者中,女性更易发生高凝,但Tas等[9]对肺癌患者凝血状态的研究后得出相反的结果,可能与样本量的大小和病例的选择差异有关,不同性别肺癌患者凝血状态的差异可能与男女激素水平不同相关,还需扩大样本的数量继续进行研究。本文按年龄将肝癌患者分为<50岁和≥50岁两组,两组患者的凝血状态无差别。从病理分期来看,TEG检测结果表明Ⅲ-Ⅳ期患者K值较I期、Ⅱ期减小,R、angel角、MA以及 CI值较 I期、Ⅱ期增大,表明分期越晚的肝癌患者,其凝血因子活性减弱、纤维蛋白功能以及血小板聚集功能增强越明显;传统凝血及血小板检测结果表明Ⅲ-Ⅳ期患者Fg值较I期、Ⅱ期增大,表明传统凝血检测项目随着分期的发展,纤维蛋白量增加。肝癌患者血浆Fg异常升高不仅提示患者血黏度升高、纤溶亢进、易发生出血倾向,更与肿瘤临床分期关系密切[10],可作为原发性肝癌患者一个重要的预后指标。传统的凝血功能检测是一个静态的终点检测凝血功能的实验技术,测定的血样标本是经过离心后的血浆,恰恰去掉了血小板这一重要的凝集因素,难以反映整个凝血过程,只能反映血浆中某一阶段或某种凝血产物无血小板参与状态下的情况[11,12]。TEG是一种以细胞为基础全血做血样标本的新型凝血检测模式,能动态分析血小板、凝血因子、纤维蛋白原等血液成分之间相互作用、血凝块形成和纤维蛋白溶解全过程的曲线图[13],因此血栓弹力图比普通凝血检测能够更准确地评估肝癌患者的凝血功能异常状况。
表8 肝癌手术后1年生存与死亡的患者TEG参数的比较/(M±Q)
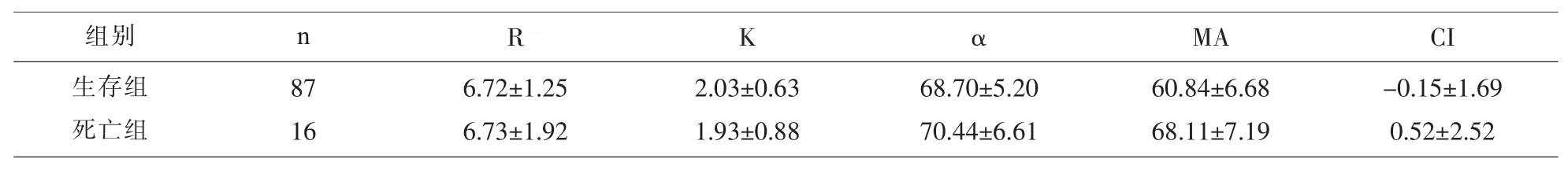
表8 肝癌手术后1年生存与死亡的患者TEG参数的比较/(M±Q)
R K αMA CI 6.72±1.25 6.73±1.92 2.03±0.63 1.93±0.88 68.70±5.20 70.44±6.61 60.84±6.68 68.11±7.19-0.15±1.69 0.52±2.52组别 n生存组死亡组87 16
表9 肝癌手术后1年生存与死亡的患者常规凝血功能及血小板计数的检测结果比较(/(M±Q)
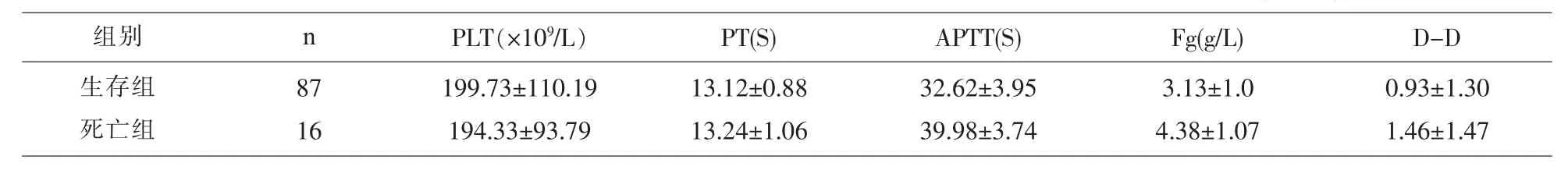
表9 肝癌手术后1年生存与死亡的患者常规凝血功能及血小板计数的检测结果比较(/(M±Q)
PLT(×109/L) PT(S) APTT(S) Fg(g/L) D-D 199.73±110.19 194.33±93.79 13.12±0.88 13.24±1.06 32.62±3.95 39.98±3.74 3.13±1.0 4.38±1.07 0.93±1.30 1.46±1.47组别 n生存组死亡组87 16
表10 肝癌手术后1年有无复发转移的患者TEG参数的比较/(M±Q)

表10 肝癌手术后1年有无复发转移的患者TEG参数的比较/(M±Q)
R K αMA CI 6.65±1.20 6.88±1.55 2.03±0.65 2.00±0.67 68.68±5.29 69.29±5.50 62.29±6.79 62.47±6.96-0.05±1.66-0.16±2.05组别 n无复发转移组复发转移组70 33
表11 肝癌手术后1年有无复发转移的患者常规凝血功能及血小板计数的检测结果比较/(M±Q)

表11 肝癌手术后1年有无复发转移的患者常规凝血功能及血小板计数的检测结果比较/(M±Q)
PLT(×109/L) PT(S) APTT(S) Fg(g/L) D-D 223.09±120.01 289.00±69.84 13.04±0.85 13.32±0.96 33.12±4.06 39.39±3.31 3.08±0.95 3.86±1.13 1.00±1.47 0.93±0.91组别 n无复发转移组复发转移组70 33
在本研究中我们将围手术期有输血与无输血患者的术前检测的TEG结果比较,两组患者TEG检测结果:K值降低、MA计数升高,表明围手术期有输注悬浮红细胞比无输注悬浮红细胞的肝癌患者术前的血浆Fg和血小板数量和功能均更高,常规凝血检测结果显示有输注悬浮红细胞比无输注悬浮红细胞的肝癌患者术前的Fg和D-D数量均增高,两种检测TEG的结果更全面,所以我们在术前监测患者的凝血状况,可以作为监测临床输血的辅助方法。
在研究术后1年生存或死亡的患者术前凝血状态时,结果显示死亡组相对于生存组凝血因子缺乏,纤维蛋白和血小板增高的状态。这与丁丽[14]等人的研究结果是一样的:Fg和PLT的水平与晚期肝癌患者的远期生存呈负相关。说明Fg和PLT等凝血指标可作为判断晚期原发性肝癌严重程度、治疗和预后的有效指标[15],有助于临床工作中对患者病情进行全面评估和预测。在术后复发转移的患者术前凝血的研究中发现复发转移组的同样出现凝血因子缺乏,纤维蛋白和血小板增高的结果,这可能是因为:可能是:①肝脏受损时其合成纤溶酶抑制物及清除纤维蛋白(原)降解产物的功能降低;②肿瘤细胞进入血液循环后,与内皮细胞、血小板等相互作用,释放生物活性物质,促进血小板激活[16],而血小板激活时,其颗粒含有的Fg等分子可稀释进入血液循环,参与肿瘤的转移;可见,肝癌患者血浆Fg,异常升高不仅提示患者血黏度升高、纤溶亢进、易发生出血倾向,更与肿瘤临床分期关系密切[17],可作为原发性肝癌患者一个重要的预后指标。
总之,本研究结果显示,原发性肝癌患者可能出现较为复杂的凝血功能异常,且与肝细胞受损程度密切相关。术前进行凝血功能检查能在一定程度上反映肝癌患者的病情变化,有助于临床工作中对患者病情进行全面评估和预测。

