不同苎麻品种根际微生物多样性群落结构分析
苏小惠,白玉超,3#,佘玮,2,杨瑞芳,2,崔丹丹,李林林,王继龙,崔国贤,2*
(1.湖南农业大学苎麻研究所,湖南 长沙410128;2.湖南农业大学农学院,湖南长沙410128;3.深圳市芭田生态工程股份有限公司,广东深圳518105)
苎麻(Boehmeria niveaL.)属荨麻科(Urticaceae)苎麻属(Boehmeria),是一种多年生宿根性草本纤维植物[1]。苎麻地下部分俗称“麻蔸”,包括根系和地下茎。在土壤中,根系分泌物和根际微生物间的相互作用是十分重要的过程,植物根系通过分泌各种次生代谢物质对根际微生物的种类、数量和分布产生影响,对根际微生物群落结构有选择塑造作用[2]。Eisenhauer等[3]的研究表明,根系分泌物介导下的植物-微生物互作关系变化对于土壤肥力、健康状况以及植物生长发育有着极其重要的作用。Berendsen等[4]认为,根际是植物体的一个组成部分,根际微生物群落的宏基因组是植物体的第二基因组。吴林坤等[2]认为,植物的他感作用、连作障碍、连作促进或是间套作增产等,均是由其根系分泌物介导下的植物与特异微生物共同作用的结果。Gschwendtner等[5]研究发现,不同的马铃薯品种之间根际微生物群落差异很大,而且在不同生长发育时期,马铃薯根际微生物群落结构也发生变化,这可能都与根系分泌物的组成和数量有关。拟南芥根系分泌物的组分与含量随生长发育时期不同而显著变化,其根部相关基因的表达水平也相应变化,且其根际微生物功能基因的表达模式与拟南芥不同生长发育时期的根系分泌物分泌模式显著相关[6]。植物根系分泌物的产生是植物根部长期进化的结果,是适应环境的一种体现。本研究拟以湘苎3号、多倍体1号、中苎1号、湘苎7号和R057的土壤样本基因组DNA为模板进行PCR扩增,并采用高通量测序方法初步探讨苎麻根际微生物多样性的特点,旨在为进一步探索根系分泌物介导下苎麻-土壤-微生物的互作关系提供理论依据。
1 材料与方法
1.1 试验材料
试验所用苎麻种植于湖南省浏阳市澄潭江镇“苎麻高产创建与高效施肥研究与示范基地”(北纬27°59′,东经113°46′),试验品种为湘苎3号、多倍体1号、中苎1号、湘苎7号和R057。 于2011年5月嫩梢扦插育苗,同年6月移栽,株距45 cm,栽培密度3.3×104株/公顷,同年8月破秆。2015年为5龄麻。土壤基本理化性质如表1所示。

表1 土壤基本理化性质Table 1 Physicochemical properties of experiment soils
1.2 取样方法
于2015年8月采用剥落法收集湘苎3号、多倍体1号、中苎1号、湘苎7号和R057 5个苎麻品种的根际土壤。首先选取生长正常的植株,整蔸取出,抖落较松散的土壤,然后收集附着在根上0~4 mm间的土壤作为根际土[7]。将土壤样品去除动植物残体等杂质,装入密封袋中,立即置于液氮中运回实验室,置于-80℃冰箱中,备用。由于研究经费有限,本研究测序未设置生物学重复。
1.3 基因组DNA的提取
采用CTAB法(十六烷基三甲基溴化铵法)对土壤样本的基因组DNA进行提取,之后利用琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量样品于离心管中,使用无菌水稀释样品至1 ng/μL。
1.4 PCR扩增
a.模板:稀释后的基因组DNA;
b.引物:根据测序区域的选择,使用带Barcode的特异引物,引物设计如表2所示;
c.PCR 采用 rTaq DNA Polymerase,20 μL 反应体系:10×Buffer 2 μL,2.5 mmol/L dNTPs 2 μL,Forward Primer(5 μmol/L)0.8 μL,Reverse Primer(5 μmol/L)0.8 μL,rTaq Polymerase 0.2 μL,BSA 0.2 μL,Template DNA 10 ng,补足 ddH2O 至 50 μL。 PCR 仪,ABI GeneAmp©9700 型。 16S rDNAPCR 扩增条件:1×(3 minutes at 95 °C);27×(30 seconds at 95 °C;30 seconds at 55 °C;45 seconds at72 °C);10 minutes at 72 °C,10 °C until halted by user。 18S rDNA-PCR 扩增条件:1×(3 minutes at 95 °C);35×(30 seconds at 95 °C;30 seconds at 55 °C;45 seconds at 72 °C);10 minutes at 72 °C,10°Cuntil halted by user。PCR产物采用2%浓度的琼脂糖凝胶进行电泳检测,使用AXYGEN公司的AxyPrep DNA凝胶回收试剂盒切胶回收PCR产物,Tris_HCl洗脱。
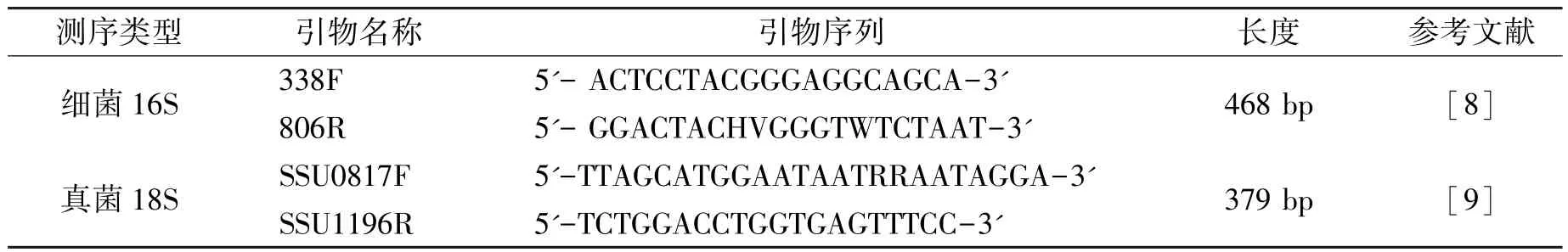
表2 PCR引物设计Table 2 PCR primer design
1.5 荧光定量
参照电泳初步定量结果,将PCR产物用Promega公司的QuantiFluorTM-ST蓝色荧光定量系统进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合。
1.6 Miseq文库构建和测序
Miseq文库构建和测序在美吉生物(上海)科技有限公司进行,测序平台为 Illumina MiSeqPE300/PE250。
1.7 生物信息分析
测序结束后,对有效序列进行去杂、修剪、去除嵌合体等过滤处理,得到优化序列。根据序列97%的相似性形成操作分类单元OTU(Operational Taxonomic Units),对OTU的代表序列作分类学分析。基于OTU聚类分析结果,对OTU进行多种多样性指数分析,以及对测序深度的检测;基于分类学信息,在各个分类水平上进行群落结构的统计分析。
2 结果与分析
2.1 苎麻根际土壤细菌群落多样性分析
2.1.1 优化序列数据统计
湘苎3号、多倍体1号、中苎1号、湘苎7号和R057 5个品种土壤样本中共得到180975个有效序列,总碱基数为79248780,平均序列长度为437.86 bp。各样本优化序列数据统计如表3所示。

表3 各样品优化序列数据统计Table 3 Data statistics of each sample optimal sequence
2.1.2 苎麻根际土壤细菌群落多样性指数
在97%相似水平上土壤样品细菌群落多样性指数如表4所示。5个苎麻品种根际土壤样品的生物分类单元OTUs为754~950。Coverage(覆盖率)是测序深度指数,其数值越高则表示样本中序列被测出的概率越高,5个苎麻品种根际土壤样品的覆盖率均在99%以上,表明绝大部分的细菌种群都被检测出来。Ace指数和Chao1指数是用来估算菌群丰度(Community richness)的指数,5个苎麻品种根际土壤样品的Ace指数为817~999,Chao1指数为873~1012。Shannon指数和Simpson指数是用来估算菌群多样性(Community diversity)的指数,Shannon值越大,说明群落多样性越高,Simpson指数值越大,说明群落多样性越低[10]。5个苎麻品种根际土壤样品的Shannon指数为5.39~5.94,Simpson指数为0.0049~0.0106。其中湘苎7号Shannon指数(5.39)低于其他4个样品,而Simpson指数(0.0106)高于其他样品并显著高于湘苎3号,说明湘苎7号品种细菌群落多样性较其他品种为最低,湘苎3号品种细菌群落多样性较其他品种为最高。

表4 细菌群落多样性指数Table 4 Bacterial community diversity indices
2.1.3 苎麻根际土壤细菌群落结构组成分析
苎麻根际土壤样品细菌群落结构在门水平上的组成和丰度如图1所示。5个苎麻品种根际土壤样品OTU与16S细菌和古菌核糖体数据库(Silva、RDP、Greengene)比对[11-13],归属于24门,52纲,125目,213科,329属,569种。主要的门有变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、芽单胞菌门(Gemmatimonadetes)、厚壁菌门(Firmicutes)、硝化螺旋菌门(Nitrospirae)和疣微菌门(Verrucomicrobia)等。其中,变形菌门、酸杆菌门、绿弯菌门、拟杆菌门和放线菌门占主导地位,约占细菌总数的88.92%~97.45%。不同苎麻品种根际土壤中以Proteobacteria在细菌中所占比例最高,品种间变化范围35.57%~50.08%;其次为Acidobacteria,品种间变化范围17.53%~33.27%。

图1 土壤细菌群落门分类水平相对丰度Fig.1 Relative abundance of soil bacterium on the level of phylum
2.2 苎麻根际土壤真菌群落多样性分析
2.2.1 优化序列数据统计
湘苎3号、多倍体1号、中苎1号、湘苎7号和R057 5个品种土壤样本中共得到143599个有效序列,总碱基数为59622314,平均序列长度为400.98 bp。各样本优化序列数据统计如表5所示。
2.2.2 苎麻根际土壤真菌群落多样性指数
在97%相似水平上土壤样品真菌群落多样性指数如表6所示。5个苎麻品种根际土壤样品的生物分类单元OTUs为190~220。5个苎麻品种根际土壤样品的覆盖率均在99%以上,表明绝大部分的真菌种群都被检测出来。5个苎麻品种根际土壤样品的Ace指数为200~232,Chao1指数为202~235,Shannon指数为2.63~3.43,Simpson指数为0.0671~0.2360。 其中湘苎3号的Shannon指数在5个苎麻品种根际土壤样品中最低,而Simpson指数显著高于其他样品。

表5 各样品优化序列数据统计Table 5 Data statistics of each sample optimal sequence

表6 真菌群落多样性指数Table 6 Fungus community diversity indices
2.2.3 苎麻根际土壤真菌群落结构组成分析
苎麻根际土壤样品真菌群落结构在门水平上的组成和丰度如图2所示。5个苎麻品种根际土壤样品OTU与ITS真菌数据库(Unite)比对[14],归属于43门,67纲,87目,102科,120属,174种。主要的门有子囊菌门(Ascomycota)、接合菌门(Zygomycota)、担子菌门(Basidiomycota)、纤毛亚门(Ciliophora)、壶菌门(Chytridiomycota)等,此外还检测到有 Eukaryota_unclassified、Fungi_unclassified、扁形动物门(Platyhelminthes)、芽枝霉门(Blastocladiomycota)、褐藻门(Ochrophyta)等。其中,以子囊菌门(Ascomycota)占据主导地位,占真菌总数的45.51%~68.96%;接合菌门(Zygomycota)和担子菌门(Basidiomycota)次之,分别占真菌总数的5.29%~15.81%和2.74%~20.13%。在5个苎麻品种中,湘苎3号根际土壤子囊菌门丰度最高(68.96%),但接合菌门丰度最低(5.29%);多倍体1号根际土壤子囊菌门丰度最低(45.51%),但接合菌门丰度最高(15.81%)。

图2 土壤真菌群落门分类水平相对丰度Fig.2 Relative abundance of soil fungus on the level of phylum
2.3 苎麻根际土壤真菌与细菌数量比值
苎麻根际土壤真菌与细菌数量比值通过样品真菌OTUs数量与细菌OTUs数量比值来计算。有学者认为,真菌型土壤是地力衰竭的标志,细菌型土壤是土壤肥力提高的一个生物指标[15]。不同苎麻品种根际土壤真菌与细菌数量比如图3所示。由图3可知,R057、多倍体1号、湘苎3号、湘苎7号和中苎1号根际土壤真菌与细菌数量比为0.23~0.29,其中以中苎1号根际土壤中真菌与细菌数量比最高。

图3 土壤真菌与细菌数量比值Fig.3 Soil fungi and bacteria quantity proportion
3 讨论与结论
高通量测序具有成本低、通量高等优点,在微生物生态学研究中得到了广泛应用。本文通过Miseq测序平台研究了苎麻根际土壤细菌和真菌的群落结构组成,以期为后续苎麻化感效应研究奠定基础。在本研究中,5个苎麻品种根际土壤样品细菌和真菌的覆盖率均在99%以上,表明绝大部分的细菌和真菌种群都被检测出来,其中检测到的主要细菌门有变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、芽单胞菌门(Gemmatimonadetes)、厚壁菌门(Firmicutes)、硝化螺旋菌门(Nitrospirae)和疣微菌门(Verrucomicrobia)等,真菌门主要有子囊菌门(Ascomycota)、接合菌门(Zygomycota)、担子菌门(Basidiomycota)、纤毛亚门(Ciliophora)、壶菌门(Chytridiomycota)等。在本研究中细菌中以变形菌门、酸杆菌门、绿弯菌门、拟杆菌门和放线菌门为优势门,真菌中子囊菌门、接合菌门和担子菌门为优势门。变形菌门在拟南芥、玉米、枸杞等根际中均有富集分布,可见变形细菌能够适应多种植物根际微环境[16-18]。酸杆菌门能够降解复杂的木质素和纤维素,残留的苎麻植株经过酸杆菌门的分解能够为土壤微生物提供充足的能源,并为土壤提供养分[19-21]。子囊菌和担子菌是土壤中重要的分解者,子囊菌门大多数为腐生菌,可以分解木质素、角质素等难降解的有机质,在养分循环中担任着重要角色[22-24]。在本研究中,不同苎麻品种间微生物多样性存在一定差异,且真菌的多样性远低于细菌。朱四元等[25]研究表明,不同苎麻品种间根际微生物数量存在显著差异,且细菌微生物量大于真菌;周建霞等[26]发现苎麻土壤微生物中细菌数量在品种间存在显著差异;方敏等[27]研究表明,马缨杜鹃根系微生物分布于41个细菌门和6个真菌门,且根系不同生态位之间微生物群落结构存在差异。
在植物生长发育过程中,根系分泌物影响着土壤中养分的有效性、重金属的吸收和转运、根际土壤的理化性质以及根际微生物种群的结构[28]。在作物种植生产中,一些作物的根系分泌物能够刺激某些有害根际微生物的生长和繁殖,这些有害微生物对下茬同一作物的生长会产生抑制作用,造成连作障碍[29]。植物分泌的化感物质和根际微生物之间的相互作用是一个重要过程,植物根系分泌的各种次生代谢产物对根际微生物的种类、数量和分布产生影响[30]。白玉超等[31-32]以甲醇、乙醚、石油醚、乙酸乙酯和正己烷为浸提剂,用气相色谱-质谱联用仪(GC-MS)对苎麻根际分泌物进行了组分分析,主要鉴定出2,4-二叔丁基苯酚、棕榈酸、邻苯二甲酸二丁酯、邻苯二甲酸二异丁酯、十八碳酸甲酯等物质。酚酸类物质是一种重要的化感物质,能抑制微生物产生气体与挥发性脂肪酸的作用,并能减少微生物对其生长介质的消耗,同时,微生物的分布类群与土壤中酚酸的种类和浓度也存在一定的关系[33-34]。有研究[35]指出,随着大棚番茄连作年限的增加,番茄根分泌的酚酸类物质增加了土壤中有害真菌的数量。苎麻作为多年生作物,其根系分泌物与根际微生物多样性的关系尚不明确。苎麻根际土壤中积累的化学物质可能直接影响根系生长或通过影响土壤微生物群落结构而改变土壤环境,进而影响苎麻的生长,这可能是探索苎麻败蔸机理研究中的一个重要方向。

