圆叶锦葵对Cd处理的光合生理响应及Cd富集特征
罗 巧 邬梦晞 龙 月 潘远智,* 赵 胤 李 青 韩盼盼
(1 四川农业大学风景园林学院,四川 成都 611130;2 西藏自治区农牧科学院,西藏自治区 拉萨 850000)
镉(Cd)的生物毒性强、持久、化学活性大,易被植物吸收[1]。研究表明,一定浓度的Cd会抑制植物的生长,表现出植株变黄、生长速率减慢、植株矮小等毒害症状,高浓度Cd甚至会导致植物死亡[2-3]。超富集植物是清理Cd污染的理想材料,与非超富集植物相比,超富集植物对Cd毒害会表现出不同的生理响应,如在形态反应及光合作用等方面[4]。Cd胁迫下,净光合速率(net photosynthetic rate, Pn)的变化是影响植株生长的主要因素之一[5]。研究发现,随着Cd处理浓度的增加,Cd超富集植物AtriplexhalimusL.和Arthrocnemummacrostachyum的Pn和光合色素含量均显著降低,导致其光合作用下降[5-6]。研究表明,光合生理是Cd胁迫下最敏感的生理过程之一,也是反映植物对Cd耐受性的重要指标之一[7]。Cd胁迫下,不同植物的光合耐性和富集特征存在一定差异[4]。因此,研究植物在Cd胁迫下的光合生理特性和富集特征具有重要意义。
研究表明,从园林地被植物中筛选出的具有超富集特征的植物,不仅能修复Cd污染土壤,还能增强景观效果[8]。但目前关于园林植物在修复土壤污染物适用性方面的系统性研究尚鲜见报道。圆叶锦葵(MalvapusillaSmith)属锦葵科锦葵属多年生草本植物,多用于园林绿化,具有分布范围广、繁殖能力强等特点[9]。本研究通过盆栽试验,分析Cd胁迫下圆叶锦葵的生长、光合气体交换参数、光合色素含量、抗氧化酶[超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)]活性的变化及其对Cd的富集特征,探讨圆叶锦葵对Cd的光合耐性和富集能力,以期为土壤Cd污染修复材料的筛选提供理论依据。
1 材料与方法
1.1 试验材料
圆叶锦葵种子(均为F1)购自四川蓝翔园艺种子公司。种子经消毒后置于人工气候培养箱内进行育苗,30 d后选取长势一致、生长健壮的幼苗作为供试苗。
1.2 试验设计
试验场地位于四川省成都市温江区成都市农林科学院设施大棚内。设施大棚内年度平均气温23℃,最低气温14℃,最高气温29℃,周围无污染源,属于重金属未污染区。采用土壤盆栽模拟法,供试土壤取自野外田间0~20 cm表层自然土壤,其理化性质为pH值6.5、有机质含量23 mg·kg-1、速效氮19.2 mg·kg-1、速效磷62.4 mg·kg-1、速效钾59.2 mg·kg-1,土壤Cd背景值为0.07 mg·kg-1。设置Cd浓度为0(CK)、5、15、30、60、100 mg·kg-16个处理,每个处理设置5个重复。将 Cd以CdCl2·2.5H2O(试剂为分析纯)的形态加入到土壤中,混拌均匀后装入塑料栽培盆(直径25 cm,高19 cm)中,静置4周。将试验苗移栽至栽培盆中,每盆栽种2株试验苗。将植株移至设施大棚内,不定期喷洒少量水(不含Cd),保持盆内持水量70%,试验处理周期为60 d。
1.3 测定方法
处理60 d后,于晴天上午的9: 00-11: 30,对同一处理组植物的顶生叶片,采用LI-6400 XT便携式光合测定仪(LI-COR公司,USA)测定各处理植株叶片的光合气体交换参数[Pn、气孔导度(stomatal conductance, Gs)、蒸腾速率(transpiration rate,Tr) 和胞间CO2浓度 (intercellular CO2concentration,Ci)],红蓝光源光强为1 000 μmol·m-2·s-1,CO2浓度控制在500 μmol·mol-1。取适量鲜叶用于光合色素含量和抗氧化酶(SOD、CAT、POD、APX)活性测定:采用丙酮浸提法测定光合色素含量;NBT还原法测定SOD活性;愈创木酚法测定POD活性;采用紫外分光光度法测定CAT活性;采用抗坏血酸反应体系测定APX活性[10]。将植株从盆中取出并冲洗干净,用20 mmol·L-1EDTA-Na溶液浸泡15 min,再用去离子水将其冲洗干净,吸水纸吸干水分后称量植株鲜重;然后105℃杀青30 min,70℃烘干至恒重,称量其干重,并将其磨粉后过100目筛备用。植株及土壤样品均采用 HNO3-HClO4法消化(v∶v=5∶1),利用AA-700原子吸收分光光度计(岛津,日本)测定样品中的重金属Cd含量。利用EPSON Scan扫描仪(爱普生公司,美国)对叶片进行扫描;WinRHIZO Pro 2012b获取相关数据。
1.4 数据处理
采用SPSS 22.0和Excel 2016进行数据处理,所有数据均为3次重复的平均值,采用单因素方差分析法(one-way ANOVA)对数据进行分析;Tukey HSD法进行差异显著性检验(P<0.05);spearman法进行相关性分析(双尾检验)。生物富集系数(biological concentration factor,BCF)、转运系数(translocation factor,TF)可以评估植物对重金属的修复效率,按照公式分别计算BCF、TF[11-12]:
BCF=地上部分Cd浓度/土壤中Cd处理浓度
(1)
TF=地上部分Cd浓度/地下部分Cd浓度
(2)。
2 结果与分析
2.1 不同浓度Cd处理对圆叶锦葵生长的影响
由图1可知,随着Cd处理浓度的增加,圆叶锦葵的干重、株高、叶面积和株茎均呈先升高后降低的趋势。与CK相比,Cd处理组的干重、株高均显著升高。当Cd处理浓度为30 mg·kg-1时,圆叶锦葵的干重、株高、叶面积和株茎均达到最大值,分别为CK的3.18、1.93、3.34和1.35倍;当Cd处理浓度为100 mg·kg-1时,与CK相比,圆叶锦葵的干重、株高、叶面积和株茎分别增长了22.83%、20.87%、7.17%和15.12%。5~60 mg·kg-1Cd处理组的叶面积分别较CK显著增长178.38%、186.39%、233.51%和83.21%,而100 mg·kg-1Cd处理组与CK间无显著差异。结果表明,5~100 mg·kg-1Cd处理促进了植株生长,其中以30 mg·kg-1Cd处理对植株的促进生长作用最大。由图2可知,5~100 mg·kg-1Cd处理的圆叶锦葵叶片没有表现出明显的毒害症状。

注:不同小写字母表示各处理间差异显著(P<0.05)。下同。Note: Different lowercase indicate significant difference at 0.05 level among treatment. The same as following.图1 不同Cd浓度下圆叶锦葵的生长响应Fig.1 The growth response of Malva pusilla Smith under different Cd concentration
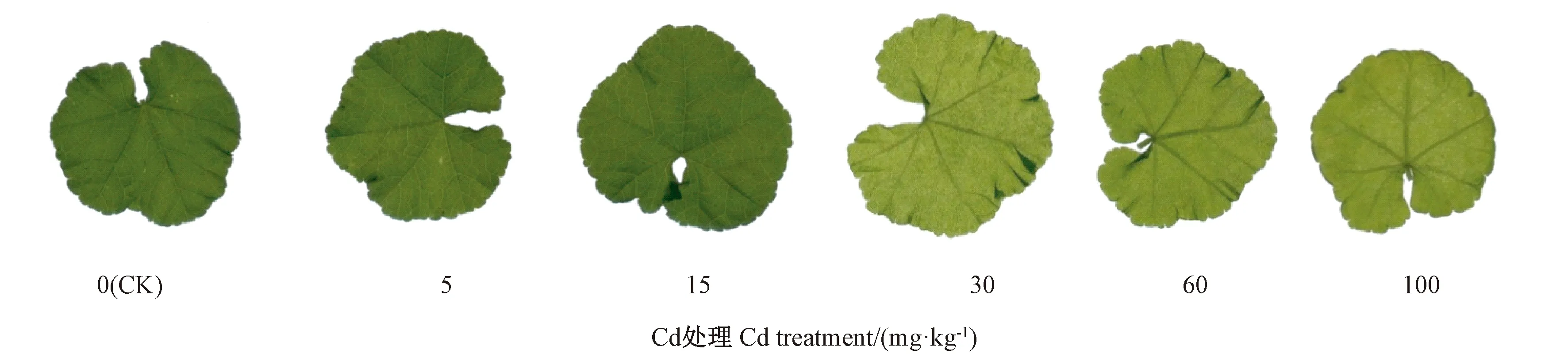
图2 不同Cd浓度下圆叶锦葵的叶片形态Fig.2 The leaf morphology of Malva pusilla Smith under different Cd concentration
2.2 不同浓度Cd处理对圆叶锦葵光合气体交换参数的影响
由图3可知,Cd处理对圆叶锦葵的Pn、Tr、Gs、Ci均有显著性影响(P<0.05)。随着Cd处理浓度的增加,Pn、Tr和Gs的变化趋势基本一致,均呈先增加后减小的趋势,且在5 mg·kg-1Cd处理下达到最大值,分别较CK显著增加了67.13%、41.33%和22.73%。5~60 mg·kg-1Cd处理时,Pn和Tr均显著高于CK,而100 mg·kg-1Cd处理时,Pn和Tr则显著低于CK。随着Cd处理浓度的增加,Ci呈逐渐减小的趋势,100 mg·kg-1Cd处理时最低,较CK显著降低19.57%。综上,5~60 mg·kg-1Cd处理提高了圆叶锦葵的Pn和Tr,而100 mg·kg-1Cd处理则抑制了Pn和Tr;随着Cd处理浓度的增加Ci一直受到抑制。

图3 不同Cd浓度下圆叶锦葵的光合气体交换参数Fig.3 The photosynthetic response of Malva pusilla Smith under different Cd concentration
2.3 不同浓度Cd处理对圆叶锦葵光合色素含量的影响
植物的光合作用主要取决于光合色素的含量,含量高则代表植物光合作用较强[13-14]。光合色素包括叶绿素a、叶绿素b和类胡萝卜素。随着Cd处理浓度的增加,叶绿素a含量呈上升的趋势,100 mg·kg-1Cd处理时达到最大值,是CK的1.24倍(图4-A);叶绿素b含量和总叶绿素含量均呈先上升后降低的趋势,且均在5 mg·kg-1Cd处理时达到最大值,分别较CK显著增加68.86%和31.83%(图4-B、C);类胡萝卜素含量呈先增加后降低的趋势,在30 mg·kg-1Cd处理时达到最大值,较CK显著增加了46.32%(图4-D)。结果表明,Cd处理促进了圆叶锦叶片中光合色素含量的增加,5~100 mg·kg-1Cd处理下植株的光合色素含量均显著高于CK。

图4 不同Cd浓度下圆叶锦葵的光合色素含量Fig.4 The photosynthetic pigment content of Malva pusilla Smith under different Cd concentration
2.4 不同浓度Cd处理对圆叶锦葵叶片抗氧化酶活性的影响
由表1可知,5~100 mg·kg-1Cd处理对圆叶锦葵叶片MDA含量及抗氧化酶(SOD、CAT、POD、APX)活性均有一定的影响。随着Cd处理浓度的增加,MDA含量呈先升高后降低的趋势,在5 mg·kg-1Cd的处理时达到最大值,5~60 mg·kg-1Cd处理的MDA含量均显著高于CK。随着Cd处理浓度的增加,SOD、POD活性均呈逐渐增加的趋势,均在100 mg·kg-1Cd处理时达到最大值,分别较CK显著增加了62.55%、256.90%;而CAT、APX活性随着Cd处理浓度的增加,呈先升高后降低的趋势,分别在30和5 mg·kg-1Cd处理时达到最大值,分别较CK显著增加94.54%、119.20%,但二者在100 mg·kg-1Cd处理时的活性均显著低于CK。
2.5 不同浓度Cd处理下,圆叶锦葵对镉的富集特征
由表2可知,随着Cd处理浓度的增加,圆叶锦葵叶片中Cd含量逐渐增加,在100 mg·kg-1Cd处理时达到最大值,为CK的352.10倍。100 mg·kg-1Cd处理时,圆叶锦葵根、茎、叶组织中Cd含量均超过了Cd超富集植物的Cd含量临界值(100 mg·kg-1DW),且植物各组织中Cd含量的关系为茎>根>叶,达到了镉超富集植物的临界条件[15]。Cd处理组中BCF值为1.41~3.31,5 mg·kg-1Cd处理时达到最大值(3.31);所有处理组的TF值为1.03~7.37,其中0~60 mg·kg-1Cd处理的TF值无显著差异,100 mg·kg-1Cd处理时的TF值显著增加,达到最大值(7.37),是CK的3.00倍。结果表明,圆叶锦葵对Cd具有很强的富集能力,同时具有很强的将地下部分Cd向地上部分(茎、叶)转运的能力,可能是一种潜在的Cd超富集植物。
注:同列不同小写字母表示处理间差异显著(P<0.05)。下同。
Note:Different lowercate in the same column indicate significant difference at 0.05 level among treatments.The same as following.

表2 Cd处理下圆叶锦葵根、茎、叶中Cd含量及其生物富集系数和转运系数Table 2 Cd content in plant tissues and BCF, TF of Malva pusilla Smith grown under Cd treatment
注:“-”表示数据不存在。
Note: ‘-’ indicates data doesn′t existed.
3 讨论
3.1 Cd对光合气体交换参数的影响
Cd胁迫会影响植物的光合气体交换参数。Ci值的变化趋势可以作为判断气孔限制和非气孔限制的依据[16]。研究发现Cd胁迫对潜在的Cd超富集植物地胆草的气体交换产生了消极影响,表现为Pn、Tr降低[7]。本研究中,Cd胁迫下植物的Pn、Gs和Ci表现出相同的变化趋势,说明Pn下降的主要原因是气孔因素;随着Cd胁迫浓度的增加,植物的Pn、Tr和Gs逐渐降低,而Ci则逐渐升高,表明其光合作用下降的主要原因是非气孔因素[16-18]。简敏菲等[19]研究发现Cd胁迫下,苎麻在早期的Pn、Gs、Tr升高,而Ci降低,说明短时间胁迫能有效刺激苎麻的光合作用,其光合作用由气孔因素和非气孔因素影响。这与本研究结果一致。Ci的下降可能有两方面原因:一是高光合作用引起的Ci下降;二是可能与Cd对光合色素、光合组织及光合作用过程的影响有关[20]。由此推断,0~5 mg·kg-1Cd处理时其光合作用受气孔因素和非气孔因素影响。5~100 mg·kg-1Cd处理时圆叶锦共葵的Pn、Tr、Gs和Ci均减小,Pn主要受气孔因素影响而显著下降。说明圆叶锦葵叶片Pn的变化既有气孔因素,又有非气孔因素的影响。这是由于Cd胁迫引起气孔开度减少甚至关闭,CO2无法进入叶片,叶片内淀粉的水解作用加强,光合产物运出缓慢,使得糖分累积,呼吸消耗增加等,从而导致光合速率降低[20]。
研究表明,较高的蒸腾作用可以促进根部吸收更多的营养元素参与代谢活动[21]。本研究中,5~60 mg·kg-1Cd处理组的Tr显著高于CK,这可能是5~60 mg·kg-1Cd处理的干重均显著高于CK的原因之一。研究发现番茄对 Cd 的吸收与蒸腾作用呈正相关关系,表明植物的蒸腾作用在对重金属的吸收过程中起着重要作用[22];研究表明,Tr的显著上升有助于Cd向地上部转运[17],这可能是圆叶锦葵叶片中Cd含量增加和具有较高转运系数的原因之一。
3.2 Cd对光合色素含量的影响
Cd对植物光合作用的影响主要表现为Cd对植物的光合色素等有破坏作用,进而影响植物的光合效率[20-21]。Cd2+对植物光合作用的影响是一个系统而复杂的过程,相关机理研究尚处于探索阶段[17,20-21]。叶绿素的含量决定了植物光合作用的强弱,重金属胁迫下,叶绿素含量的变化可反映重金属对植物的损害状况[23]。研究发现低浓度Cd胁迫下,短期内Cd对叶绿素的合成有刺激作用,超过一定浓度后,则对叶肉组织产生危害作用,破坏叶绿素结构,抑制叶绿素的合成,从而导致叶绿素含量降低[24-25]。Cd胁迫下,黄麻[18]、美洲狼尾草[26]叶片中光合色素含量显著降低;超富集植物欧洲千里光[27]幼苗总叶绿素含量显著降低。也有研究表明,Cd胁迫下植物会产生一定的保护机制[28]。如印度芥菜[29]通过将Cd储存在叶片的表皮毛中,避免重金属对光合作用的损害。而本研究中,随着叶片中Cd含量的增加,5~100 mg·kg-1Cd处理的光合色素含量均显著高于CK,这可能是由于叶片耐受Cd的临界阈值远大于100 mg·kg-1,使得圆叶锦葵对Cd具有较高的耐性,因而5~100 mg·kg-1Cd处理对圆叶锦葵光合色素的含量产生了促进作用,这与蓖麻[30]在Cd胁迫下光合色素含量下降的研究结果不一致。
在植物体内,类胡萝卜素的作用主要体现在吸收光能、避免叶绿素和叶绿体的光氧化损失、清除叶片内活性氧自由基等方面[20,31]。研究发现,0~150 mg·kg-1Cd胁迫下,植物的类胡萝卜素含量均高于叶绿素含量[32],这与本研究结果一致,可能是因为胁迫条件下植物的类胡萝卜素含量增加,较高的类胡萝卜素可以对三线态叶绿素进行猝灭,清除氧自由基,以此提高天线色素的热耗散,使 PSⅡ反应中心免遭破坏[33]。在本研究中,5~100 mg·kg-1Cd处理增加了类胡萝卜素的含量,较多的类胡萝卜素可以清除叶片内的活性氧自由基,进而缓解圆叶锦葵的氧化胁迫,这可能是引起5~100 mg·kg-1Cd处理下MDA含量降低的原因之一。
3.3 Cd胁迫下抗氧化酶与光合作用的关系

4 结论
本研究结果表明,Cd处理下,圆叶锦葵叶片Pn的变化既受气孔因素又受非气孔因素的影响。0~5 mg·kg-1Cd处理下的光合作用受气孔因素和非气孔因素(叶面积、光合色素和抗氧化酶等)的影响;而5~100 mg·kg-1Cd处理下的光合作用受到气孔因素影响。Cd处理下,圆叶锦葵表现出较强的光合耐性,对Cd具有较强的转运能力和超富集特征,是一种潜在的Cd超富集植物。然而,Cd处理下圆叶锦葵的光合耐受和超富集Cd的机制尚不清晰,今后可通过生理、细胞及分子水平的研究进一步阐明其对Cd的解毒和富集原因。

