鹅肝酶解物对酒精性脂肪肝的改善作用
赵 金 潘道东 孙杨嬴 曹锦轩 曾小群
(宁波大学食品与药学学院/浙江省动物蛋白食品精深加工技术重点实验室,浙江 宁波 315211)
随着生活水平的提高,生活方式、饮食结构的变化,酒精滥用现象越来越普遍[1]。由此引发的酒精性脂肪肝是酒精性肝病的早期病变阶段[2],长期过量饮酒会使其加重,转变为不可逆的酒精性肝炎、酒精性肝纤维化或酒精性肝硬化[3-4],临床症状为非特异性,可无症状或右上腹胀痛、食欲不振、乏力、体重减轻等[5]。目前,酒精性脂肪肝发病机制尚不明确,但酒精及其代谢产物导致的脂肪代谢异常、脂质过氧化损伤[6]及氧化应激[7]等都与之相关。国内外缺少疗效显著的治疗药物,因此,亟需研制出对酒精性脂肪肝具有抑制作用的药物。
我国被誉为“世界水禽王国”,鹅的饲养量、存栏量、屠宰量均位居世界第一[8]。但鹅副产品肝脏的利用方式仍局限于初级加工,如制成鹅肝酱或肥料[9],经济价值较低。研究表明,禽类肝脏在酶解物中产生大量游离氨基酸、蛋白质、有益机体健康的金属离子及抗氧化肽[10-11],且抗氧化肽分子量多位于10 kDa以下[12]。鹅肝在酶解过程中可以释放出大量具有生物活性(抗氧化、金属螯合)的天然小肽[13],其安全性更高,具有较好的研究价值。王立等[10]利用胰酶酶解鹅肝,发现酶解物具有抗氧化活性。舒沿沿等[13]进一步利用解淀粉芽孢杆菌(Bacillusamyloliquefaciens)、地衣芽孢杆菌(Bacilluslicheniformis)、嗜酸乳杆菌(Lactobacillusacidophilus)混合发酵制备鹅肝肽,并利用Sephadex G-25凝胶层析分离得到P1、P2、P3三种抗氧化肽。但有关鹅肝酶解物对酒精引起的脂肪肝的防治效果尚鲜见报道。在前人研究的基础上,本试验利用SD大鼠酒精性脂肪肝模型研究鹅肝酶解物体内保肝护肝作用,探讨鹅肝酶解物对酒精性脂肪肝的改善作用,以期为开发治疗酒精性脂肪肝的药物提供理论依据。
1 材料与方法
1.1 材料与试剂
SPF级6周龄雄性Sprague-Dawley (SD) 大鼠32只,体质量260±10 g,购自Sino-British SIPPR/BK Lab.Animal Ltd(杭州);鹅肝由宁波曙海食品有限公司提供;胃蛋白酶(3 000 NFU·mg-1),北京索莱宝科技有限公司;Lieber-DeCarli 乙醇液体饲料,南京特罗菲饲料科技有限公司;总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)测定试剂盒,北京中生北控生物科技股份有限公司;肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)、白介素-1(interleukin-1,IL-1)、单核细胞趋化蛋白-1(monocyte chemotactic protein 1,MCP-1)酶联免疫分析试剂盒,上海源叶生物科技有限公司;总DNA提取试剂盒,美国Omega生物科技有限公司。
1.2 主要仪器与设备
PL403 电子天平,梅特勒-托利多公司;XHF-D 高速分散器,宁波新芝生物科技股份有限公司;H1850R 台式高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;BT3000 全自动生化分析仪,意大利奔腾公司;FD-1D-80 真空冷冻干燥机,北京博医康实验仪器有限公司;Spectar Max 190 酶标仪,美国Molecular Devices 公司。
1.3 试验方法
1.3.1 鹅肝酶解物的制备 获得的新鲜鹅肝用聚乙烯袋包装后立即于-20℃冷冻保存。试验前一天,将鹅肝小块在2℃的冰箱中过夜解冻。鹅肝酶解物(goose liver hydrolysate,GLH)的制备参考Chou等[12]的方法。将去离子水以1∶2的质量比加入解冻后的鹅肝中,均质3 min,调节pH值至2.0,然后95℃加热 10 min使肝内的内源酶变性。冷却后,鹅肝匀浆液和胃蛋白酶以400∶1的质量比混合,于37℃酶解2 h。酶解完成立即将匀浆液加热至95℃并保持15 min。水解产物在2 000×g、4℃条件下离心15 min,用滤纸过滤上层液体,最后采用真空冷冻干燥机将所得液体冻干成粉,即得到GLH粉末。
1.3.2 动物分组及给药方法 32只6周龄SD雄性大鼠在室温22±2℃、相对湿度55%±5%、光照:黑暗=12 h:12 h条件下用标准实验室饲料饮食适应一周后,随机分成4组,每组8只。其中, 对照组:Lieber-DeCarli液体对照饲料+生理盐水(灌胃);模型组:Lieber-DeCarli乙醇液体饲料+生理盐水(灌胃); GLH-H组:Lieber-DeCarli乙醇液体饲料+ 600 mg·kg-1BW GLH(灌胃);GLH-L组:Lieber-DeCarli乙醇液体饲料+ 200 mg·kg-1BW GLH(灌胃)。模型组、GLH-H组、GLH-L组中的大鼠给予足够饲料,而配对喂养的对照组接受与前一天模型组大鼠相同的饮食量。液体饲料按使用说明现用现配,每天早上9:00进行灌胃,下午5:00点进行液体饲料的替换。用Lieber-DeCarli液体饲料喂养5周,每周记录一次大鼠体重变化。
1.3.3 标本的采集和处理 在喂养第42天下午 5:00 撤去饲料和水,按照组别收集其粪便(-80℃冰箱保存),然后所有大鼠禁食过夜。第二天采用心尖取血,将收集到的血液于4℃冰箱静置过夜,3 500 r·min-1离心10 min,取上层血清并保存在-80℃冰箱中,备用。大鼠断颈处死后进行解剖,取其各组织(肝脏、心脏、肾脏、肺脏和脾脏),用生理盐水漂洗、滤纸试干称重后,快速放入液氮中冷冻,待解剖完成后转移至-80℃冰箱中保存,备用。肝脏在试干称重后分离出一部分,放入体积分数4%甲醛溶液固定24 h保存,随后用石蜡包埋切片,应用苏木精-伊红染色法(hematoxylin-eosin staining,HE)法染色[14],光镜下观察组织病理学变化。
1.3.4 生化指标的测定 血清中尿素氮(blood urea nitrogen,BUN),总胆固醇(total cholesterol,TC),甘油三酯(triglyceride,TG)的含量采用全自动生化分析仪进行测定[15]。
1.3.5 炎症因子的测定 血清中肿瘤坏死因子-α(TNF-α)、白介素-1(IL-1)、单核细胞趋化蛋白-1(MCP-1)含量的测定均按照相应试剂盒的使用说明进行。
1.3.6 肠道微生物的测定 按照Stool DNA Kit的使用说明提取各组样品中的总DNA,最终将总DNA在50 μL洗脱缓冲液中洗脱并储存在-80℃冰箱中,随后委托上海生工进行高通量测序并对各样品中微生物多样性进行分析。
1.3.7 数据分析 本试验所得数据均采用SPSS 16.0软件进行处理,结果均以均值+标准差表示。组间差异采用单因素方差分析(one-way ANOVA),P<0.05表示组间差异性显著。
2 结果与分析
2.1 鹅肝酶解物对酒精性脂肪肝大鼠肝脏细胞脂肪变性的影响
对照组大鼠的肝小叶结构清晰,肝内无脂肪变性,肉眼观察肝脏呈鲜红色,说明肝内没有明显的脂肪堆积(图1-A);模型组肝细胞普遍明显肿大,具有严重脂肪变性现象,核增大,肉眼观察肝脏颜色呈淡红色,肝内有明显的脂肪空泡(图1-C);GLH-L剂量组肝细胞有中度脂肪变性现象(图1-D);GLH-H高剂量组肝细胞只有较少的脂肪空泡,属于轻度脂肪变性(图1-B)。综上表明,大鼠酒精性脂肪肝模型建立成功,且GLH对酒精性脂肪肝具有明显的改善作用,高剂量组改善效果优于低剂量组。

注:A:对照组;B:GLH-H组;C:模型组;D:GLH-L组。Note: A: Control. B: GLH-H group. C: Model group. D: GLH-L group.图1 大鼠肝脏HE染色后的病理切片图(HE,×200)Fig.1 Pathology slice images of mouse liver after HE staining (HE, ×200)
2.2 鹅肝酶解物对酒精性脂肪肝大鼠体质量及肝脏指数的影响
由表1可知,试验开始时各试验组大鼠体重无显著性差异,而试验结束时各试验组大鼠体重差异显著。与对照组相比,模型组大鼠体重显著降低(P<0.05),而GLH-L组、GLH-H组大鼠体重均介于对照组和模型组大鼠体重之间,表明在长期饮酒的情况下,大鼠食用相同体积的饲料,酒精会使体重降低。与对照组相比,模型组大鼠肝脏指数显著增大(P<0.05),符合酒精性脂肪肝大鼠的特点[16];与模型组相比,GLH-H组大鼠肝脏指数显著减小(P<0.05),GLH-L组大鼠肝脏指数也有所下降,但无统计学差异。综上表明,高剂量的GLH可以改善酒精性脂肪肝引起的大鼠体重增长,减缓肝脏指数增大的症状。
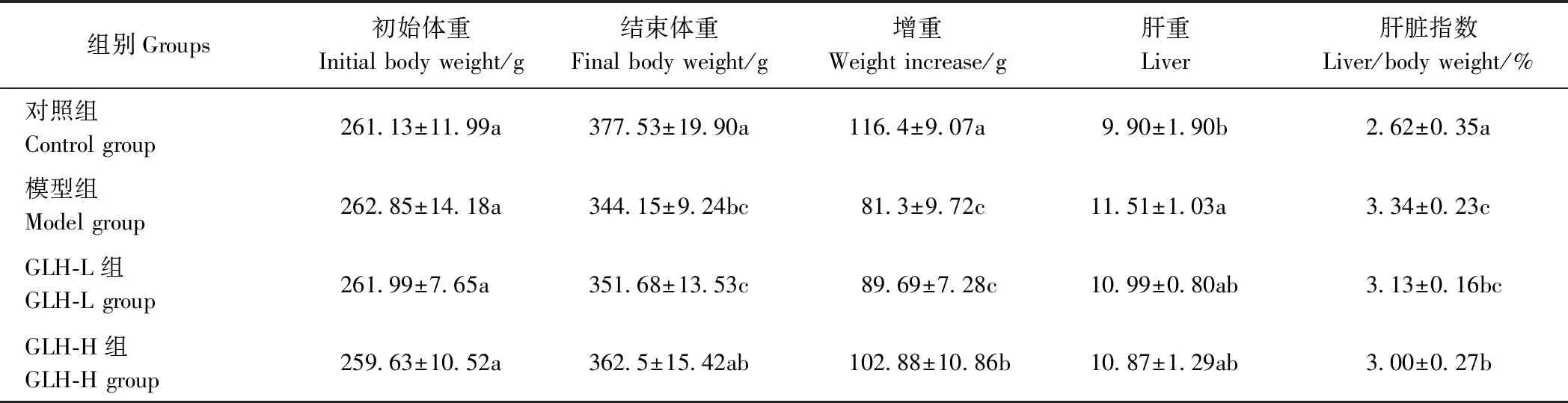
表1 GLH对酒精性脂肪肝大鼠体质量及肝脏指数的影响Table 1 Effect of GLH on body weight and liver index in rats with alcoholic fatty liver
注:同列不同小写字母表示差异显著(P<0.05)。下同。
Note: Different lowercase letters in the same line indicate significant difference at 0.05 level. The same as following.
2.3 鹅肝酶解物对酒精性脂肪肝大鼠血生化指标的影响
由表2可知,与对照组相比,模型组大鼠血清中尿素氮、总胆固醇和甘油三酯含量显著增加,与模型组相比,GLH-H 组大鼠血清中尿素氮、总胆固醇和甘油三酯含量均显著降低;GLH-L组大鼠血清中尿素氮和总胆固醇较模型组大鼠无显著变化,甘油三酯含量显著下降。上述结果说明,只有当GLH剂量足够高时才能对酒精性脂肪肝大鼠血清学指标具有显著的改善作用。
2.4 鹅肝酶解物对酒精性脂肪肝大鼠血清中炎症因子的影响
由图2可知,与对照组相比,模型组大鼠血清中各炎症因子含量均显著性升高;GLH-H组和GLH-L组大鼠血清中的炎症因子含量均高于对照组,显著低于模型组。上述结果说明,GLH只需要很低的剂量就可以显著的改善酒精性脂肪肝大鼠血清中的炎症水平。
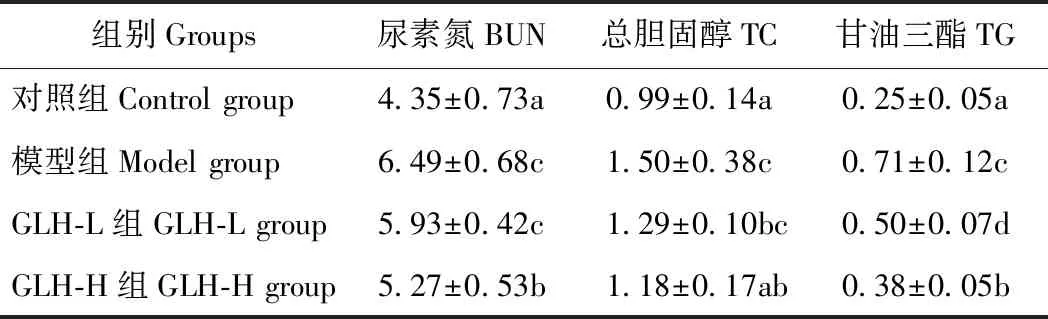
表2 GLH对酒精性脂肪肝大鼠血清尿素氮、总胆固醇、甘油三酯的影响Table 2 Effect of GLH on serum BUN, TC and TG in rats with alcoholic fatty liver /(mmol·L-1)

注:不同小写字母表示不同组别的同一炎症因子含量差异显著(P<0.05)。Note: Different lowercase letters indicate significant difference in the content of the same inflammatory factor in different groups at 0.05 level.图2 GLH对酒精性脂肪肝大鼠血清中炎症因子的影响Fig.2 Effect of GLH on inflammatory cytokine on serum in rats with alcoholic fatty liver
2.5 鹅肝酶解物对酒精性脂肪肝大鼠肠道微生物的影响
由图3可知,在门水平上,无论是对照组、模型组、还是GLH-H组、GLH-L组大鼠,其肠道微生物的组成均主要为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroietes)、变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)和放线菌门(Actinobacteria)。与对照组相比,模型组大鼠肠道微生物中厚壁菌门相对含量减少,拟杆菌门、变形菌门、疣微菌门相对含量增加,放线菌门几近消失;与模型组相比,GLH-H组和GLH-L组大鼠肠道中厚壁菌门相对含量增加,变形菌门相对含量减少。其中,模型组厚壁菌门/拟杆菌门的相对丰度比值(3.33)显著低于对照组(11.07)(P<0.05),而GLH-H组和GLH-L组厚壁菌门/拟杆菌门的相对丰度比值(4.75)显著高于模型组(P<0.05)。综上表明,在给予GLH治疗后,酒精性脂肪肝大鼠肠道菌群紊乱现象得到改善。
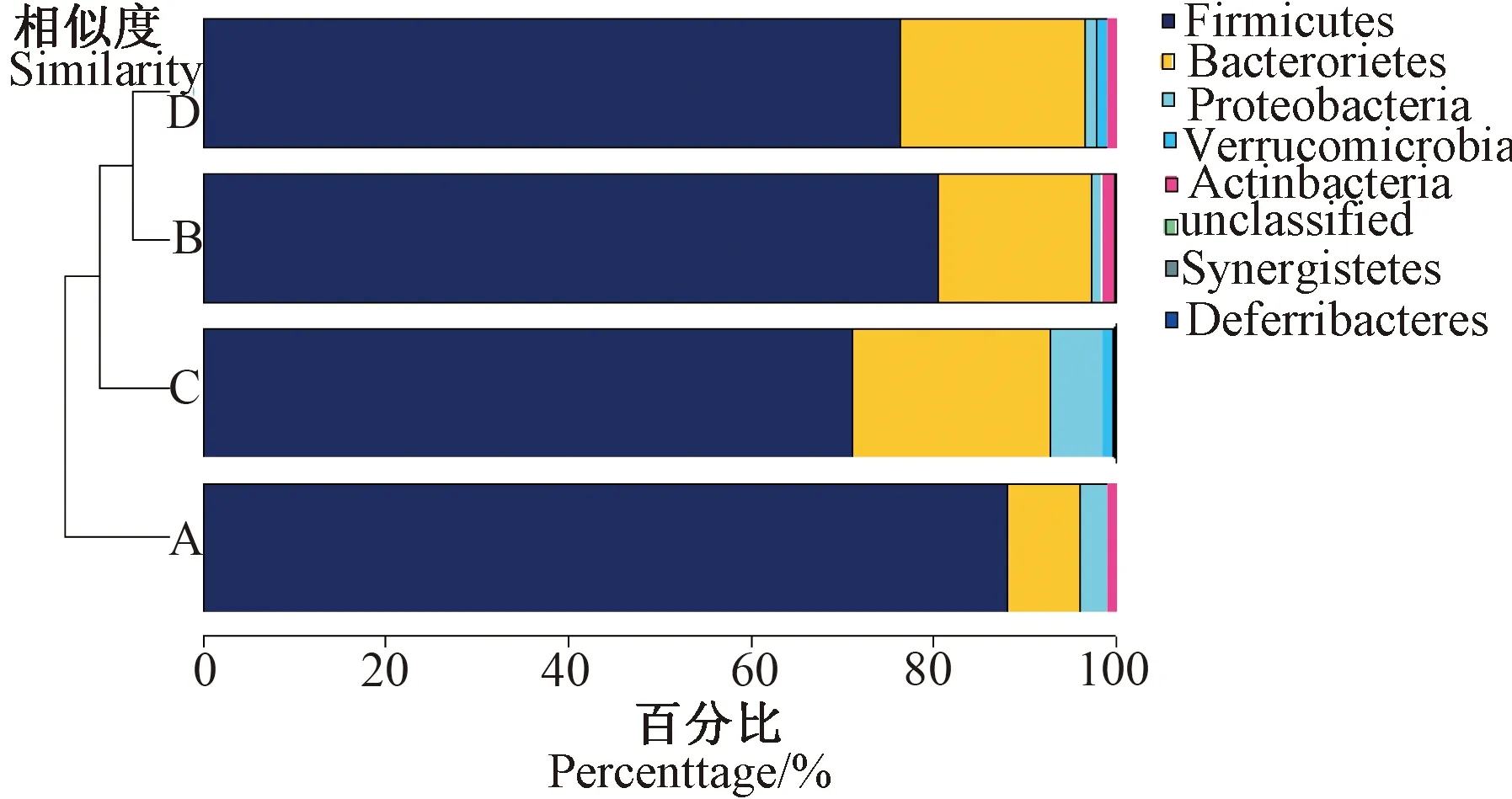
图3 GLH对酒精性脂肪肝大鼠门水平肠道微生物组成的影响Fig.3 Effect of GLH on the composition of intestinal floral on phylum level in rats with alcoholic fatty liver
3 讨论
本试验通过饲喂SD大鼠Lieber-DeCarli 酒精液体饲料5周,建立酒精性脂肪肝模型研究鹅肝酶解物对酒精性脂肪肝的干预和作用机理,HE染色结果显示,模型组大鼠肝小叶出现大量脂肪空泡,肝细胞普遍明显肿大,具有严重脂肪变性现象,表明肝内出现了脂肪沉积,这与Ajmo等[17]和Bai等[18]的研究结果相同,说明本次酒精性脂肪肝模型建立成功。本研究结果表明,与对照组比较,模型组大鼠的肝细胞脂肪变性明显;与模型组相比,GLH-H组和GLH-L组大鼠的肝细胞脂肪变性明显减轻。
本试验中,食用相同体积的液体饲料,模型组大鼠体重显著低于对照组,这是由于酒精使模型组大鼠对食物的利用率下降[19],而GLH-H组和GLH-L组逆转了这一现象,且GLH-H组大鼠的体重更接近对照组大鼠体重,说明GLH可提高酒精性脂肪肝大鼠对食物的利用率。此外,模型组大鼠的肝脏指数显著增大,这是酒精性脂肪肝的特点之一[20],而GLH-H组显著降低了酒精性脂肪肝大鼠的肝脏指数。
甘油三酯是体内能量的重要来源,也是人体内含量最多的脂类,其合成的主要场所在肝脏[21]。慢性酒精摄入通过控制转录调控因子PGC-1a 和 SREBP-1c来抑制脂肪酸氧化,促进脂质生成,进而导致肝脏中甘油三酯的积累[22]。本试验结果表明,与对照组相比,模型组大鼠血清中尿素氮、甘油三酯、总胆固醇含量均显著增加,其中大鼠血清甘油三酯含量约为对照组大鼠的3倍,模型组大鼠血清中总胆固醇含量较对照组有显著性升高,这与前人研究结果相似[23-25]。此外,经GLH治疗后,大鼠血清中总胆固醇和甘油三酯含量均显著降低,GLH-H组大鼠总胆固醇和甘油三酯含量接近对照组,说明GLH具有抑制TC生成、促进TG氧化分解的作用,进而影响脂质分布、运转与清除。
脂肪细胞因子,如传统炎症及免疫因子的启动和致敏是酒精性脂肪肝形成的关键步骤[26]。慢性酒精摄入刺激激活库否细胞(Kupffer cells,KC),产生大量TNF-α、IL-1和MCP-1等炎症因子[27]。炎症通路激活在乙醇导致的肝脏损伤中也发挥重要的作用,其中炎症因子TNF-α 可以导致肝细胞坏死。本研究中,与对照组相比,模型组大鼠在酒精的刺激下,炎症因子大量增加,其中TNF-α、IL-1和MCP-1含量分别约为对照组大鼠的1.78倍、1.55倍、1.63倍,但经GLH治疗后,大鼠血清中炎症因子的水平均显著下降,其中GLH-H组血清中的TNF-α含量与对照组无显著差异。
肠道微生物是人体内最重要的微生物群落,其本身及其代谢产物共同参与机体的物质能量代谢及免疫调节[28],在能量的摄取、转化、储存的过程中起到了非常重要的作用。研究表明,肠道菌群结构与某些代谢综合征和心血管疾病相关[29-30],但肠道微生物和酒精性脂肪肝的互作关系的具体机制尚不清楚。有学者认为酒精的摄入会引起肠道微生物紊乱和过度增殖[31],酒精破坏了肠道屏障的完整性,对细菌源产物的渗透性增加,而这些产物加剧了酒精性脂肪肝的形成;也有学者认为细菌的过度增殖增加了乙醇代谢产物(乙醛)的浓度,而高浓度的乙醛促进脂肪合成酶活性的升高及脂肪合成量的增加,加剧肝内脂肪酸和甘油三酯的沉积[28]。研究表明,通过“肠-肝”轴,肠道菌群紊乱及其代谢物对肝病具有重要的调节作用[32]。饮酒者结肠中变形菌门的增加会升高乙醛的浓度,这会影响细胞间的紧密结合和增加肠道的通透性[33]。本研究结果表明,酒精抑制了肠道中厚壁菌门的生长,促进了拟杆菌门、变形菌门的生长。而大鼠饲喂GLH后,使得其肠道中厚壁菌门与拟杆菌们的比例重新得到了回升,说明GLH对酒精性脂肪肝大鼠肠道菌群失调具有一定的改善作用。
4 结论
酒精性脂肪肝具有可治疗性,这种程度的肝损伤具有可逆性。本试验结果表明,GLH具有调节酒精性脂肪肝大鼠肝功能指标,可以减轻酒精性脂肪肝大鼠肝小叶中的脂滴堆积的现象,预防因酒精刺激所产生的肝肿大,同时GLH可以改善酒精性脂肪肝大鼠肠道菌群紊乱的现象,说明GLH具有明显的预防酒精性脂肪肝发生的作用。接下来可进一步研究其有效成分,以便为开发治疗酒精性脂肪肝药物提供理论基础。

