厚壳贻贝Mytilin-1成熟肽在毕赤酵母中的重组表达及其抑菌活性
张亚莉 陶妍 谢晶 钱韻芳
(上海海洋大学食品学院 上海水产品加工及贮藏工程技术研究中心,上海 201306)
近年来,随着水域环境的污染,水生生物遭受病原微生物侵染的问题越来越严重。而贝类等软体动物虽然自身缺乏基于T淋巴细胞和免疫球蛋白的获得性免疫功能,但却能抵御环境中病原微生物的侵害,这种防御机制得益于其拥有内源性的免疫系统[1]。抗菌肽则是贝类先天性免疫系统的第一道防线,对于维持其机体的健康和稳定起了关键性的作用,因此被认为是开发天然抗菌剂的良好候选者。
目前,已经报道的关于贝类抗菌肽的研究大部分聚焦于贻贝。Mitta等[2]在地中海贻贝(Mytilus galloprovincialis)和紫贻贝(Mytilus edulis)中发现了多种类型的抗菌肽,且各种类存在多样性,他们按照这些抗菌肽在一级结构和半胱氨酸数目上的差异将其分为4类:防御素(Defensins)、贻贝素(Mytilins)、贻贝肽(Myticins)和贻贝霉素(Mytimycin)。从地中海贻贝血淋巴中分离纯化到的Defensin A和B均含有6个半胱氨酸残基,可形成3个分子内二硫键[3-4];而从其血细胞和血清中分离到的Myticin A和B含有8个半胱氨酸残基,两者都可形成4个分子内二硫键,但具有不同的半胱氨酸排列模式[5]。Mytimycin则是从紫贻贝的血清中分离得到的,包含12个半胱氨酸残基,可形成6个分子内二硫键[6]。至于Mytilins的成熟肽,由34个氨基酸残基组成,含有8个半胱氨酸残基,它们与Myticins的区别主要是成熟肽一级结构的氨基酸残基数目[7]。王日昕等[8]从厚壳贻贝(Mytilus coruscus)的血清中分离纯化到3种Mytilin,分别命名为Mytilin-1、Mytilin-2和 Mytilin-3, 这 3种 Mytilin的成熟肽序列之间存在数个氨基酸残基的差异。孙敬敬等[9]从厚壳贻贝的血清中分离到一种不同于上述4类抗菌肽的新型抗菌肽,将其命名为Mytichitin-A,该抗菌肽含6个半胱氨酸残基,具有几丁质结合结构域,且具有较强的抑制革兰氏阳性菌的活性。
迄今为止,已有一些厚壳贻贝来源的上述抗菌肽的重组DNA表达方面的研究报道。仲燕等[10]通过反转录从厚壳贻贝的血清中分离到Myticin A基因,并通过真核表达系统获得了重组Myticin A,发现它对巨大芽孢杆菌(Bacillus megaterium)具有抑制作用;Meng等[11]则对厚壳贻贝血清中新分离到的Mytichitin A做了真核重组表达,证明重组蛋白具有抑制金黄色葡萄球菌(Staphylococcus aureus)和枯草芽孢杆菌(Bacillus subtilis)的活性。武梅等[12]曾构建了厚壳贻贝Mytilin-1,2,3的真核表达载体,但未能在酿酒酵母(Saccharomyces cerevisiae)S78细胞中完成重组蛋白的表达。Shan等[13]通过大肠杆菌原核表达系统获得了厚壳贻贝重组Mytilin-1成熟肽,证明该重组蛋白对金黄色葡萄球菌和大肠杆菌具有抑制作用。但是较之真核表达系统,原核表达系统存在一些众所周知的缺点,如外源蛋白对宿主细胞容易产生毒害作用、新生肽链无折叠功能,并且易形成不溶的包涵体而丧失活性。据此,本研究拟通过建立厚壳贻贝Mytilin-1成熟肽的真核表达系统,获得具有良好抑菌活性的重组Mytilin-1,旨在为贝类来源的天然抗菌剂的基因工程制备提供技术途径。
1 材料与方法
1.1 材料
1.1.1 菌株和载体 大肠杆菌DH5α购自天根生物科技有限公司(北京);毕赤酵母X-33和表达载体pPICZαA购自Invitrogen公司(美国);用于抑菌试验的枯草芽孢杆菌、金黄色葡萄球菌和大肠杆菌属(Escherchia coli)为本实验室保存。
1.1.2 主要试剂 限制性内切酶(XhoI、XbaI和SacI)和T4 DNA连接酶购自TaKaRa公司(日本);TaqDNA聚合酶、DNA分子量标准、质粒小提试剂盒、YNB(无机氮源)和生物素购自天根生物科技有限公司;蛋白质分子量标准购自中科瑞泰生物科技有限公司(北京);博来霉素购自Invitrogen公司;Western blot分析试剂购自康为世纪生物科技有限公司(北京)。
1.1.3 培养基 LB培养基:10 .0 g/L蛋白胨、3.0 g/L牛肉浸出物、5. 0 g/L NaCl;YPD培养基:10 g/L酵母粉、20 g/L蛋白胨、20 g/L葡萄糖、20 g/L琼脂;MM培养基:13.4 g/L YNB、5 mL/L甲醇、0.4 mg /L生物素、15 g/L琼脂;BMG培养基:13.4 g/L YNB、0.4 mg/L生物素、10 mL/L甘油、100 mmol/L磷酸缓冲液(pH6.0);BMM培养基:13.4 g/L YNB、0.4 mg/L生物素、10 mL/L甲醇、100 mmol/L磷酸缓冲液(pH 6.0)。
1.2 方法
1.2.1 目的基因的合成及重组表达载体的构建 参考厚壳贻贝Mytilin-1的全长 cDNA 序列(GenBank登录号:FJ973154.1),根据毕赤酵母的密码子偏爱性对编码其成熟肽的密码子进行优化,并在其5′端添加XhoⅠ酶切位点、Kex2信号肽酶切位点和6×His标签,在其3′端添加两个终止密码子(TAG和TAA)和XbaⅠ酶切位点;该目的基因被命名为“mMy1”,由上海生工生物工程有限公司合成。使用XhoI 和XbaI 对重组克隆质粒“PUC-mMy1”进行双酶切,获得目的基因mMy1后,在T4 DNA连接酶作用下,如图1所示,将其与被同样酶处理过的表达载体pPICZαA连接(16℃,30 min),转入大肠杆菌感受态细胞DH5α中,通过双酶切和DNA测序验证重组表达载体pPICZαA-mMy1是否构建成功。
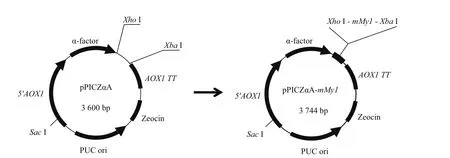
图1 重组表达载体pPICZαA-mMy1的构建
1.2.2 电转化毕赤酵母X-33及高拷贝阳性转化子的筛选 使用SacI对重组表达载体pPICZαA-mMy1进行线性化处理,将其电转入80 μL毕赤酵母X-33感受态细胞中(1 500 V、25 μF、200 Ω、5 ms),加入1 mL 1 mol/L的山梨醇;另外,将pPICZαA空载体以同样的方法电转入毕赤酵母X-33中作为阴性对照;这些转化子在YPD培养基中,于28℃、150 r/min 的条件下培养1.5 h,离心收集菌体涂布于含100 μg/mL博来霉素的YPD平板上,29℃培养3 d;挑取长势良好的菌落分别接种于含1 000 μg/mL博来霉素的YPD平板和MM平板上,筛选高拷贝甲醇利用快速型酵母转化子。对筛选到的转化子提取基因组DNA,使用载体上的通用引物(5′AOX1:5′-GACTGGTTCCAATTGACAAGC-3′,3′ AOX1 :5′-GCAAATGGCATTCTGACATCC-3′)进行 PCR 鉴定。另一方面,对筛选到的酵母转化子进行DNA测序。
1.2.3 重组mMy1的诱导表达 挑取3个阳性转化子接种于5 mL YPD培养基中,29℃、250 r/min 培养24 h;取500 μL转接至50 mL BMG培养基中,培养至OD600为2.0-4.0,离心收集菌体重悬于1 000 mL BMM培养基中,29℃、250 r/min下,1%甲醇诱导表达96 h;在同样条件下对阴性对照进行诱导表达。
1.2.4 Tricine-SDS-PAGE和Western blot分析 培养液经离心后取上清用于Tricine-SDS-PAGE分析[14],分离胶和浓缩胶浓度分别为16.5%和4%。经Tricine-SDS-PAGE后的凝胶电转至0.22 μm的PVDF膜上,用封闭液对膜处理1.5 h,之后用TBST洗膜,加入抗His标签的鼠单克隆抗体,孵育2 h后再用TBST洗膜;再加入辣根过氧化物酶标记的羊抗鼠IgG,孵育1 h后洗膜;采用 HRP-DAB 显色试剂盒进行显色反应。
1.2.5 抑菌实验 将金黄色葡萄球菌、枯草芽孢杆菌和大肠杆菌培养至对数生长期,各取1 μL与100 μL 含重组mMy1的培养液上清混合,37℃孵育2 h后取30 μL涂布于LB平板,37℃培养12 h,观察细菌生长情况。另外,将1 μL菌液与100 μL 含pPICZαA 空载体的转化子的培养液上清混合,同上处理作为阴性对照。
2 结果
2.1 密码子优化后的目的基因mMy1及其重组表达载体pPICZαA-mMy1的鉴定
目的基因mMy1的cDNA序列及其推断的氨基酸序列如图2所示,它由144 bp组成,5′端依次含XhoI位点、信号肽酶切位点(KR)的密码子和6×His的密码子,3′端含XbaI位点和两个终止密码子。mMy1有8个保守的半胱氨酸残基,它们在空间上能形成4对二硫键而稳定了蛋白质的结构。通过ExPASy软件预测,mMy1的理论分子量为4.8 kD、等电点为9.63。
对含pPICZαA-mMy1的大肠杆菌DH5α进行菌落PCR发现,在理论位置646 bp处有明亮条带(图3-A);另外,对pPICZαA-mMy1进行XhoI和XbaI双酶切,结果如图3-B所示,在约144 bp处的小分子量条带与理论值相符。另外,DNA测序结果表明重组表达载体pPICZαA-mMy1已构建成功。
2.2 甲醇利用快速型高拷贝酵母转化子的鉴定
通过含高浓度博来霉素的YPD平板和MM平板筛选到7株长势良好的酵母转化子,提取它们的DNA 作为模板,使用表达载体上的通用引物5′AOX1和3′ AOX1进行PCR鉴定;电泳结果显示:与阴性对照相比,7个转化子均在近700 bp处有明显条带(图4),与646 bp的理论分子量相符,证明pPICZαA-mMy1已成功嵌合进酵母基因组中。
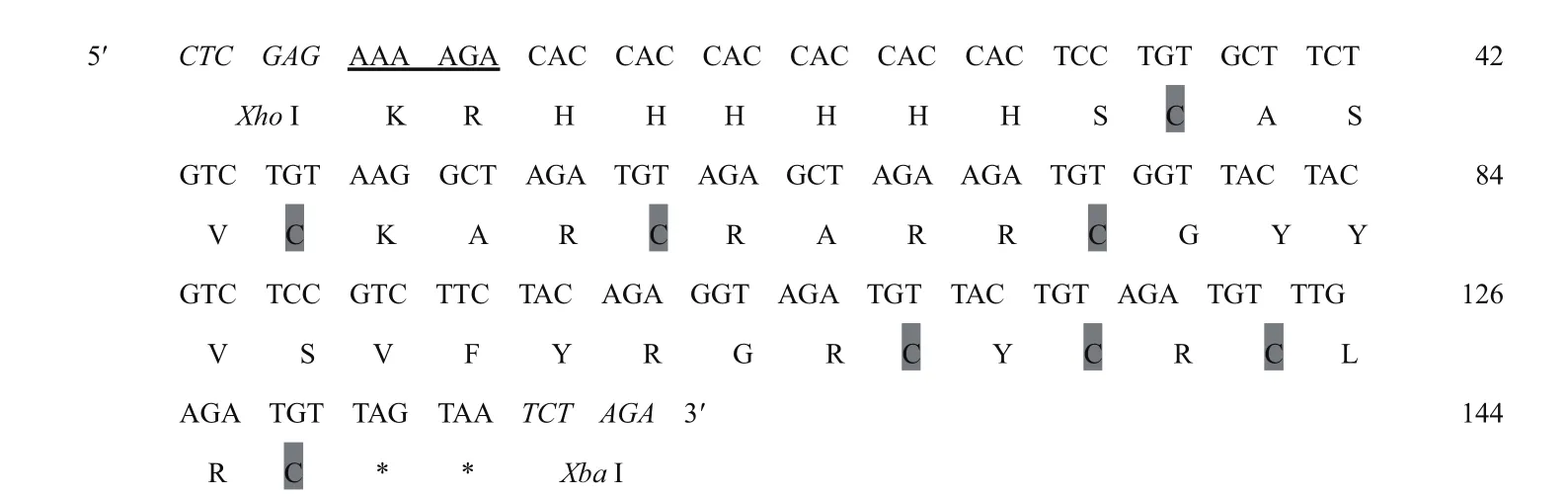
图2 厚壳贻贝mMy1成熟肽的cDNA及推断的氨基酸序列
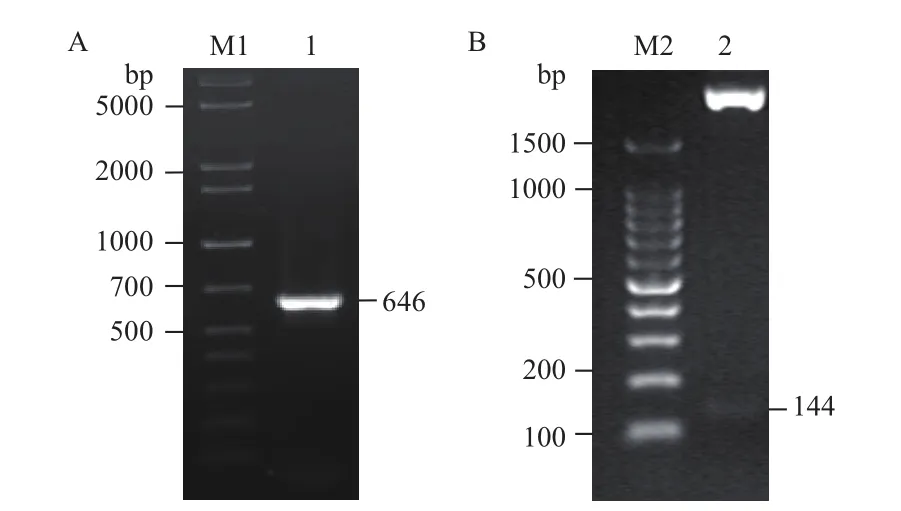
图3 pPICZαA-mMy1的菌落PCR(A)和双酶切鉴定(B)
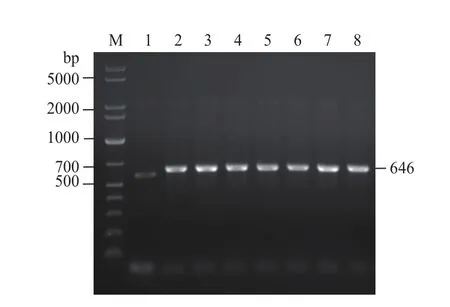
图4 高拷贝酵母转化子的PCR鉴定
2.3 表达产物的Tricine-SDS-PAGE和Western blot分析结果
选取图4中的2号、3号和4号3株酵母转化子,在29℃、250 r/min条件下,使用1%甲醇诱导表达96 h,对它们的培养液上清进行Tricine-SDS-PAGE分析,结果显示(图5):2号转化子在7.8-14.4 kD处有一个明显的条带,而阴性对照的培养液上清则无此条带,故基本证明重组mMy1在毕赤酵母X-33中被表达。值得注意的是,重组mMy1的理论分子量为4.8 kD,但Tricine-SDS-PAGE的分子量偏高,其原因可能是因为重组mMy1的分子量太小且带正电荷,使得SDS对其电荷不能完全屏蔽,导致电泳时迁移速度变慢。
另一方面,Western blot分析结果显示(图6):在10 kD处有明显的杂交条带,而阴性对照则未见任何条带,表明了带有6×His标签的目的蛋白与抗His的鼠单克隆抗体发生免疫反应,再与辣根过氧化物酶标记的羊抗鼠IgG反应,经底物显色,显示为杂交条带,故进一步证明重组mMy1在毕赤酵母 X-33中成功表达。但显示的杂交条带的分子量更高,这可能是因为蛋白质分子量标准与显色染料发生共价偶联后在电泳时迁移速度变慢。
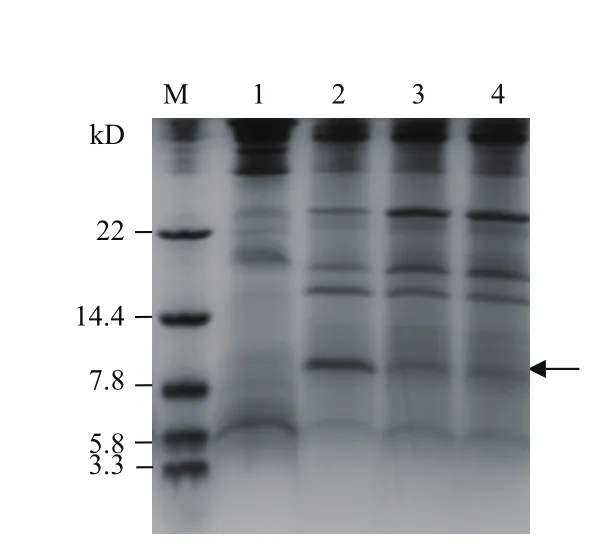
图5 培养液上清的Tricine-SDS-PAGE分析

图6 培养液上清的Western blot分析
2.4 重组mMy1的抑菌活性
由图7所示,金黄色葡萄球菌、枯草芽孢杆菌和大肠杆菌分别与含重组mMy1的培养液上清作用后,平板上的菌落数明显减少;而阴性对照(不含重组mMy1的培养液上清)对上述3种细菌无抑制作用,据此可初步证明重组mMy1具有良好的抑菌活性。
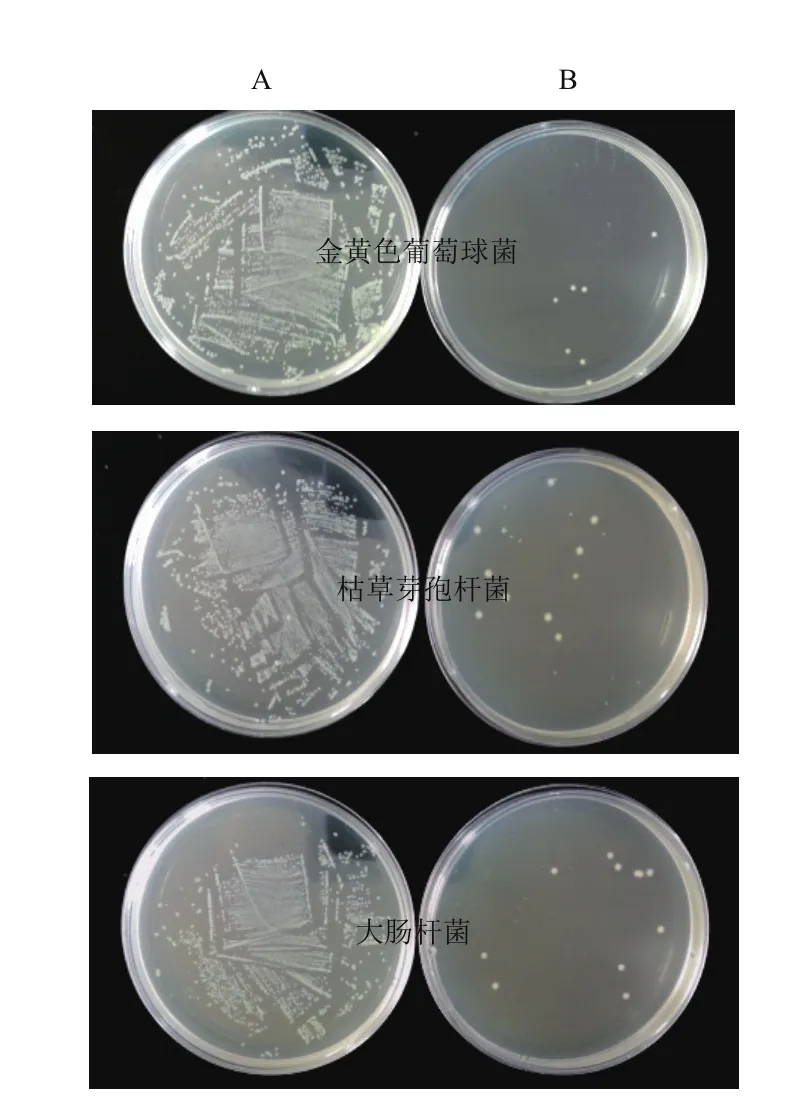
图7 含重组mMy1的培养液上清的抑菌活性
3 讨论
厚壳贻贝来源的抗菌肽中,Mytilin是相对丰度较高、同工型最多的一种抗菌肽,它们在厚壳贻贝的免疫系统中发挥了很重要的作用。参考王日昕等[8]在厚壳贻贝的血清中分离到的编码Mytilin-1的cDNA序列,根据Graphical Codon Usage Analyser(http://www.gcua.schoedl.de/)预测,我们发现该cDNA中存在7个对于毕赤酵母来说的低频密码子,并对这些密码子进行了优化。Zhou等[15]对树舌灵芝中的两种新型真菌免疫调节蛋白(Fungal immunomodulatory proteins,FIPs)的密码子进行优化后,重组蛋白的产量显著提高;王方芹等[16]对黑曲霉的α-L-鼠李糖苷酶基因rha进行了密码子优化发现,重组蛋白的酶活力提高了2.7倍。
毕赤酵母表达系统有利于外源蛋白的分泌表达、具有良好的翻译后折叠修饰功能,便于获得具有生物学活性的重组蛋白[17];并且在促进二硫键形成方面比大肠杆菌更有效[18],这对于富含二硫键的Mytilin-1来说尤为重要。近年来,我们致力于鱼贝类来源抗菌肽的真核重组表达,已经通过毕赤酵母表达系统获得斑点叉尾鮰(Ictalurus punctatus) 来源的重组表达的c型溶菌酶[19]、LEAP2[20]和 hepcidin[21],以及三疣梭子蟹(Portunus trituberculatus)的重组 c型溶菌酶[22]。根据前期研究发现,甲醇浓度和诱导表达时间是影响目的蛋白表达的两个重要因素。甲醇浓度过低(<1%)会导致小分子量的杂蛋白出现;反之,则对毕赤酵母工程菌的生长有影响。而表达时间过长,会使培养液的pH降低而影响目的蛋白的活性。据此,本研究确定的目的重组蛋白的表达条件为在29℃、250 r/min、pH 6.0条件下,使用1.0%甲醇诱导表达96 h。
虽然如上所述,对目的基因进行了密码子优化,但重组mMy1的表达量较低,仅为2 mg/L,其原因可能与重组mMy1的分子量偏小且带正电荷有关。已有研究发现,小分子外源蛋白对宿主菌具有潜在的杀伤作用,而阳离子肽在表达过程中易被蛋白酶降解[23]。近来,Liang等[24]报道了将抗乙肝病毒表面抗原单链抗体(HBscFv)的基因与γ干扰素(IFNγ)的基因连接,在毕赤酵母X-33中进行融合表达,获得的重组HBscFv-IFNγ显示了对乙肝病毒(Hepatitis B virus,HBV)的结合活性。因此,进一步的研究将聚焦于mMy1与大分子蛋白质基因的串联,以期实现重组融合蛋白的表达,进而获得高表达量的目的蛋白。
本研究获得的重组mMy1对革兰氏阳性的金黄色葡萄球菌和枯草芽孢杆菌以及革兰氏阴性的大肠杆菌都显示了抑菌活性,这与Shan等[13]的研究结果基本一致,他们通过大肠杆菌原核表达系统获得了重组厚壳贻贝Mytilin-1成熟肽,该重组蛋白显示了对金黄色葡萄球菌和大肠杆菌的抑菌活性。重组mMy1的抑菌活性可能与其携带的15个碱性氨基酸中的8个精氨酸有关,因带较多的正电荷,它能够与细菌细胞膜表面所含的带负电荷的酸性脂质作用,进而破坏细胞膜[25],其抑菌机理还有待于进一步阐明。
4 结论
本研究根据毕赤酵母的密码子偏爱性对编码厚壳贻贝Mytilin-1成熟肽的密码子进行优化合成,通过构建重组表达载体pPICZαA-mMy1,在毕赤酵母X-33中,于29℃、250 r/min条件下,经1%甲醇诱导表达96 h,成功获得重组目的蛋白mMy1;抑菌试验证明该重组蛋白对革兰氏阳性的金黄色葡萄球菌和枯草芽孢杆菌以及革兰氏阴性的大肠杆菌均有明显的抑菌活性。

