绿色木霉耐高温葡萄糖氧化酶的特性分析
高兆建,王先凤,尚业成,许 祥,李宝林,张抗震,焦 魏
(1.徐州工程学院食品(生物)工程学院,江苏 徐州 221018;2.江苏智荟生物科技有限公司,江苏 徐州 221018;3.江苏太合食品有限公司,江苏 徐州 221018;4.邳州市金大地肥料有限公司,江苏 徐州 221100)
葡萄糖氧化酶(glucose oxidase,GOD)是一种需氧脱氢酶,全称为β-D-吡喃型葡萄糖需氧脱氢酶,它可以在有氧条件下专一性地催化β-D-葡萄糖氧化成D-葡萄糖酸-1,5-δ-内酯和伴随的分子氧还原为过氧化氢,在水相体系中D-葡萄糖酸-1,5-δ-内酯自动水解为葡萄糖酸[1-2]。GOD对多种糖有氧化性,但葡萄糖、2-脱氧-D-葡萄糖、D-果糖、D-甘露糖共同存在时,GOD对葡萄糖有非常高的催化特异性,而对其他糖氧化能力极其微弱[3]。
基于以上特性,GOD应用领域十分广泛,在食品、轻工业、医药及生物等领域都有应用[4]。在食品行业中,GOD可以除去饮料、红酒、蛋粉中残留的葡萄糖及氧气,从而防止食品发生褐变,延长保质期[5]。而目前应用最多的则是用作生物传感器,用于在线监控发酵液中残余葡萄糖含量,或在医药行业中GOD制成方便快捷使用的检测试纸如尿糖试纸、血糖试纸[6]。目前所报道的GOD多来源于曲霉属中的黑曲霉和青霉属[7-10]。不同来源的GOD酶学性质有所不同[11-12]。Simpson等[13]报道了从青霉菌CBS 120262中分离的GOD,酶蛋白由分子质量均为70 kDa的两个相同亚基构成,酶最适作用温度在25~30 ℃,最适作用pH 6~8。苏茉等[14]从黑曲霉发酵液中分离纯化了GOD,该酶最适温度为37 ℃,最适pH 5.7,在30~40 ℃范围内稳定性较好,在pH 4.0~8.0范围内活性稳定,酶Km值为30.69 mmol/L,Vmax为21.88 μmol/L。石淑钰等[15]从海洋低温菌假单胞杆菌(Pseudomonas migulae)中分离的GOD最适反应温度为20 ℃,超过40 ℃酶活力迅速下降。Blazic等[16]在酵母中成功表达了源于黑曲霉的GOD,并通过离子交换层析和超滤纯化了酶蛋白,蛋白分子质量在100~140 kDa之间,Km值为33.4,最适作用pH 5.0。Khan等[17]从海洋真菌葡萄青霉(Penicillium viticola)中克隆了一个开放阅读框为1 806 个碱基的GOD基因,其编码GOD分子质量为65.5 kDa,等电点5.01。报道的GOD最适作用温度主要在20~40 ℃,酶在较高温度下很快失活。而从工业应用角度考虑,若酶在高温下仍具有高活性高稳定性,则酶更受欢迎[18]。
从发酵液中分离纯化酶蛋白,因发酵液色素、杂蛋白等杂质的存在分离过程更为困难[19],造成高纯度的酶产品成本较高,因此高活力高纯度的GOD主要依赖进口。也因成本因素,限制了其在畜牧养殖业中的广泛应用[20]。另外近年来随着工业制造的转型发展,对高活力、高稳定性、高纯度的GOD需求越来越大。因此寻找这种酶的新生产资源、酶高效分离纯化方法、在苛刻环境保持高稳定性是目前满足市场需要的重要研究课题方向。现已报道的GOD来源非常有限,酶的耐受恶劣条件性能差,如不耐受高温、pH值适用范围窄等。
本研究采用实验室筛选到的1 株高产GOD的绿色木霉(Trichoderma viride),从其发酵液中分离纯化到高纯度酶制剂(T. viride glucose oxidase,TvGOD),所产TvGOD耐高温耐酸性及抗逆性显著,有潜力在工业生产中使用。
1 材料与方法
1.1 材料与试剂
本研究所用产GOD菌株为前期实验室筛选获得,经过生理生化及分子生物学鉴定确定为绿色木霉,菌种编号为WX24,本实验室保存。
DEAE-Sepharose Fast Flow、Phenyl Sepharose 6 Fast Flow、Sephadex G-75 瑞典Amersham pharmacia公司;蛋白质标准分子质量Marker、牛血清白蛋白 美国Sigma公司;考马斯亮蓝R-250 美国Bio-Rad公司;其他试剂均为国产分析纯。
马铃薯葡萄糖琼脂斜面培养基:20 g/100 mL马铃薯,2 g/100 mL葡萄糖,1.5 g/100 mL琼脂,自然pH值,121 ℃灭菌20min;种子培养基:蔗糖2 g/100 mL,蛋白胨0.5 g/100 mL,葡萄糖0.2 g/100 mL,酵母粉0.2 g/100 mL,KH2PO40.05 g/100 mL,MgSO4·7H2O 0.01 g/100 mL,pH 6.0,121 ℃蒸汽灭菌15 min;摇瓶发酵培养基:蔗糖5 g/100 mL,蛋白胨0.8 g/100 mL,酵母粉0.5 g/100 mL,葡萄糖0.5 g/100 mL,NaNO30.5 g/100 mL,KH2PO40.2 g/100 mL,MgSO4·7H2O 0.04 g/100 mL,FeSO40.001 g/100 mL,pH 6.0,121 ℃灭菌20 min。
1.2 仪器与设备
AKTA Explorer 100型蛋白质纯化系统 美国GE公司;Hoefer 2-D电泳系统 美国Hoefer公司;3K30型台式冷冻离心机 德国Sigma公司。
1.3 方法
1.3.1 TvGOD的发酵制备
种子液培养在斜面培养基上接种绿色木霉WX24孢子,32 ℃、200 r/min摇床培养3~4 d。摇瓶发酵采用250 mL锥形瓶,装液量50 mL,121 ℃灭菌15 min后,按照15%的接种量接种种子液37 ℃、200 r/min摇床培养5 d即达产酶高峰。发酵液先用4 层纱布过滤,滤液冷冻离心(4 ℃、10 000 r/min离心15 min),所得的上清液即为粗酶液,于4 ℃保存。
1.3.2 酶的分离纯化
在4 ℃条件下,发酵上清液中加入硫酸铵粉末,4 ℃静置过夜,收集30%~85%饱和度的沉淀,用少量50 mmol/L、pH 6.0磷酸缓冲溶液(缓冲溶液A)溶解,置于透析袋中透析除盐。透析后的粗酶液离心后上样缓冲溶液A平衡好的DEAE-Sepharose(2.6 cm×30 cm)阴离子交换柱,上样后缓冲溶液A洗柱至无蛋白洗脱下来。然后用含0~1.0 mol/L NaCl的缓冲溶液A进行线性梯度洗脱,洗脱速率为1 mL/min,每管收集3 mL。测定收集管中溶液酶活力。有活性部分合并,超滤管超滤浓缩,浓缩后样品硫酸铵浓度调节后,加到已用含1.0 mol/L硫酸铵的pH 7.0、50 mmol/L磷酸盐缓冲液(缓冲溶液B)平衡好的Phenyl Sepharose 6 Fast Flow疏水层析柱(1.0 cm×20 cm),继续用含1.0 mol/L硫酸铵缓冲溶液B洗柱至蛋白基线走平,然后改用含1.0~0 mol/L硫酸铵的缓冲溶液B逆梯度洗脱。检测获得的活性组分超滤浓缩后,上样于缓冲溶液A平衡的Sephadex G-75(1.6 cm×90 cm)分子筛凝胶柱并洗脱,控制流速为0.5 mL/min。洗脱液经紫外检测并分部收集(3 mL/管),分别测定各收集管的酶活力,将有活性的部分合并,用于检测酶纯度及用于酶学性质的研究。
1.3.3 酶活力检测
参照文献[21]的方法并加以改进。以50 mmol/L、pH 6.0的磷酸缓冲溶液配制邻联茴香胺、葡萄糖及过氧化物酶溶液。向离心管中分别加入适当稀释酶液100 μL、2.4 mL 0.21 mmol/L邻联茴香胺溶液、0.5 mL 10%葡萄糖溶液、100 μL 100 U/mL的过氧化物酶溶液,在60 ℃条件下,准确反应5 min,再置于沸水浴中快速灭活4 min,冷却至室温,在520 nm波长处测定其吸光度;用预先灭活的酶液作空白对照,其他处理条件相同。酶活力单位(U)定义为:每分钟催化葡萄糖氧化产生1 μmoL H2O2所需的酶量为1 个活力单位。
1.3.4 蛋白含量测定
蛋白含量测定采用Lowry法[22],以牛血清白蛋白制作标准曲线对蛋白进行定量。
1.3.5 表观分子质量测定
按Laemmli等[23]的方法,分离胶10%,浓缩胶5%。将样品及标准蛋白(兔磷酸化酶B(97 400 Da)、牛血清白蛋白(66 200 Da)、兔肌动蛋白(43 000 Da)、牛碳酸酐酶(31 000 Da)、胰蛋白酶抑制剂(20 100 Da)、鸡蛋清溶菌酶(14 400 Da))进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),然后以相对迁移率对分子质量作图,从图中求出该蛋白酶的分子质量。
1.3.6 酶学性质分析
1.3.6.1 最适反应温度及热稳定性
酶最适作用温度测定:在20~70 ℃按照标准方法测定酶活力,以酶活力最高者为100%。
酶的热稳定性测定:将酶液在20~70 ℃分别保温2 h,迅速冷却至室温,测残余酶相对活力,以未经过热保温的酶液作为空白对照(100%)。
1.3.6.2 酶的最适反应pH值及pH值稳定性
酶最适作用pH值测定:将酶液分别在pH 3.0~10.0的缓冲液体系中,在60 ℃测定酶活力,以酶活力最高者为100%。
酶pH值稳定性测定:酶液在pH 3.0~10.0的缓冲液中,4 ℃存放48 h,测残余酶活力,以测得的最高酶活力为100%。所用缓冲液为:pH 3.0~6.0磷酸氢二钠-柠檬酸缓冲液,pH 6.0~7.5的磷酸氢二钠-磷酸二氢钠缓冲液,pH 8.0~8.5的Tris-HCl缓冲液,pH 9.0~10.5的甘氨酸-氢氧化钠缓冲液。
1.3.6.3 金属离子及抑制剂对酶活力的影响
取适当酶液,向其中分别加入金属盐和抑制剂溶液,金属离子终浓度为5 mmol/L,十二烷基硫酸钠(sodium dodecyl sulfate,SDS)和十六烷基三甲基溴化铵(cetyltriethylammnonium bromide,CTAB)为0.1 g/100 mL,Tween-80和Trition X-100为1%,乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA) 5 mmol/L,苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)4 mmol/L。25 ℃保温1 h后,测定残余酶活力。以上均以不加任何试剂的酶液作为空白对照(100%)。
1.3.7 酶的动力学分析
分别用浓度为10~80 mmol/L的葡萄糖为底物,在50 mmol/L、pH 6.0的Na2HPO4-柠檬酸缓冲体系中,60 ℃条件下与TvGOD反应,测定酶活力,计算相应的反应速度,利用米氏方程双倒数法求得Michaelis-Menten常数Km值及Vmax。
1.4 数据统计与分析
实验设3 次重复,结果以 ±s表示,数据采用SPSS 20.0软件进行统计分析,应用Microsoft Excel软件绘制曲线图。
2 结果与分析
2.1 TvGOD的分离纯化
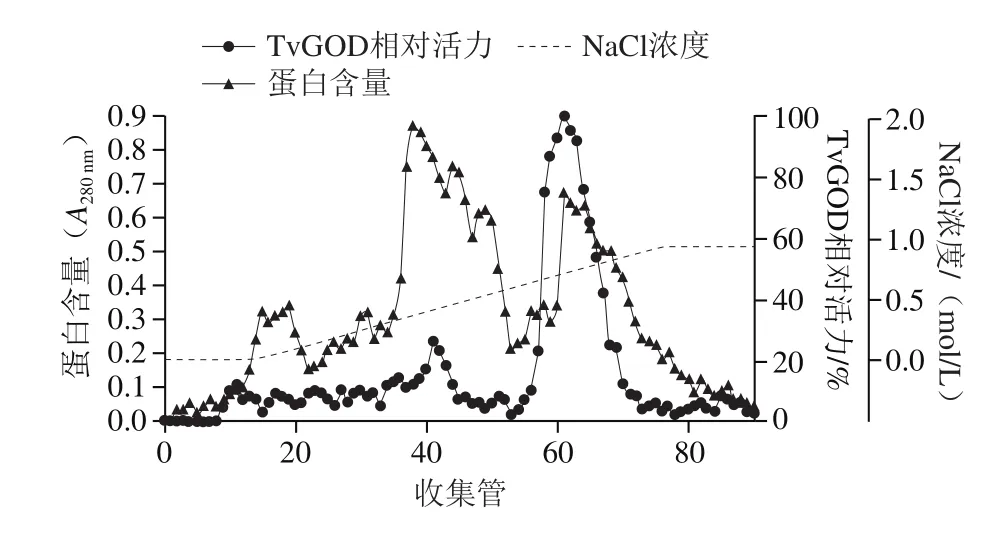
图1 DEAE-Sepharose离子交换层析Fig. 1 Elution profile of TvGOD by DEAE-Sepharose ion-exchange column chromatography
脱盐后的粗酶液上样DEAE-Sepharose Fast Flow阴离子交换层析柱,洗脱后得到多个洗脱峰,洗脱曲线如图1所示。不含酶活力的大量杂蛋白峰在低中浓度NaCl条件下先被洗脱下来,而后随着NaCl浓度的提高,大量蛋白被洗脱下来,对收集管检测酶活力显示,酶活洗脱峰与第3大蛋白洗脱峰基本重合,接着在高NaCl浓度条件下杂蛋白被洗脱下来。测定结果表明,在该分离条件下,蛋白组分与杂质分子实现了较好分离,有酶活力的对应收集管合并后用于后续纯化操作。经过离子交换层析,TvGOD比活力达到134.47 U/mg,酶回收率为52.80%,纯化倍数为4.53。

图2 Phenyl Sepharose 6 Fast Flow疏水层析Fig. 2 Elution profile of TvGOD by Phenyl Sepharose 6 Fast Flow hydrophobic chromatography
收集离子交换层析活性部分上样到Phenol Sepharose 6 Fast Flow疏水层析柱上,逆硫酸铵浓度梯度洗脱得到一系列蛋白洗脱峰,如图2所示,硫酸铵浓度在0.6~0.8 mol/L范围,洗脱管峰具有TvGOD活力,其他蛋白峰检测不到活性。收集所有具有酶活力的流出液,测得比活力为232.76 U/mg,纯化倍数为7.83,回收率为33.08%。
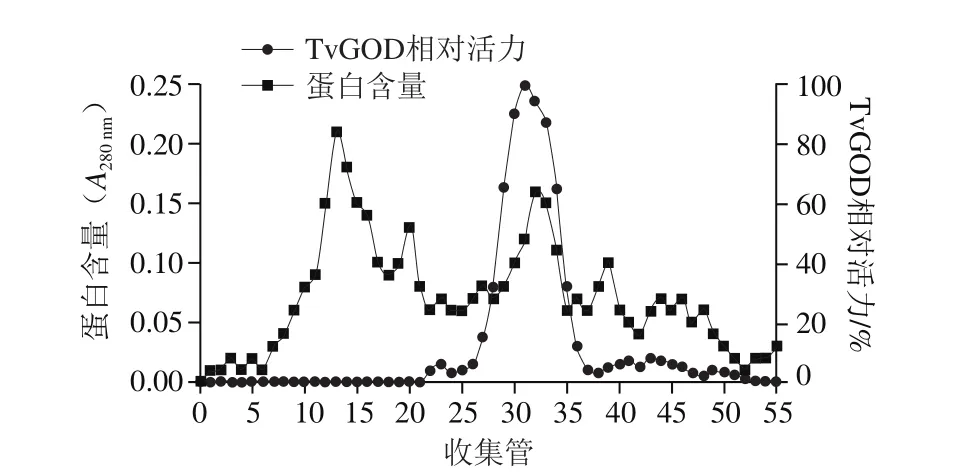
图3 Sephadex G-75分子筛凝胶过滤层析Fig. 3 Chromatography of TvGOD on Sephadex G-75
收集合并有活性的蛋白峰,进一步通过Sephadex G-75分子筛凝胶柱分离纯化。从图3可看出,样品出现5 个蛋白质峰,说明TvGOD与其他杂蛋白得到了有效分离。5 个峰中仅有位于第25~37管之间的第2峰具有酶活力。在其他峰处没有检测到酶活力,故该层析可有效除去大部分杂蛋白。活力峰峰形尖陡且较窄,说明分子筛凝胶过滤层析分离效果较好。各步纯化情况如表1所示,经此步纯化后酶比活力达426.67 U/mg,酶活力回收率为19.15%,纯化倍数为14.36。

表1 绿色木霉WX24 TvGOD的分离纯化Table 1 Purification of TvGOD from T. viride WX24
2.2 TvGOD纯度和分子质量测定
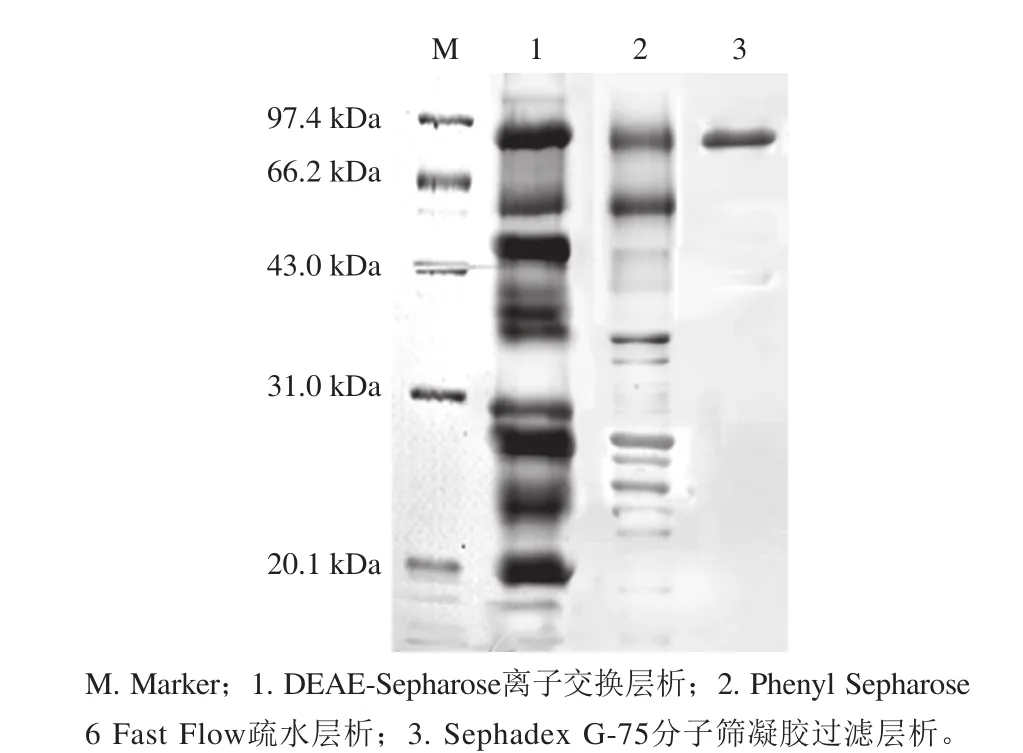
图4 TvGOD的SDS-PAGE图谱Fig. 4 SDS-PAGE profile of purified TvGOD
由图4可见,经DEAE-Sepharose Fast Flow分离后酶液中还含有大量杂蛋白;Phenyl Sepharose 6 Fast Flow疏水层析后,杂蛋白显著降低,但仍有多条清晰条带;而经Sephadex G-75分子筛凝胶过滤色谱柱分离后的酶液仅有1 条条带,说明采用以上分离纯化后已获得纯度较高的TvGOD。经计算其分子质量约为93 kDa。
2.3 TvGOD酶学性质分析
2.3.1 TvGOD最适作用温度及热稳定性
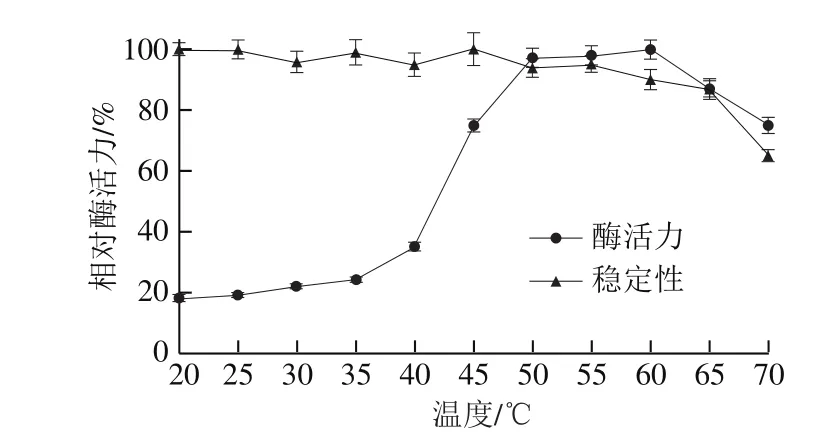
图5 TvGOD最适作用温度及热稳定性Fig. 5 Optimum reaction temperature of TvGOD
如图5所示,在20~60 ℃酶活力随温度的升高而增加,在20~40 ℃之间酶活力增加幅度较小,40 ℃时相对酶活力约为30%;在40~50 ℃酶活力随温度升高急速增加,50~60 ℃酶活力随温度升高活力增加速度变缓,当温度达到60 ℃时,酶活力达到最高;随后酶活力逐渐降低,但当温度达到70 ℃时酶活力还能达到75%,说明该酶最适反应温度为60 ℃,可以看出该酶嗜高温,在实际生产中有较好的应用前景。
由图5热稳定性曲线看出,在所检测温度下,酶活力非常稳定。当TvGOD在20~60 ℃时残余酶活力都能保持90%以上,当温度高于60 ℃时酶活力随温度的升高稳定性下降比较明显,但在70 ℃时保温2 h残余酶活力扔有65%。可以看出该TvGOD对于温度耐受性较好,使用范围较广,在工厂使用中无需冷冻保藏。
2.3.2 pH值对酶活力和酶稳定性的影响
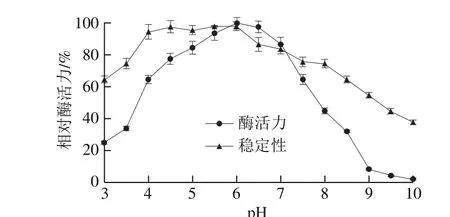
图6 pH值对TvGOD活性及稳定性的影响Fig. 6 Effect of temperature on the stability of TvGOD
如图6所示,pH 3.0~6.0范围内酶活力随pH值升高而增加,当pH值超过6.0时,酶活力急速下降,故酶最适作用pH 6.0。pH 3.0~4.0酶活力增加较为显著;当pH值超过4.0时酶活力增加幅度减缓。pH 5.0时相对酶活力为85%,pH 7.0时相对酶活力为87%,但当pH 10.0时,酶活力几乎测不到,故TvGOD适合弱酸性条件下使用。从图6的pH值稳定性曲线看出,在pH 4.0~7.0之间,TvGOD非常稳定,酶活力保持在85%以上。特别是在pH 4.5~6.0之间,48 h内酶活力保持90%以上。由此表明,TvGOD在在弱酸性条件下较为稳定,这同酶的活性条件相一致。
2.3.3 金属离子及抑制剂对TvGOD活力的影响

表2 金属离子及抑制剂对TvGOD活性的影响Table 2 Effect of various metal ions and inhibitors on TvGOD activity
如表2所示,在5 mmol/L离子浓度下,Mg2+和Ca2+对酶均有激活作用,其中Mg2+激活作用更为显著,相对酶活力达到138%,Ca2+的相对酶活力达到112%;Na+和K+对酶活力几乎没有影响,但Mn2+、Fe2+、Cu2+和Zn2+对酶活力有轻微的抑制作用,而Hg2+和Pb2+几乎能够完全抑制酶活力;表面活性剂SDS、CTAB、Tween-80、Trition X-100对酶活力有轻微抑制作用;金属螯合剂EDTA对酶的抑制作用较弱;PSFM对酶活力抑制作用非常强烈,酶活力仅有10.2%。
2.3.4 TvGOD动力学分析
利用不同浓度葡萄糖(10~80 mmol/L)作为底物,测定TvGOD的反应初速率。按照米氏方程,采用Lineweaver-Burk双倒数作图,结果如图7所示,求得TvGOD的表观米氏常数Km为11.62 mmol/L,最大反应速率Vmax为8.244 mmol/(L·min)。
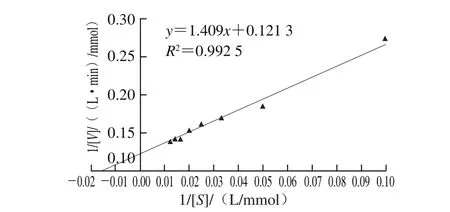
图7 酶催化不同浓度的葡萄糖Lineweaver-Burk曲线Fig. 7 Lineweaver-Burk plot of TvGOD activity at different glucose concentrations
3 讨 论
目前,我国在微生物GOD的应用还处于刚起步阶段,由于高纯度GOD的提取工艺复杂、生产成本高,国内市场依赖大量高价进口GOD产品,限制了微生物GOD的广泛应用。层析技术在生物酶制剂的分离纯化中具有重要意义,与其他分离技术相比,其分离效率高、适用范围广、过程易于放大和易于自动化等特点。但迄今为止,层析技术应用于微生物GOD纯化的报道及产品甚少,主要原因是发酵液成分复杂、野生型微生物的GOD产量低等。本研究从绿色木霉WX24菌株发酵液中,利用硫酸铵分级盐析及离子交换层析、疏水层析以及分子筛凝胶过滤层析技术,分离纯化到了电泳纯的TvGOD,比活力达到426.67 U/mg,纯化倍数14.36,回收率19.15%。郝杰清等[24]从重组毕赤酵母发酵液中一步Q-Sepharose Fast Flow层析,实现了纯化酶比活力73.17 U/mg,纯化倍数为1.35。Simpson等[13]建立的青霉属菌株CBS 120262(Penicillium sp. CBS 120262)GOD纯化方法,采用两步柱层析、两步沉淀、两步超滤,比活力达到312.0 U/mg,产率14.1%。与报道相比,本研究所应用的纯化方法所得酶的比活力和纯化倍数均较高,主要源于采用了3 种柱层析方法,而报道的大多采用两种层析技术,本研究增加了疏水层析,更为有效地去除了杂蛋白、色素等杂质,而对酶的回收率影响不大。在传感器领域,GOD的纯度、特异性以及苛刻环境的耐受性对传感器的灵敏度、专一性及使用寿命具有重要影响。本研究纯化的方法,在酶的纯度和酶比活力方面具有较大优势,所纯化酶制剂适用于对酶纯度较高的研究中。但因纯化环节多,酶的回收率偏低。因此,从成本和纯化的规模考虑,本纯化的方法可以借鉴,并需要进一步深入研究。
目前有关GOD的报道主要源于曲霉属[25-26]和青霉属[8,13,27]以及基因重组表达的毕赤酵母[28],又以黑曲霉来源的为主,而本研究所用菌株绿色木霉因其安全性好、生长速度快、对培养基及培养条件要求低等优点,常用于发酵制备各种酶,是发酵工业生产的常用菌株。TvGOD生产还鲜见报道,这对于开发新特性的GOD、增加资源多样性具有积极意义。
来源于不同细菌或真菌的GOD,酶的理化性质都差异很大,包括分子质量、等电点、最适水解反应条件等[29]。而且大多数不同来源的GOD活力低,适用范围比较单一,或酸性,或碱性,且不耐高温,这导致GOD在工业上的应用受到了极大的限制。本研究的TvGOD酶学性质表明,酶最适温度为60 ℃,在50~60 ℃之间,酶活力保持在90%以上。Simpson等[13]报道的Penicillium sp. GOD最适温度25~30 ℃,Courjean等[30]从P. amagasakiense克隆的基因重组表达GOD最适温度50 ℃,石淑钰等[15]报道了1 株海洋细菌假单胞杆菌(P. migulae),所产GOD最适温度20 ℃,与报道相比,本研究的TvGOD更适合于高温环境下使用。就热稳定性来看,本研究的TvGOD在60 ℃以下保温2 h,残余酶活力均在90%以上,65 ℃保温2 h后相对酶活力为87%。石淑钰等[15]报道的GOD超过40 ℃保存时,酶活力迅速降低;苏茉等[14]报道的黑曲霉GOD在30~40 ℃范围内稳定性较好。通过以上比较发现,TvGOD高温耐受性非常好,这可能因为酶蛋白分子结构中存在二硫键等促进稳定蛋白结构的因素存在,本课题组将进一步克隆GOD基因,研究基因的结构特点,从分子角度分析耐热性的原因。具有耐高温优良特性的酶,适用于高温环境工艺中,比如饲料高温造粒、食品巴士杀菌、传感器高温环境下检测等。
酶学性质研究显示TvGOD在pH 5.0~7.0都可以保持80%以上活力,并且该酶在pH 5~10之间保持85%以上酶活力,酶的最适作用pH 6.0,这与郝杰清[24]以及Crognale[4]等报道的重组毕赤酵母GOD相同。而有报道来源于灰葡萄孢菌(Botrytis cinerea)GOD最佳作用pH 7.5[31],假单胞杆菌(P. migulae)GOD最适pH 7.0[15],黑曲霉(Aspergillius niger)H1-9b GOD最佳pH 5.7[14]。从稳定性来看,GOD在弱酸性条件下保持了高稳定性。综上,TvGOD适合酸性环境下使用,可用作饲料添加剂,在畜禽胃的酸性环境中,酶依然具有高的催化活性。金属离子Mg2+和Ca2+对酶有强烈的激活作用,特别是Ca2+的激活作用更为显著,这种激活特性在目前报道的GOD还鲜见。表面活性剂SDS、CTAB、Tween-80、Trition X-100对酶的抑制作用非常有限,说明酶对表面活性剂的耐受性较好。这种苛刻环境的耐受性与酶的高温耐受性相一致,进一步说明TvGOD分子结构中存在稳定分子结构的因素。
不同来源的GOD之间Km值差异性较大。对比报道的GOD,本研究所分离得到的TvGOD的Km值处于已报道文献中相对较低的范围,说明其对底物葡萄糖具有相对较好的亲合力,因此具有潜在的应用研究价值,值得进一步深入研究。
4 结 论
本研究建立了TvGOD分离纯化方法,并得到电泳纯的TvGOD,对照已有报道的GOD纯化,本研究酶的比活力、回收率以及纯化倍数较高,酶分子质量与报道的大部分相比偏小。进一步酶学性质研究表明该酶在高温下活性较高,60 ℃达到最高,在65 ℃以下酶比较稳定。酶在弱酸性条件下催化活性及稳定性高,表明该酶更适合酸性环境下使用。金属离子与抑制剂实验显示常规金属离子对酶没有明显抑制作用,而Mg2+和Ca2+有显著的激活作用,表面活性剂对酶活力没有强烈抑制作用。酶的催化动力学研究表明,酶Km值低于大部分目前文献报道的水平,说明酶对底物葡萄糖亲和力高,特异性强。GOD在传感器领域有重要应用,而传感器的使用环境复杂,很多是非常苛刻的催化条件,本研究纯化得到的TvGOD在温度、pH值、常规金属离子以及表面活性剂等方面表现出突出的耐受优势,因此TvGOD在传感器领域以及食品、饲料等行业具有潜在的应用价值。此外,为了使该酶进一步实现商业化生产,本研究团队将测定酶的N-端序列或内肽序列,从而反推出TvGOD的部分DNA基因序列,进而通过基因步移或Race技术克隆出完整的GOD基因,最后开展构建基因工程菌等后续研究,最终实现规模化生产。

