双重血浆置换治疗伴血栓性微血管病狼疮性肾炎的临床疗效
章海涛 谌达程 周敏林 代 敏 王晶晶 胡伟新 刘志红
狼疮性肾炎(LN)是临床上最常见的自身免疫性疾病,在我国肾活检患者中占继发性肾小球肾炎的32.9%[1],除了累及肾小球外,LN还累及肾小管间质和血管。27.7%到半数的弥漫增殖性LN患者合并血管病变[2-3]。其中血栓性微血管病(TMA)的发生率各国报道不一,在 8.1%~25.4%之间[4-9],这些患者临床症状表现重,病变进展迅速,肾脏预后差[8-10]。随着对LN的认识,越来越多的学者意识到血管病变的重要性[6-7],尽管采取积极的免疫抑制治疗,仍有部分患者快速进展为终末期肾病(ESRD),临床上属于难治性LN,目前尚无针对这类患者的有效治疗措施。血浆置换(PE)能在短期内快速清除自身抗体、细胞因子及可能的有害致病因素,用于常规治疗无效的重症系统性红斑狼疮(SLE)或者伴中枢神经系统损害、抗磷脂综合征等合并症的患者,直到免疫抑制剂发挥效应[11-14]。但是PE对合并TMA的LN患者治疗效果报道也不一致[8-9,13]。由于血浆短缺,我们采用双重滤过血浆置换(DFPP)治疗重症LN患者,取得显著疗效,并观察到DFPP治疗可以提高伴TMA的LN患者2年的肾脏存活率[15-16]。因此,本文通过回顾性研究,观察伴TMA的LN患者临床特征及DFPP联合免疫抑制剂治疗的临床疗效。
对象和方法
病例选择 2009年7月~2018年1月在国家肾脏疾病临床医学研究中心住院接受DFPP治疗的伴TMA的LN患者,SLE诊断符合美国风湿病协会1997的修订标准,SLE疾病活动指数(SLE-DAI)>10分,所有患者均行肾活检。除外存在凝血功能异常、出血倾向及活动性出血、或者合并感染、生命体征不稳定等,不宜接受DFPP治疗者。
肾组织病理 所有患者均在B超引导下行经皮肾穿刺活检术,肾组织进行常规光镜、免疫荧光和电镜检查。病理分型参照2003年国际肾脏病学会和肾脏病理学会(ISN/RPS)分型标准,采用半定量方法进行活动性指数(AI)及慢性化指数(CI)评分。TMA病变活动期表现为肾间质小动脉内皮细胞肿胀、剥脱,内膜黏液样水肿,或腔内纤维素血栓和(或)变形红细胞、管壁纤维素样坏死,可伴肾小球内皮细胞肿胀、内皮下疏松或袢内微血栓形成;慢性期表现为小动脉黏液样内膜增厚、“洋葱皮”样改变和内膜纤维性增生[3-4,6]。
DFPP治疗方法 采用血浆分离器EC50W为一级滤器,EC20W为二级滤器(Asahi Kasei Kuraray Medical CO,Ltd,日本),低分子肝素联合枸橼酸抗凝,要求活化凝血时间延长1倍以上。体外循环下,全血流经一级滤器(速度120~150 ml/min),滤出的血浆进入二级滤器(速度30~40 ml/min)再次滤过,滤出血浆回输至体内。被截留的血浆成分滞留在二级滤器中再循环(流量60 ml/min)。每次处理血浆量为1.5~2倍血浆容量,每次治疗后补充20~30g白蛋白及新鲜冰冻血浆200~400 ml,每周 2~3 次[17]。
免疫抑制剂治疗 DFPP治疗同时给予甲泼尼龙静脉治疗(0.5 g/d×3~6d),后续口服泼尼松(起始剂量为0.6~0.8 mg/kg·d),4周后逐渐减量至10 mg/d维持;7例接受丙种球蛋白冲击治疗;DFPP治疗2~4周后给予吗替麦考酚酯、他克莫司、多靶点疗法或间断静脉环磷酰胺冲击治疗。
临床观察指标 观察患者的临床特点、DFPP治疗前后SLE-DAI、血清肌酐(SCr)、免疫学及血管内皮指标变化,3个月时摆脱透析患者比例以及肾脏缓解、远期肾存活情况。
采集DFPP治疗前及治疗后次日血样检查。尿液检查包括沉渣红细胞计数(RBC)和尿蛋白定量,血液检查包括血生化、常规、自身抗体(间接免疫荧光法)、补体(免疫比浊法)和血管内皮指标:ELISA方法测定血管内皮细胞黏附分子1(VCAM-1)、E选择素(E-selectin)和血栓调节蛋白(TM),试剂由法国Diaclone公司生产。采用免疫磁珠法测定循环内皮细胞(CECs)(磁珠由美国Invitrogen公司生产,鼠抗人CD146单克隆抗体由法国BioCytex公司生产)。ELISA方法测定血管性血友病因子裂解酶(ADAMTS13)抗体(试剂由奥地利 Technoclone GmbH公司生产)。ADAMTS13活性测定有两种方法,2016年6月以前采用荧光共振能量转移方法检测(试剂由美国Sekisui diagnostics公司生产),2016年6月以后采用ELISA方法(试剂由Technoclone GmbH公司生产)。
疗效评估 完全缓解(CR)定义为:尿蛋白定量≤0.4 g/d,无活动性尿沉渣,白蛋白≥35 g/L,SCr正常,无肾外狼疮活动;部分缓解(PR)定义为:尿蛋白定量下降超过基线值的50%,且<3.5 g/d,白蛋白≥30 g/L,SCr正常或上升不超过基线值25%。无效(NR)指未达到CR或PR标准[18]。肾脏复发包括两种情况:(1)尿蛋白增加:CR患者尿蛋白定量≥1.0 g/d;PR患者尿蛋白定量升高≥2.0 g/d,可伴或不伴血尿增加;(2)SCr上升:基线正常者,SCr升高50%以上且超过正常范围;基线异常者,SCr上升超过基线值30%,同时血尿增多[18]。肾外复发定义为出现皮肤、血管炎、关节痛、血小板计数<5×109/L或溶血性贫血、神经系统症状、狼疮性心肌炎、狼疮性肺炎、浆膜腔炎等活动症状或者检查异常,SLE-DAI升高4分以上。这些指标在2周后必须重新评估。ESRD定义为:需要肾脏替代治疗(血液透析、腹透透析或移植),或eGFR<15 ml/(min·1.73m2) 持续>3个月,或持续SCr倍增。重度高血压定义为:收缩压≥180 mmHg和(或)舒张压≥110 mmHg,肉眼血尿定义为:尿沉渣红细胞计数≥600万/ml,多形型。
统计学方法 采用《SAS 9.3》统计软件进行数据处理,计量资料采用均数±标准差表示,治疗前后比较采用配对t检验;计数资料采用病例数和(或)百分数描述,治疗前后比较采用配对精确概率法。生存资料描述采用Kaplan-Meier法。以P<0.05为差异有统计学意义。
结 果
一般情况 共纳入30例患者,平均年龄26.4±10.8岁,男 ∶女比例为9∶21,SLE 病程 43.9±55.8月,LN病程30.3±47.9月,16例(53.3%)为初治患者,19例(63.3%)表现为急进性肾炎综合征,27例伴有溶血尿毒综合征(HUS)或血栓性血小板减少性紫癜(TTP),9例合并中枢神经系统病变,24例伴重度高血压,17例(56.7%)需要行即时透析,SLEDAI 18.2±4.8,SCr 370.4±183.0 μmol/L(表 1)。其中Ⅳ型17例,Ⅳ+Ⅴ型9例,Ⅴ+Ⅲ型1例,Ⅱ型1例,Ⅴ型 2例,平均 AI 9.3±3.0分,CI 3.3±2.5分。
DFPP治疗前后临床指标变化 DFPP治疗2.7±0.8次后(1~5次),SLE-DAI和 SCr显著下降(P<0.000 1),血清白蛋白上升(P<0.000 1),ds-DNA 显著下降(P=0.000 5)。治疗3个月,除上述指标显著变化外,尿检、补体及血常规指标也明显改善(表1)。17例需要即时透析的患者中有12例(70.6%)摆脱透析治疗。
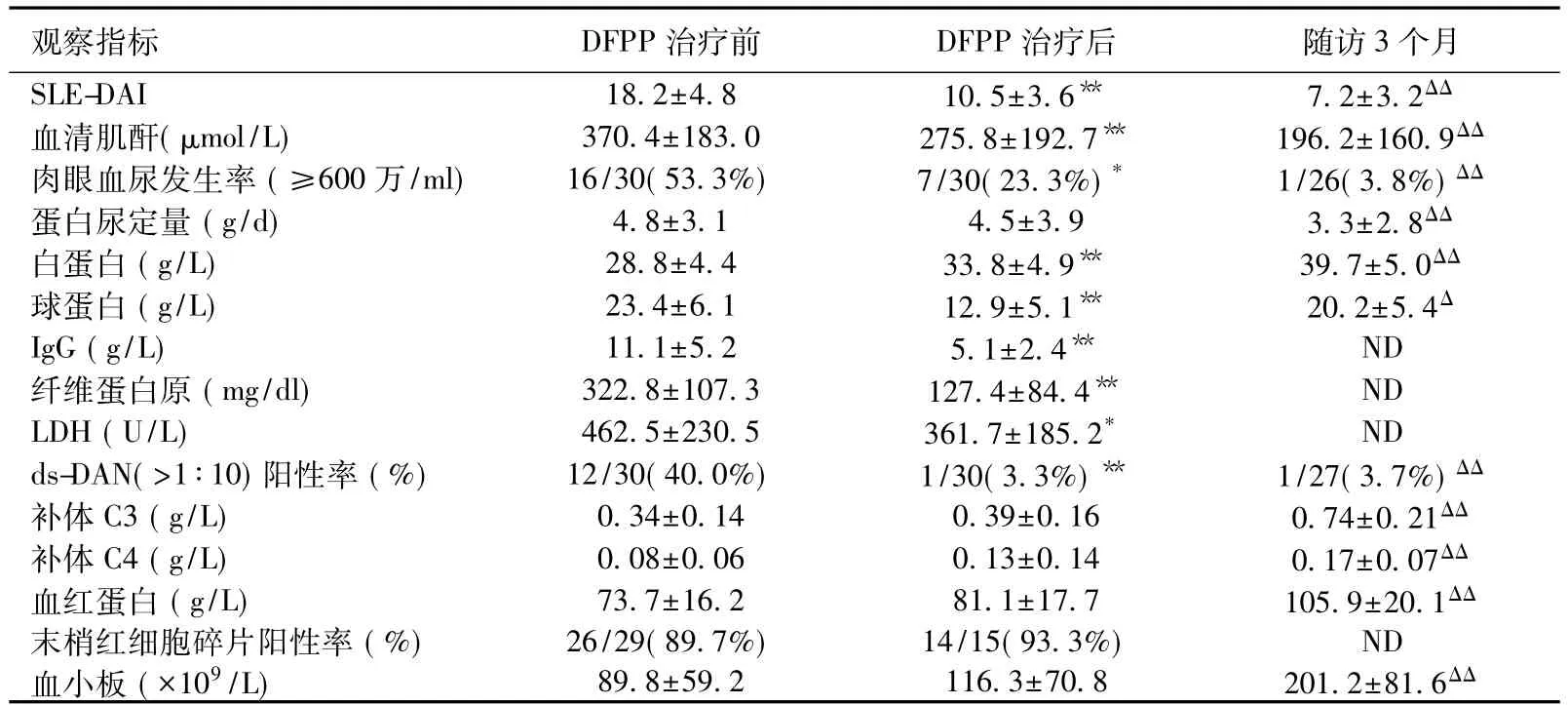
表1 DFPP治疗前后临床指标变化
DFPP对血管内皮功能指标的影响 6例ADAMTS13活性下降的患者经DFPP治疗后,5例ADAMTS13活性上升,其中 4例恢复正常;3例ADAMTS13抗体阳性的患者治疗后抗体均转阴。治疗后的血管内皮功能指标较治疗前均降低,但只有CECs和VCAM-1有统计学差异,E-selectin和TM无统计学差异(表2)。
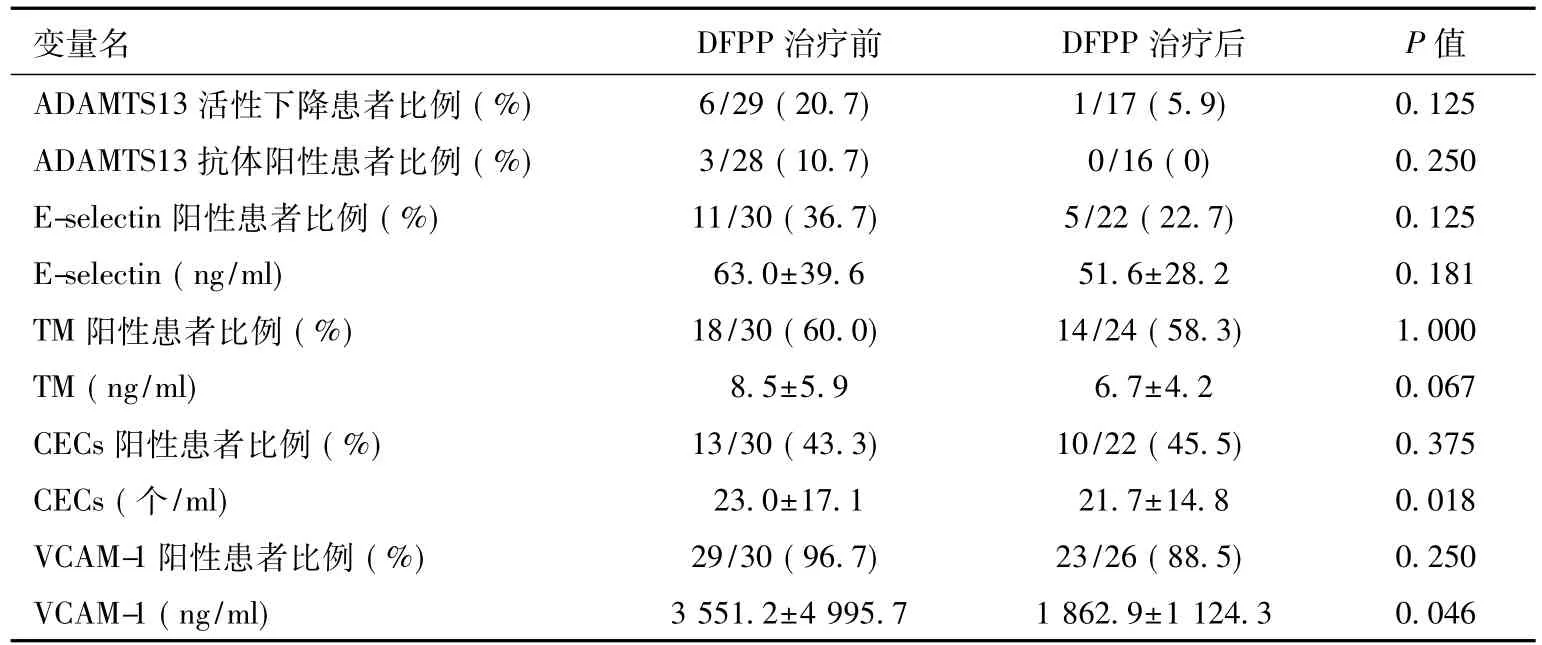
表2 DFPP治疗前后血管内皮功能指标变化
DFPP治疗的不良反应 3例患者在DFPP治疗中出现合并症,1例为一过性发热,1例为一过性低血压,1例咯血加重。经对症治疗后,症状均消失。
DFPP治疗的远期疗效 1例患者出院后即失访;3例死亡,其中2例死于肺部感染(分别发生在DFPP治疗2个月及随访3年),1例在治疗1年后死于脑膜炎、多脏器功能衰竭(图1)。
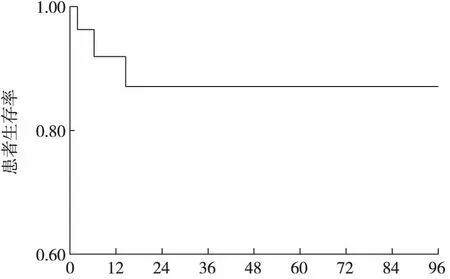
图1 30例伴血栓性微血管病狼疮性肾炎患者存活率
治疗6个月时,18例(60.0%)患者获得临床缓解,其中CR 5例,PR 13例。
随访45.9±28.2月,累积13例患者(43.3%)获得CR,首次获得CR时间为19.0±12.6月。5例患者出现狼疮复发,其中肾脏复发 4例。10例(33.3%)患者到达肾脏终点(8例接受肾脏替代治疗,2例SCr倍增)。3年、5年、8年的肾存活率分别为76.0%、66.3%和66.3%(图2)。

图2 30例伴血栓性微血管病狼疮性肾炎患者的肾脏存活率
讨 论
目前LN的治疗取得了极大进展,多项指南推荐了LN的规范治疗,有效的诱导治疗及序贯维持治疗使LN20年肾存活率高达68.3%~87.9%[19-20],但是合并 TMA 的患者肾脏预后差,进入ESRD的风险是不伴TMA患者的2.99倍[4]。这些患者通常无法遵循指南的推荐进行治疗,大多数根据临床医生的经验来选择治疗措施,文献报道PE治疗有效[21-23],但是国内因血浆短缺,无法大规模应用该疗法。
DFPP是在PE的基础上,通过第二个孔径较小的滤器,选择性地清除血浆中的大分子物质,并将滤出的白蛋白、小分子等物质重新回输患者体内,不仅有效节约了血浆用量,而且用于多种疾病的治疗[24-25]。Li等[26]报道了 12 例增殖性 LN 采用DFPP联合口服激素治疗,并与甲强龙冲击治疗后口服激素联合吗替麦考酚酯(1.5 g/d)治疗的患者进行比较,虽然两组总的 CR率没有差异,但是DFPP治疗能快速减轻浮肿、提高白蛋白水平,降低SCr,3个月的CR率也高于对照组,平均激素用量较低。我们的前期研究也发现DFPP治疗重症LN,能快速改善狼疮活动,降低 SCr,清除 ds-DNA[15]。
本文观察的30例TMA患者,多表现为急进性肾炎、半数以上需要即时肾脏替代治疗,SLE-DAI高,肾功能损害突出,重度高血压和HUS/TTP的发生率高。这些患者经过DFPP联合免疫抑制剂治疗后,短期SLE-DAI和肾功能迅速改善,肉眼血尿消失,ds-DNA抗体滴度下降,治疗3个月有70.6%患者摆脱透析。
文献报道伴TMA的LN患者仅有16%~52.8%接受 PE治疗,这些患者 CR率仅为22.2%~30%[4,8]。Li等[9]报道了 9 例接受 PE 的伴 TMA 的LN患者(1例DFPP治疗),只有3例获得CR,2例治疗失败。而本文观察的30例DFPP治疗伴TMA的LN患者,43.3%获得CR,说明DFPP联合免疫抑制剂治疗,有利于TMA患者获得CR。本文中有33.3%患者到达肾脏终点,与 Pattanashetti等[8]和Hu等[10]报道的伴TMA的LN患者30.3%和38%出现肾功能衰竭相近[8,10]。这些患者5年的肾存活率为 66.3%,高于文献报道的 22.2% ~ 46.7%[9-10]。亦有作者认为合并TMA对远期肾存活率没有显著影响[27]。
LN累及血管会导致内皮细胞损伤,导致血管内皮标志物如E-selectin、CECs、TM和VCAM-1发生变化,但是各家报道不一[28-32]。伴有血管病变的 LN患者,血清CECs、TM和VCAM-1明显高于不伴血管病变的患者,其中合并 TMA 的患者更明显[30-32]。本文观察到治疗后血管内皮指标较治疗前均降低,仅CECs和VCAM-1有统计学差异,E-selectin和TM无统计学差异,可能与样本量较小有关。赵明辉等报道活动性LN患者血清ADAMTS13活性明显低于正常人,抗 ADAMTS13抗体阳性率仅为1.8%[33],合并TTP/HUS的LN患者ADAMTS13活性更低,抗体阳性率高[34],但是也有报道伴TMA的LN患者中ADAMTS13活性下降的比例不高[4]。本文观察的患者中有20.7%存在ADAMTS13活性下降,10.7%患者存在 ADAMTS13抗体阳性。DFPP治疗后,ADAMTS13活性上升,抗体转阴。说明DFPP治疗可改善LN患者内皮功能紊乱,有利于病情恢复。
本项研究是单中心回顾性研究,样本量较小,并且未设立非DFPP治疗作为对照。因此,对于DFPP治疗伴TMA的LN患者临床疗效仍需前瞻性对照研究进一步评估。
小结:DFPP联合免疫抑制治疗伴TMA的LN患者能快速降低狼疮活动,改善血管内皮功能,临床缓解率和远期肾存活率较高。DFPP可作为伴TMA的LN患者一种有效治疗手段。

