利用CRISPR/Cas9构建稳定遗传的斑马鱼TYRO3纯合突变体
张利文 侯 庆 汪 玲 朱小东 曾彩虹 秦卫松 刘志红 陈朝红
TYRO3受体络氨酸激酶是一种单跨膜蛋白。TYRO3与其配体,生长停滞特异性基因6(GAS6)或蛋白S(PROS1)结合后,胞内结构二聚化,诱导胞内域的络氨酸激酶域磷酸化[1],从而激活下游的信号通路,介导细胞生长、存活、黏附、迁移、凋亡等生理病理过程[2-6]。TYRO3在多种组织中表达,并且在神经系统中最突出。在脑组织中,TYRO3在内皮细胞[7]、神经元[8]、少突胶质细胞[9]、海马[3]及外周神经系统施旺细胞[10]均有表达。缺氧情况下TYRO3可通过激活AKT信号通路保护鼠海马神经元减免于凋亡[3]。在造血系统中,TYRO3在树突状细胞[11]、自然杀伤细胞[12]、单核细胞和巨噬细胞[13]、血小板和巨核中[14-17]表达,可发挥调节血栓形成作用。免疫系统中,TYRO3可负性调节天然免疫细胞2型免疫反应的强度[11]。在生殖系统中,TYRO3在睾丸中的支持细胞和卵巢中的颗粒细胞中表达[18]。TYRO3也在肺,骨骼肌,肝脏,胰腺和心肌表达[19-20]。我们之前的研究发现[21],TYRO3在肾小球中特异性表达于足细胞,大量白蛋白尿的糖尿病肾病患者和局灶节段性肾小球硬化(FSGS)患者肾小球TYRO3 mRNA水平下降,肾小球中TYRO3 mRNA表达水平与糖尿病肾病患者估算的肾小球滤过率(eGFR)呈正相关,TYRO3作为足细胞保护性因子,在维持正常足细胞功能中发挥重要作用。本研究利用CRISPR/Cas9技术构建稳定遗传的斑马鱼TYRO3纯合突变体,为进一步研究其功能提供体内模型。
斑马鱼的肾单位分子组成、结构和功能与高等哺乳动物后肾高度保守[22],斑马鱼模型具有胚胎发育时间短,发育过程中胚胎透明,易于观察表型缺陷和进行基因筛选等优势,越来越多的被应用于基因功能研究。目前在斑马鱼中最常用的抑制基因表达的方法包括胚胎注射Morpholino,RNAi、ZFNs、TALENs 和 CRISPR/Cas9。CRISPR/Cas9系统效率高,脱靶率低,在斑马鱼的研究中逐渐被广泛应用。
本研究通过CRISPR/Cas9构建稳定遗传的斑马鱼TYRO3纯合突变体,并初步观察TYRO3缺失对斑马鱼肾小球的影响。
材料和方法
斑马鱼饲养和繁殖 斑马鱼饲养于28.5℃水温环境中,照明14h与黑暗10h交替。斑马鱼胚胎于28.5℃培养箱中孵化,每日更换培养液。
斑马鱼肾小球的分离 吸取5d的Tg(pod:GFP)的斑马鱼幼鱼于1.5 ml的EP管中,置于冰上麻醉沉底后用含1%北美胎牛血清的PBS清洗一遍后用2.5 ml的注射器快速抽吸三次,将含碎裂斑马鱼的液体吸取到荧光显微镜下观察,用移液器枪头将带绿色荧光的肾小球组织块吸出加到消化液中37℃消化3 min后再次于荧光显微镜下将从组织分离下来的肾小球吸出加到RNA裂解液中。Tg(pod:GFP)的斑马鱼来自周卫斌教授馈赠。
靶位点设计 在Ensemble网站找到斑马鱼tyro3蛋白编码序列,用NCBI对蛋白序列进行blast,找到蛋白的保守功能域,在蛋白保守功能域对应的基因序列第5外显子处设计基因突变位点,通过http://www.rgenome.net/网站分别对靶位点序列特征和脱靶可能性打分,选择活性较高的single-guide RNA(sgRNA)并合成gRNA序列oligo:oligo A1:5'-GGTGAAGCTGACAGTGTCTC-3'oligoB1:5'-GAGACACTGTCAGCTTCACC-3';oligoA2:5'-GTCAGCGAGCAGCACTGGAT-3'oligoB2:5'-ATCCAGTGCTGCTCGCTGAC-3'。
转录模板合成 TYRO3 gRNA oligo退火,PCR反应体系包括 1 μl 100 μm oligo A,1 μl 100 μm oligo B ,5 μl 10×annealing buffer,43 μl H2O。反应程序:95℃ 开始反应,每 30s降 1℃。取 2 μg PDR274质粒用限制性内切酶Bas1(NEB公司)线性化后,纯化(zymoclean Gel DNA Recovery kit)回收。取1 μl(5 ng/μl)线性化的 PDR274 质粒与3 μl退火后的oligo用T4连接酶(NEB公司)16℃过夜连接。转化入DH5α感受态细胞,挑单克隆,提取质粒并测序鉴定。
sgRNA和Cas9编码的mRNA体外转录TYRO3 gRNA体外转录模板是用限制性内切酶Dra I将pDR274-TYRO3 gRNA载体线性化后纯化回收作为模板,应用MaxiScript T7 Kit将1 μg模板体外转录成gRNA,纯化回收(RNA clean&concentrator TM-5)体外转录的gRNA。对于编码Cas9的mRNA体外转录,我们使用PT3TS-nCas9n质粒,XbaⅠ线性化后纯化(DNA clean&concentratorTM-5)。取 1 μg用于体外转录(mMESSAGE mMACHINE T3 kit),转录产物纯化(RNA clean&concentrator TM-25)后用Nanodrop测量纯度和浓度。
sgRNA和Cas9编码mRNA显微注射 将Cas9 mRNA(300 ng/μl)和 gRNA(10 ng/μl)共同显微注射入野生型AB斑马鱼胚胎单细胞,28.5℃培养箱饲养。通过 PCR分析基因型,逐代筛选 F0,F1和F2。
靶位点序列PCR和琼脂糖凝胶电泳 取1枚24h胚胎或者剪取部分成年斑马鱼尾加30 μL含1%蛋白酶(proteinase K)细胞裂解液(每100 ml包含:1M pH为8.0的Tris-HCl;4 ml 2 mM EDTA,200 μl Triton-100)混匀55℃ 1h,95℃ 5 min裂解基因组DNA。取1.5 μl裂解液作为PCR反应模板。PCR上下游引物分别设计在靶位点上下游100 bp左右的位置。上游引物序列:CTGGGACAATTCCACGCTAA,下游引物序列TGCTGAGTCAGAACAATGTAAGT。PCR 反应体系包括:5.7 μl ddH2O,0.3 μl primer 混合液(10 μmol/L),1 μl基因组模板和 7.5 μl 2×EasyTaq supermix。反应程序:94℃ 3min;94℃30s,54℃ 15s,72℃ 30s,共 35 个循环;72℃ 7 min。配制3%的琼脂糖凝胶电泳,取5 μl PCR产物进行电泳。
结 果
TYRO3在斑马鱼肾小球上有表达 对肾脏有荧光标记的斑马鱼Tg(pod:GFP)进行肾小球的分离,RT-PCR检测近端肾小管分子slc20a1a,远端肾小管分子trpm7以及足细胞标记分子podocin,以对分离小球进行纯度验证(图1A)。分离斑马鱼肾小球RT-PCR结果显示TYRO3在斑马鱼肾小球上有表达(图1B)。
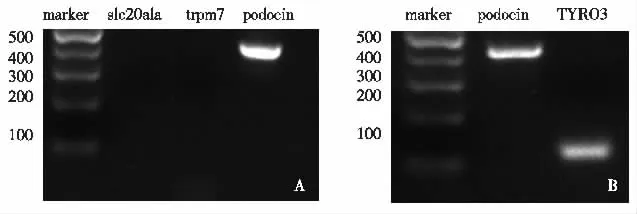
图1 分离斑马鱼肾小球,RT-PCR检测肾小球TYRO3表达
通过CRISPR/Cas9系统突变斑马鱼TYRO3基因 根据斑马鱼TYRO3蛋白的保守功能域,在其对应的基因序列第5外显子处设计基因突变位点(图2C),并根据以下实验流程进行操作(图2A)。为确认gRNA的活性及靶位点突变类型,收集八个注射后胚胎(F0代),裂解获得基因组DNA后做PCR(图2B),双条带显示有碱基的改变,有超过八分之一的双条带,说明gRNA活性有效。将PCR产物测序,测序后峰图在target site PAM前4 bp出现套峰(图2C)。证明造成了碱基的缺失。将非3倍数碱基缺失的F0代孵育至成年。
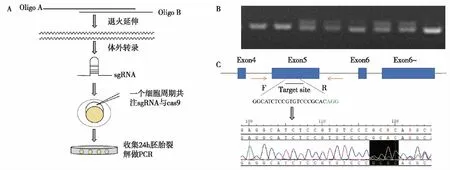
图2 CRISPR/Cas9突变斑马鱼TYRO3基因
通过CRISPR/Cas9系统得到稳定遗传的TYRO3基因突变的斑马鱼品系 为验证这种碱基突变是可遗传的,将同一批注射了sgRNA的斑马鱼胚胎恒温28.5℃培养约3个月至性成熟后,分别从中取与野生型AB斑马鱼雌雄交配,收集每对斑马鱼产生的胚胎F1,恒温培养至24h,每对随机取8只胚胎做PCR,选取其中双条带的PCR产物分别做测序,检测胚胎突变稳定性。产卵的17对鱼中有12对胚胎出现了双条带,并且双条带比率大于1/8,最终测序证实得到有两种不同的非3倍数的碱基突变(图3A、B)。将同一批的其余胚胎恒温培养至性成熟,从同一种突变类型斑马鱼中分别取雌雄进行交配,得到包含有野生型、杂合型、纯合型斑马鱼胚胎。上述胚胎培养至成年后分别剪每只斑马鱼尾鳍做PCR,选取其中单条带测序,鉴定每条成鱼基因型。一号突变型有43只斑马鱼进行了剪尾、PCR及测序,其有2条突变纯合体,28条杂合体以及13条野生型。而二号突变型有103只斑马鱼进行了剪尾、PCR及测序,其有5条突变纯合体,63条杂合体以及35条野生型。纯合子基因型测序结果及峰图(图3B),显示碱基缺失均出现在同一位置,峰图整齐,没有出现杂峰,表明等位基因突变类型一致,即得到稳定遗传的TYRO3基因突变的纯合斑马鱼品系。

图3 通过PCR和测序鉴定基因型,筛选获得TYRO3基因突变斑马鱼
TYRO3突变对斑马鱼的影响 为了研究TYRO3缺失对斑马鱼的影响,我们让同一纯合突变的雌雄鱼交配,得到完全纯合的TYRO3基因突变斑马鱼。结果显示胚胎发育至3d时大约有30%的斑马鱼出现心包、卵黄囊及眼周的水肿,与野生型斑马鱼相比,TYRO3基因突变斑马鱼身体短小,身体稍微弯曲,其余部分胚胎表型相对正常。出现水肿表型斑马鱼从第三天就开始陆续出现死亡,至第五天已经全部死亡,只剩余表型相对正常斑马鱼存活。我们随机挑选几条存活下来5d的子代胚胎送至电镜检查,结果显示,TYRO3突变斑马鱼均出现了明显的足突融合。
讨 论
CRISPR/Cas9诱导基因组DNA双链断裂,通过末端非同源修复机制对断裂的双链DNA进行修复,从而引起碱基的缺失或者插入,并在基因编码区内产生移码效应,导致蛋白质翻译提前终止。本实验通过CRISPR/Cas9系统得到稳定遗传的TYRO3基因突变的斑马鱼品系,考虑gRNA的脱靶,我们刚开始设计了两条gRNA,而其中一条在注射24h,取胚胎做PCR进行活性验证时发现,并未造成有效的碱基缺失,另一个gRNA 8个PCR中有4个出现双条带。测序结果显示,其中有3个在紧靠PAM前4个碱基发生了缺失,另一个在PAM往前3个碱基处发生了6个碱基的缺失,F0代突变效率可达50%。通过F0代与野生型斑马鱼交配得到杂合突变体F1以及同一碱基缺失F1之间交配得到子代的测序证明,这种由gRNA造成的碱基缺失可稳定的遗传。但是值得注意的是,在对F1子代成年斑马鱼剪尾进行突变体筛选时,根据孟德尔遗传定律,纯合子突变数量应维持在25%,而本研究获得的2个纯合子都只占5%左右,严重低于遗传定律,但杂合子与野生型之间的比例(2∶1)却基本符合,提示TYRO3基因基因突变纯合子有一大部分在生长过程中死亡。与之一致的是,TYRO3纯合突变体之间的子代斑马鱼在3d时出现了明显的身体水肿以及死亡,即使存活下来的斑马鱼也出现了明显的足突融合,提示TYRO3缺失造成了斑马鱼足细胞损伤。

图4 TYRO3突变对斑马鱼的影响
既往研究提示,TYRO3在肾脏的生理病理过程中可能发挥重要作用。Zhong等[23]发现TYRO3介导了PROS1抑制足细胞炎症反应,发挥足细胞保护作用。PROS1通过激活TYRO3负性调节免疫和炎症反应,减轻细胞损伤[24-26]。而敲低 TYRO3 显著降低了 PROS1的抗炎效应,提示 TYRO3在介导PROS1抑制足细胞炎症中发挥重要作用。近期研究发现,大量白蛋白尿的糖尿病肾病患者循环和尿液中可溶性TYRO3升高,高糖抑制体外培养肾小管上皮细胞TYRO3 mRNA表达[27]。但上述研究未探索TYRO3在肾脏的功能。目前关于TYRO3在肾脏方面的研究几乎没有。本研究成功运用CRISPR/Cas9系统构建稳定遗传的TYRO3基因突变的斑马鱼品系,为进一步研究TYRO3基因功能提供了体内模型。值得注意的是,纯合的TYRO3基因突变斑马鱼胚胎期只有30%出现明显的肾脏损伤表型,虽然表型相对正常的斑马鱼电镜下也出现了明显的足突融合。这种表型严重程度的差异,是否是因为受同一家族另外成员或其他基因的影响而不同?据报道TYRO3和AXL可能会异二聚化后相互交叉磷酸化[28],TYRO3磷酸化程度受AXL磷酸化水平影响,因此TYRO3在肾脏的功能其机制还有待进一步研究。

