内镜治疗胃间质瘤的疗效评价及其预后影响因素分析
陈 龙 李世清 袁溢苒 童明霞 杜宗汉 周晓晴
作为临床上胃肠道间叶组织常见肿瘤之一,胃肠间质瘤(gastrointestinal stromal tumor,GIST)发病率约为胃肠道肿瘤0.2%左右,其病灶可位于胃肠道任何部位,而在GIST中,尤以胃间质瘤(gastrointestinal tumor,GST)较为常见,约为GIST发病人数60%左右[1]。研究结果表明,GST病灶部位依次以胃底、胃体、胃窦为主。临床上早期胃间质瘤无明显症状,多表现为胃肠道出血、纳差以及上腹部隐痛不适等[2]。由于该疾病恶变率高达2.1%,因此早期诊断与治疗对于患者生命质量的提高具有重要临床意义。目前针对该疾病的诊断方式多以胃镜,超声内镜检查为主。由于该疾病已完全耐受传统放疗、化疗等治疗手段,而针对GST的治疗多以手术切除为主[3]。一方面由于开腹手术对患者机体创伤较大,术后并发症多且恢复较为缓慢,同时也由于内镜技术发展与体积较小GST检出率的提高,越来越多胃间质瘤使用内镜下切除方式进行治疗。该治疗方式不仅手术创伤小,且治疗安全,并发症发生率低[4]。因此,内镜治疗GST已被越来越多的患者接受。为了探讨内镜治疗胃间质瘤的疗效及其患者预后影响因素,本文回顾性分析我院收治的60例胃间质瘤患者临床病例资料,其研究结果如下。
1 资料与方法
1.1 资料
以我院2017年1月至2018年1月期间收治的60例胃间质瘤患者作为研究对象,患者纳入标准[5]:①所有患者均经过胃镜病理检查诊断确认;②术前给予患者行超声胃镜检查,均可见完整肿瘤包膜;③术前给予患者行腹部CT检查,未见淋巴结转移或远处转移;患者排除标准[6]:①患者存在远处转移和(或)淋巴结转移;②术前接受过放疗或化疗患者;③同时伴有其他恶性肿瘤患者。回顾性分析其临床病例资料,将其分为观察组(n=30)与对照组(n=30),在观察组中,观察组男性患者16例,女性14例。该组患者年龄平均值为(60.35±7.43)岁,平均患病时间(12.32±4.12)个月。肿瘤直径平均值为(6.44±1.32)cm。按照肿瘤在胃体发生部位进行分类,胃底17例、胃体11例、胃窦2例。在对照组中,观察组男性患者18例,女性12例。该组患者年龄平均值为(60.43±7.23)岁,平均患病时间(12.12±4.54)月。肿瘤直径平均值为(6.54±1.31)cm。按照肿瘤在胃体发生部位进行分类,胃底13例、胃体11例、胃窦6例。两组患者于上述基本资料间无统计学差异(P>0.05),具有可比性。
1.2 方法
1.2.1 治疗方法 观察组患者接受内镜下治疗,即:患者保持左侧卧位姿势,然后给予其气管插管,并行全麻处理。待行常规胃镜检查确认肿瘤具体部位后,使用Dual刀环绕肿瘤外缘一周作标记。然后将亚甲蓝+肾上腺素+生理盐水注射入肿物表面黏膜,进行粘膜下液体垫的建立。进一步使用Dual刀将肿瘤病灶处黏膜切开,使粘膜下层组织与肿瘤暴露,然后使用IT刀及VS刀剥离肿瘤边缘处黏膜下组织。若肿瘤病灶深达肌层,或病灶与浆膜层连接紧密,则切除胃壁全层,使胃壁全层缺损。需要注意的是,在切除胃壁全层过程中,可使用牙线或圈套器牵拉肿瘤表面附着粘膜组织,以防其掉入腹腔。对于创面可见出血点或小血管,可使用金属钛夹或止血钳电凝止血。而对于面积较小的胃壁肌层穿孔或其缺损部位,可使用金属钛夹将创面夹闭,若缺损部位超过金属夹,则可使用尼龙圈联合金属夹作“荷包”缝合处理。完全切除肿物后将其取出,最后观察是否存在残留肿瘤组织、瘤体包膜是否完整。术后将切除肿瘤组织送病理进行检查,获取肿瘤直径、核分裂数、危险度分级等。
对照组患者接受腹腔镜进行治疗,即:患者保持仰卧位姿势,然后给予其气管插管,并行全麻处理。然后行常规消毒铺巾,建立气腹使用五孔法或四孔法。手术过程中,将患者气腹压力维持在12.15 mmHg。若不明确患者病变部位,则可于手术过程中注射亚甲蓝注射,并行胃镜检查以确定病灶部位。然后根据肿瘤病灶具体部位,选择施行腹腔镜近端胃部分切除术或腹腔镜胃楔形切除术或腹腔镜远端胃部分切除术,最后进行消化道重建。术中行常规冰冻切片,并送病理进行检查,获取肿瘤直径、核分裂数、危险度分级等。
严密观察术后两组患者生命体征情况,且一般在术后1~2天可行流质饮食,若无不适则可逐渐过渡到正常饮食。
1.2.2 疗效观察指标及其评价标准 ①围手术期指标:手术时间、手术首次排便时间、术后进食时间、术后住院时间;②术后不良反应发生情况:肺炎、急性弥漫性腹膜炎及术后穿孔、复发等。
1.3 统计学处理
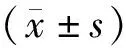
2 结果
2.1 两组患者围手术期指标的比较
相比较对照组,观察组患者手术时间、手术首次排便时间、术后进食时间、术后住院时间等围手术期指标均明显更短,其差异性均具有统计学意义(P<0.05)。
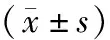
表1 两组患者围手术期指标的比较
2.2 两组患者术后不良反应发生情况的比较
治疗后6个月对所有患者进行随访,发现所有患者病灶均完整切除。但观察组患者复发、肺炎、急性弥漫性腹膜炎及术后穿孔等不良反应发生率明显低于对照组(P<0.05)。其结果详见表2。
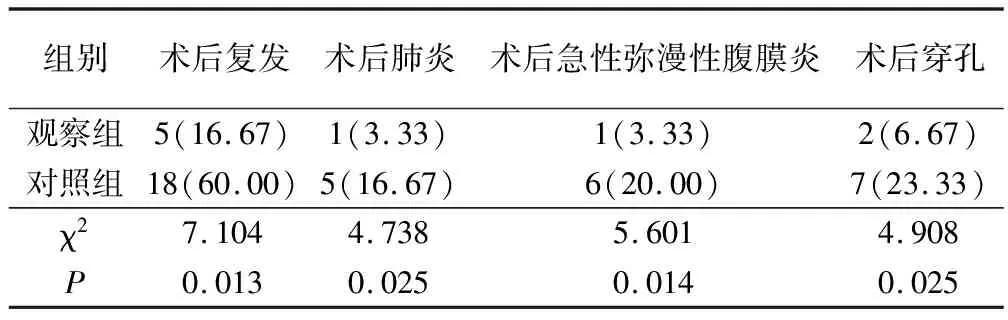
表2 两组患者不良反应发生情况的比较(例,%)
2.3 影响胃间质瘤术后复发单因素分析
根据患者术后病情是否复发,将其分为复发组(n=23)与非复发组(n=37),并对其影响因素进行单因素分析,结果表明:影响胃间质瘤复发主要因素包括肿瘤大小、核分裂数、肿瘤危险度分级、术后伊马替尼使用等。其结果详见表3。
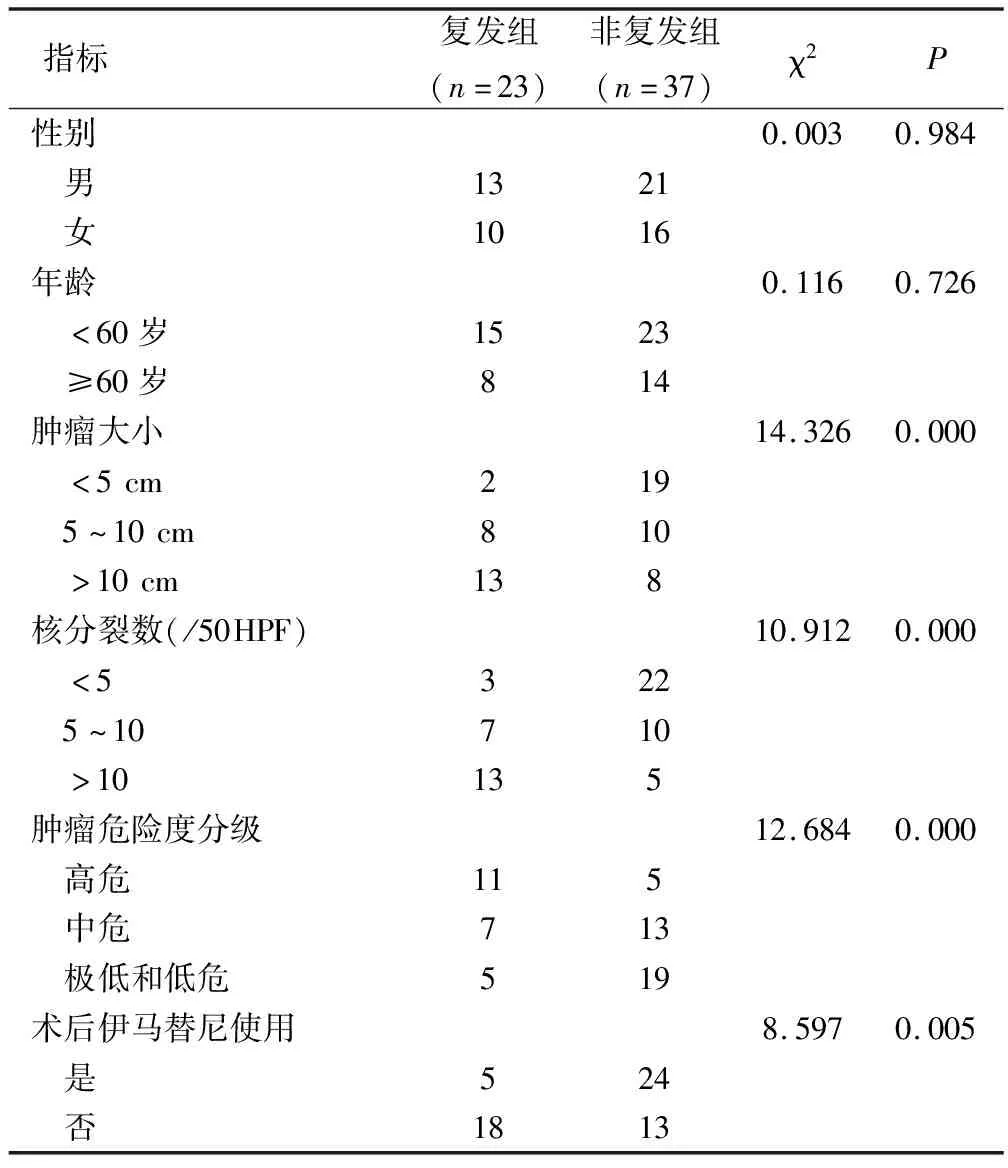
表3 影响胃间质瘤术后复发Pearson单因素分析/例
2.4 影响胃间质瘤术后复发cox回归多因素分析
首先对可能影响胃间质瘤术后复发的因素(肿瘤大小、核分裂数、肿瘤危险度分级、术后伊马替尼使用)进行赋值,然后进行cox多因素回归分析,其结果表明上述因素均为影响胃间质瘤术后复发的独立危险因素,其结果见表4。
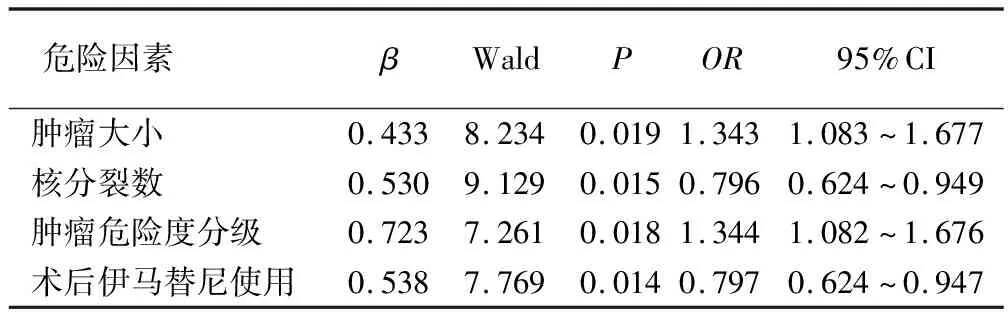
表4 胃间质瘤术后复发cox回归多因素分析
3 讨论
近些年来,随着电镜技术与免疫组学科的发展,胃肠道间质瘤的概念也逐渐在临床上得以应用。病理学研究表明,胃肠道间质瘤是1类结缔组织或间质性肿瘤,c-Kit检测呈阳性,在胃肠道各脏器中均可发生,表现为纳差、上腹部隐痛不适、胃肠道出血等常见消化道症状。显微镜下观察可见,肿瘤细胞呈上皮样或(和)梭形,且成巢或成团排列,同时具有潜在恶变性[7-8]。临床上该类疾病以40岁以上患者多见,且男性更多。胃镜下检查可见,胃腔溃疡与癃起的病灶,该疾病确诊需要借助术后病理检查与特征性免疫组化标志物检查如CD117和CD34等手段,其中尤以CD117检查阳性最为重要,已被公认为诊断胃肠道间质瘤的金标准[9]。
胃间质瘤是最常见的1种胃肠道软组织肿瘤,属于消化道固有肌层肿瘤,具有潜在侵袭性,恶性程度较高,能够严重伤害身体的器官,给人们造成很大的痛苦,甚至威胁生命,其“凶狠”程度有时更猛于一般胃癌。早期临床上通常采用外科手术切除、腹腔镜下摘除肿瘤病灶对胃间质瘤进行治疗,然而上述治疗方法不仅对机体创伤较大,同时手术并发症也较多,不利于患者病情恢复与预后。近几年来,随着医疗器械技术的不断发展,内镜在肿瘤治疗方面表现出高效、安全、微创、恢复快等诸多优势,目前该治疗方法已在临床上得到广泛应用。
为了探讨内镜治疗胃间质瘤的疗效及其患者预后影响因素,本文以我院收治的60例胃间质瘤患者作为研究对象,观察组患者接受内镜下治疗,对照组患者接受腹腔镜治疗,结果发现:观察组患者手术时间、手术首次排便时间、术后进食时间、术后住院时间等围手术期指标均明显低于对照组,且该组患者术后复发、肺炎、急性弥漫性腹膜炎及术后穿孔等不良反应发生率也明显更低。该结果也证实了内镜治疗胃间质瘤,促进患者病情恢复,治疗有效且安全。
肿瘤体积可反映肿瘤生物学行为及其预后。对于胃间质瘤而言,肿瘤越大,其恶性程度越高,则肿瘤复发与发生远处转移的几率越大[10]。本研究结果表明不同肿瘤大小与患者术后复发情况具有统计学差异,且肿瘤大小是影响胃间质瘤复发的独立危险因素。肿瘤核分裂数与癌细胞增殖活性及患者预后密切相关。核分裂数越多,则肿瘤细胞增殖活性越强,而预后越差。相比较核分裂象数≤5/50HPF肿瘤患者而言,核分裂数>10/50HPF患者生存率更低,表明核分裂象数与患者死亡风险呈正相关。本研究结果中不同核分裂数与患者术后复发情况具有统计学差异,且核分裂数是影响胃间质瘤复发的独立危险因素。
在综合考虑肿瘤大小、核分裂数、肿瘤部位、肿瘤是否破裂等因素后,NIH危险度肿瘤分级标准将肿瘤分为高危、中危、低危、极低危四类。有研究报道上述四类胃肠间质瘤患者完全手术切除肿瘤后其5年生存率分别为61.5%、93.2%、90.1%与100%,表明胃肠间质瘤危险度分级越高,则患者预后越差[11-12]。本研究结果也证实肿瘤不同危险度与患者术后复发情况具有统计学差异,且肿瘤危险度分级是影响胃间质瘤复发的独立危险因素之一。作为靶向治疗胃肠间质瘤的一线药物,伊马替尼已广泛用于临床上胃肠间质瘤的治疗(术前与术后用药、轮替与交叉用药),且具有较好的治疗效果[13]。无论胃肠间质瘤患者肿瘤是否完整切除,术后给予患者常规服用伊马替尼,每天400毫克,能有效提高患者生存率,并防止肿瘤的复发。本研究结果表明:术后是否服用伊马替尼与患者术后复发情况具有统计学差异,且该因素也是影响胃间质瘤复发的独立危险因素。
综上所述,内镜治疗胃间质瘤,能有效改善患者病情,加快患者恢复。另外,针对肿瘤大小、核分裂数、肿瘤危险度分级、术后伊马替尼等独立危险因素,应及时采取预防措施,提高患者预后。

