地西他滨联合减量化疗治疗T-ALL患儿的临床疗效及其影响因素
池新红 牛志莹 张 娜 王 丽
T细胞免疫表型急性淋巴细胞白血病(T-ALL)是比较少见的白血病,也属于一类高度异质的恶性血液系统克隆性肿瘤,具有很强的侵袭性[1-2]。T-ALL的发病机制还不明确,被认为是多种因素共同作用的结果[3]。现代研究表明,多条信号通路交互作用是肿瘤发生发展的一个重要过程,可涉及多条信号通路的调控[4-5]。目前针对T-ALL的治疗主要是应用化疗与放疗治疗,提高白血病患儿缓解率、降低病死率,但是很多患儿由于对化疗药的不耐受,导致治疗失败[6]。其他治疗方法包括小剂量阿糖胞苷、去甲基化、抗感染、血制品输注等支持治疗[7-8]。近年有研究证实地西他滨能够抑制DNA甲基化转移酶活性,对应DNA过度甲基化失活抑癌基因具有激活作用,可以加快肿瘤细胞凋亡[9]。但是临床观察发现,影响T-ALL患儿预后不良的因素较多[10],有研究称T-ALL患儿随着年龄增长治疗疗效逐渐降低,加之合并症增多、分子生物学变化比例增高、耐药性以及不良细胞遗传等原因,导致其诱导化疗完全缓解率在50%左右,2年生存率很难超过20%[11]。本文具体调查与分析了79例T-ALL患儿的临床疗效及影响疗效的因素,现总结报告如下。
1 资料与方法
1.1 一般资料
2014年7月到2018年3月选择我院诊治的79例T-ALL患儿,纳入标准:符合T-ALL的诊断标准;年龄3~12岁,具有化疗指征;医院伦理委员会批准了此次研究;患儿家长在自愿条件下签署了知情同意书。排除标准:1月内有化疗史患儿;急性全髓增殖症伴骨髓纤维化、急性早幼粒细胞白血病患儿;合并先天性心、肝、肾异常的患儿。79例中男性40例,女性39例;年龄最小3岁,最大12岁,平均年龄(6.74±2.29)岁;染色体核型:标危70例,高危9例;FLT3-突变20例,NPM1突变33例;白细胞计数<50×109(个/l)56例,骨髓原始细胞<50% 45例,外周血原始细胞<50% 40例。
1.2 治疗方法
所有患儿都给予地西他滨联合减量化疗治疗,第1天静脉滴注地西他滨,20 mg/m2,1次/天,使用3 d;第1~3天柔红霉素(D),静脉推注,25~40 mg/m2;阿糖胞苷(A),1~7 d 2次/天,静脉滴注,50~80 mg/m2。治疗观察4个疗程。
1.3 预后有效判定标准
巨核系、红系无异常,骨髓原粒细胞≤5%;无白血病浸润造成的相关症状及体征,生活不受影响;外周血无白血病细胞,儿童Hb>90 g/l,女性>90 g/l,男性>100 g/l。
1.4 调查资料
调查所有患儿的年龄、性别、骨髓原始细胞、外周血原始细胞、染色体核型、FLT3基因突变、NPM1突变、白细胞计数等基本资料。
1.5 统计方法
采用SPSS 21.00统计软件进行数据分析处理,计数资料以百分率(%)的形式表示,行χ2检验,计量资料以均数±标准差表示,行独立样本t检验,采用多因素logistic分析其独立危险因素,以P<0.05表示差异有统计学意义。
2 结果
2.1 疗效
治疗4个疗程后,79例患儿治疗有效56例,有效率为70.9%。
2.2 影响疗效的单因素分析
单因素分析显示有效组的骨髓原始细胞、外周血原始细胞、白细胞计数、染色体核型、FLT3突变、NPM1突变与无效组对比,差异有统计学意义(P<0.05);2组性别、年龄等差异无统计学意义(P>0.05)。见表1。

表1 影响T-ALL患儿预后疗效的单因素分析(例,%)
2.3 影响预后疗效的多因素分析
以患儿预后有效作为自变量,以骨髓原始细胞、外周血原始细胞、白细胞计数、染色体核型、FLT3突变、NPM1突变作为因变量,多因素logistic回归分析结果显示骨髓原始细胞、外周血原始细胞、白细胞计数、染色体核型、FLT3突变、NPM1突变都是影响T-ALL患儿疗效的独立危险因素(P<0.05)。见表2。
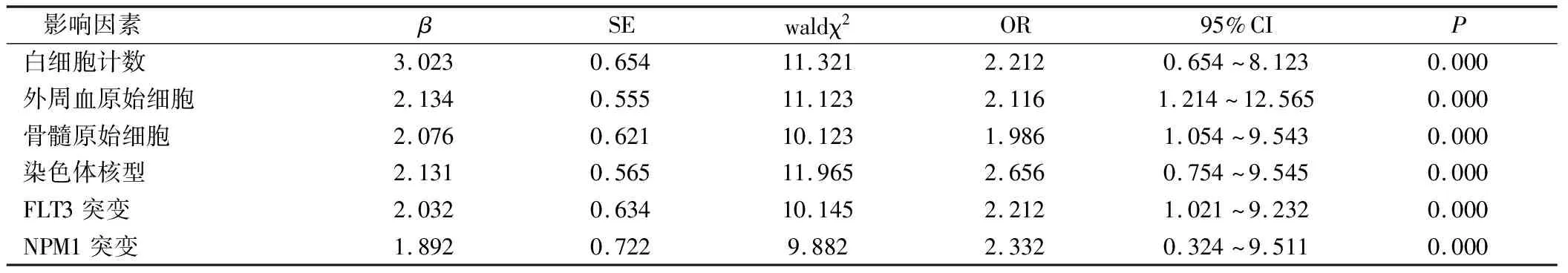
表2 影响T-ALL患儿预后疗效的多因素分析(n=78)
3 讨论
白血病是常见的血液系统恶性肿瘤之一,其中T-ALL比较少见,占所有白血病的5%左右[12]。有流行病学调查显示1~10岁是T-ALL高发年龄,且随年龄增长发病率逐渐降低。T-ALL患儿的身体机能下降,且自身免疫状态较差,多种因素均会影响化疗药物在体内的代谢作用,部分伴发疾病严重时甚至还可引起化疗不耐受情况[13],特别是很多患儿在化疗过程或整个疗程期间发生致命的感染或其他严重并发症风险更高[14]。目前T-ALL还无标准化的治疗方案,也未对其预后影响因素达成统一共识,临床治疗以经验性用药为主[15]。本研究显示治疗4个疗程后,79例患儿治疗有效56例,有效率为70.9%,虽稍高于既往研究,可能与本研究纳入病例相对较少有关,但整体保持一致。
现代研究表明多条信号通路相互交叉是T-ALL发生发展的一个重要机制,与肿瘤细胞增殖、凋亡、促进血管形成密切相关[16]。同时T-ALL 患儿预后的因素较多,由于各地人口学特征、医疗水平、经济条件有所差异,因此对当地T-ALL 患儿预后的影响因素调查对改善患者预后具有积极意义[17]。本研究单因素分析显示有效组的骨髓原始细胞、外周血原始细胞、白细胞计数、染色体核型、FLT3突变、NPM1突变与无效组对比,差异有统计学意义(P<0.05);多因素logistic回归分析结果显示骨髓原始细胞、外周血原始细胞、白细胞计数、染色体核型、FLT3突变、NPM1突变都是影响T-ALL患儿疗效的独立危险因素(P<0.05)。NPM1突变可以通过激活多种下游靶蛋白而发挥其功能,其中pAKT激活IkB激酶,降解IkB而使NF-ΚB活化进入细胞核而促进恶性肿瘤细胞生长[18]。相关研究也表明NPM1的突变与肿瘤的耐药和放射抵抗均有相关性,抑制该通路的活性可以逆转细胞的耐药性,增强放射敏感性[19]。骨髓原始细胞、外周血原始细胞、白细胞计数升高时提示机体可能发生感染等严重并发症,伴随着不同程度的电解质失衡、血液生化的改变,同时有报道称白细胞升高更易诱发老年人脑出血或心肺功能不全等严重并发症,影响化疗效果[20]。骨髓原始细胞、外周血原始细胞均可用于评价T-ALL患儿病情的严重程度,但临床上用于评价T-ALL的预后尚有一定争议,但可以作为细胞遗传学独立指导T-ALL的治疗[21-22]。FLT3是潜在的白血病的原癌基因,FLT3突变对正常血细胞增殖、分化产生破坏作用,进而影响T-ALL的发病与进展[23-24]。高危型染色体核型的T-ALL预后效果较差,可能与高危染色体核型患儿耐药基因的表达比例相对较高有关。当FLT3 通路调节失控后,促使Gli蛋白持续性激活、启动下游靶基因转录,从而促进肿瘤增殖[25]。
综上所述,地西他滨联合减量化疗治疗T-ALL患儿的疗效比较好,骨髓原始细胞、外周血原始细胞、白细胞计数、染色体核型、FLT3突变、NPM1突变为影响疗效的主要因素。

