壳聚糖-乳清蛋白-原花青素复合膜制备及性质鉴定
宗金环,姜丽君,张东亮*
山东理工大学农业工程食品科学学院(淄博 255049)
壳聚糖是自然界中唯一的一种碱性多糖,是由甲壳素部分或全部脱除乙酰基后得到的,其无毒且具有生物降解性和生物相容性[1-2]。近年来,壳聚糖作为一种天然膜材料,在果蔬保鲜方面受到越来越多的关注,但单一的壳聚糖膜抗菌性能和机械性能较差[3],因此,许多学者对壳聚糖复合膜进行研究:李爱珍等[4]用明胶、壳聚糖为原料制成复合膜,发现明胶-壳聚糖复合膜能有效防止细菌对鲜肉的侵染,延长鲜肉的货架期;Pranoto等[5]发现在壳聚糖中加入大蒜油后可增加抗菌性能,而对其机械性能几乎没有影响。
原花青素是一类在自然界广泛分布,从植物中分离得到的多酚类化合物[6-7],能有效清除体内自由基,是国际上公认的最有效的天然抗氧化剂[8]。有研究者制备含原花青素的鱼明胶-壳聚糖可食膜,发现原花青素的成膜溶液具有良好的抗氧化性[9]。但原花青素易被氧化,稳定性差,极易受到环境因素的影响(高温、光照、潮湿等),导致其生物利用率低[10-11]。因此,提高其稳定性是解决其投入应用的关键问题[12],但是目前对提高壳聚糖膜中原花青素的稳定性,增加其释放量的研究较少。蛋白质被视为多酚加入食品体系的良好载体[13],而乳清蛋白是一种营养丰富且功能强大的蛋白质[14-15],可用来提高原花青素的稳定性。但乳清蛋白膜是易脆的,当添加增塑剂(甘油等)后可使乳清蛋白膜具有一定的韧性[16]。
试验在传统保鲜方法的基础上,制备壳聚糖-乳清蛋白-原花青素复合膜,以提高原花青素的释放量为目的研究制膜工艺,同时检测不同复合膜的性质。研究成果能在一定程度上提高原花青素的释放量,使其抗氧化性增加,减缓水果蔬菜的腐败变质。
1 材料与方法
1.1 材料与仪器
壳聚糖(乙酰化大于90%,国药集团化学试剂有限公司);乳清蛋白(上海源叶生物科技有限公司);原花青素(天津希恩思生化科技有限公司);碳酸氢铵、冰乙酸、硫酸铁铵、甲醇、正丁醇、盐酸(均为分析纯)。
UV-1700型紫外分光光度计(日本岛津公司德国STA 449 C-QMS 403 C);同步(综合)热分析仪与质谱联用仪(德国耐驰公司);德国Bruker AXS D 8 Advance多晶X射线衍射仪器(德国Bruker AXS公司);Nicolet 5700傅里叶变换红外光谱仪(美国热电尼高力仪器公司);美国FEI Sirion 200场发射扫描电子显微镜(FEI香港有限公司)。
1.2 试验方法
1.2.1 原花青素含量的测定
采用铁盐催化比色法[15]在550 nm处测定原花青素含量。
1.2.2 制膜工艺设计
1.2.2.1 成膜液的制备
准确称取180 mL蒸馏水、6 g壳聚糖粉末、60 mL 1 mol/L的乙酸溶液、60 mL蒸馏水、42 mL 0.5 mol/L的NH4HCO3溶液、6 mL 1%的甘油、222 mL蒸馏水,依次加入1 000 mL的锥形瓶中,边加边用磁力搅拌器搅拌。
1.2.2.2 干燥过程中pH变化
取6份100 mL上述成膜液,分别加入0,1,3,5,7和9 mL 0.5 mol/L的NH4HCO3溶液,混合均匀后,置于40 ℃恒温干燥箱中干燥,每减少30 mL测量一次pH。
1.2.2.3 确定原花青素加入量
取6份25 mL的上述成膜液,分别加入0,1,3,5,7和9 mL 1%的原花青素溶液,混合均匀后倒入一次性培养皿中,并将其放在40 ℃恒温干燥箱中干燥24 h,成膜后取膜,并浸入50 mL蒸馏水中,每24 h测定原花青素含量,连续测定6 d。
1.2.2.4 确定乳清蛋白加入量
取6份25 mL成膜液,分别加入0,1,3,5,7和9 mL 1%的乳清蛋白溶液,干燥24 h后浸入50 mL蒸馏水中,每24 h测定原花青素释放量,连续测定6 d。
1.2.2.5 不同pH条件下原花青素释放量的确定
用0.2 mol/L磷酸氢二钠溶液和0.1 mol/L柠檬酸溶液配置不同pH的缓冲溶液,经上述3个过程完成各项单因素条件优化之后,按完整制膜方法配置成膜液,分别取6份25 mL上述成膜液,并将其放在40 ℃恒温干燥箱中干燥24 h,干燥完成后加入30 mL不同pH缓冲溶液浸泡,每24 h测定原花青素释放量,连续测定3 d,确定复合膜的最佳保存条件。
1.2.3 膜性质检测设计
制备3种不同的复合膜:壳聚糖-原花青素膜(CP)、壳聚糖-乳清蛋白-原花青素复合膜(CWPP)、壳聚糖-乳清蛋白-原花青素复合膜,浸泡7 d干燥(CWPPW),并检测其性质。
1.2.3.1 X射线衍射
使用X射线衍射仪器对复合膜的晶体结构进行检测,并绘制XRD图。
1.2.3.2 红外光谱分析
利用特定波长的红外射线,对膜的分子结构进行分析和鉴定,并绘制红外吸收光谱。
1.2.3.3 扫描电镜
使用场发射扫描电子显微镜对其进行扫描,分别拍摄上述复合膜在200,100和50 μm长度下的显微照片。
1.2.3.4 TG-DTA
使用同步(综合)热分析仪与质谱联用仪对复合膜的热力学性质进行检测。
2 结果与讨论
2.1 制膜工艺
2.1.1 成膜液干燥过程pH变化
乳清蛋白的等电点为5.0左右[17-18]。在成膜液中,若溶液pH过低,会在一定程度上影响乳清蛋白的活性,从而影响乳清蛋白的水解反应,进而影响复合膜中原花青素的释放量;若成膜液pH过高,会导致干燥后的复合膜脆性大,影响复合膜的质量。由图1可以看出,在成膜液中,加入7 mL 0.5 mol/L的NH4HCO3溶液时,可保证复合膜在干燥的过程pH稳定在5.0~5.5,既能保证复合膜中乳清蛋白的最大活性,最大限度地提高原花青素的释放量,又能降低成膜的脆性,保证干燥后的复合膜的柔韧性。因此,每100 mL成膜液中应添加7 mL 0.5 mol/L的NH4HCO3溶液。
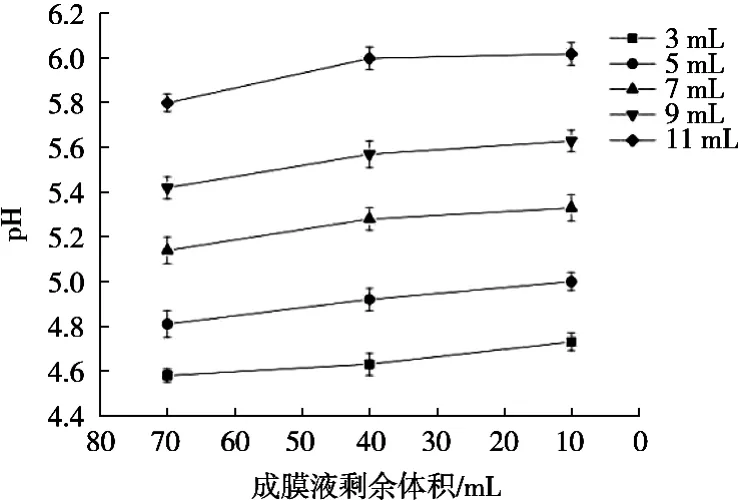
图1 成膜液干燥过程中的pH变化
2.1.2 复合膜中原花青素量的确定
由图2可以看出,溶液中原花青素的释放量与成膜液中原花青素的添加量及膜的浸泡时间有关。每25 mL成膜液添加1%的原花青素溶液体积1~7 mL时,原花青素的释放量随着原花青素溶液体积的增大而增多,且在原花青素添加体积7 mL时释放量达到最大;但添加量超过7 mL时,释放量开始下降或趋于稳定。同时,复合膜的浸泡天数也影响原花青素的释放,在一定程度上,浸泡时间越长,释放量越低。因此,每100 mL成膜液中添加7 mL 1%的原花青素溶液,原花青素的释放量最佳。
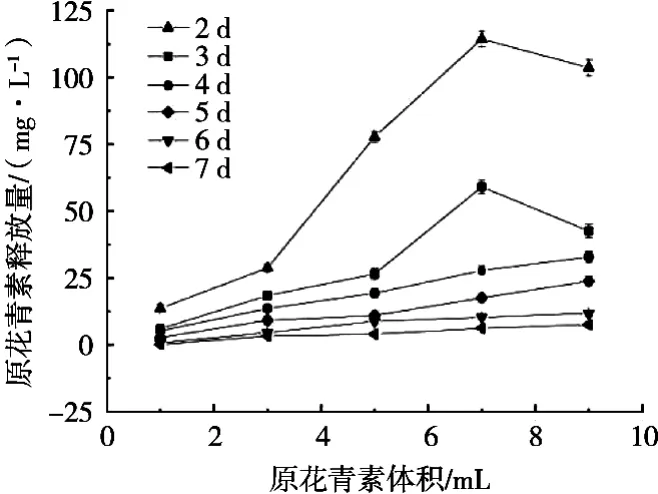
图2 原花青素体积对原花青素释放量的影响
2.1.3 复合膜中乳清蛋白量的确定
由图3可以发现,溶液中原花青素的释放量与成膜液中乳清蛋白的添加量及膜的浸泡时间有关。每25 mL成膜液添加1~3 mL 1%的乳清蛋白时,原花青素的释放量与乳清蛋白的添加体积线性关系并不稳定;添加量5和9 mL时,原花青素的释放量明显增多或趋于稳定;添加量7 mL时,释放量开始下降或趋于稳定。而且在试验过程中,乳清蛋白添加量7~9 mL的复合膜在浸泡过程中,发生肉眼可见的明显断裂,成膜性极差。同时,复合膜的浸泡天数也影响原花青素的释放,在一定程度上,浸泡时间越长,释放量越低;浸泡4 d后释放量基本稳定,最适宜的添加量均为5 mL。因此,每100 mL成膜液中1%乳清蛋白溶液的最适添加量为5 mL。
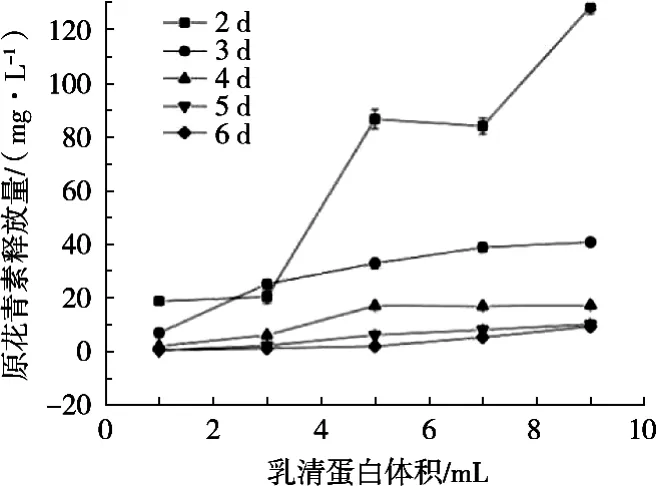
图3 乳清蛋白添加量对原花青素释放量的影响
2.1.4 不同pH下原花青素释放量
由图4可以看出,溶液中原花青素的释放量与缓冲溶液的pH及膜的浸泡时间有关。缓冲溶液的pH 2.2时,浸泡中的膜0.5 h内被腐蚀变为乳浊液,无法利用;缓冲溶液pH 3~4时,原花青素的释放量随着pH增大而增多;缓冲溶液的pH 4~7时,原花青素的释放量随着pH增大又开始下降。同时,复合膜的浸泡天数也影响原花青素的释放,在一定程度上,浸泡时间越长,释放量越低,浸泡3 d后释放量基本稳定,最适宜的缓冲溶液pH为4。因此,复合膜制备完成后,最适保存条件为pH 4。
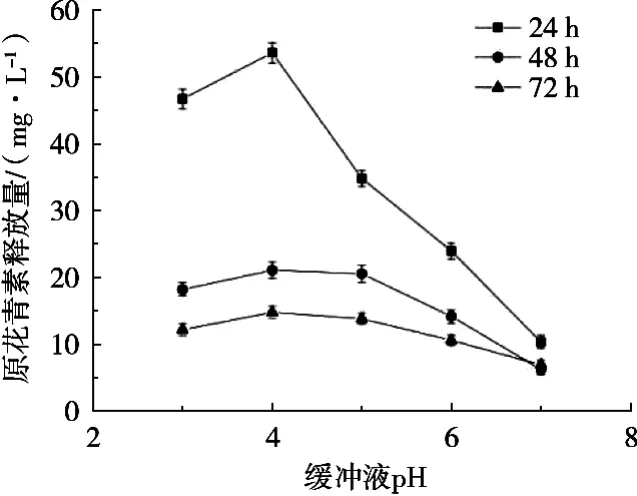
图4 不同pH缓冲溶夜浸泡下原花青素的释放量
2.2 膜性质检测
2.2.1 扫描电镜
由图5可得,CP、CWPP和CWPPW的膜表面较光滑致密,说明其成膜性较好;CP与CWPP比较,CP由于未加入乳清蛋白,水解程度低、原花青素释放量少,所以在电镜下可以看到明显的原花青素颗粒,CWPP则不能;CWPP与CWPPW比较,由于原花青素是水溶性的,CWPPW的表面有些许颗粒并有少量空隙存在,可能是经过处理后结晶被破坏后造成的。

图5 扫描电镜镜像
2.2.2 X射线衍射
由图6可得,图中峰值代表的是结晶度,且其最高峰值越小表示晶体交联越松散[19],晶体的交联越松散则原花青素的释放量就会越多,所得的膜就越符合期待的膜质量。3种复合膜的XRD图由结晶衍射峰和大量的弥散衍射峰组成,其中弥散衍射峰是一些结晶度很低的半晶体聚合物[19-20];CP和CWPP的衍射峰形趋势基本一致(有一个明显的衍射峰和大量的弥散衍射峰),说明乳清蛋白未对CP的结晶度产生影响;当2θ为20.06°时,CP和CWPP出现一个较强的衍射峰,说明这时CP和CWPP膜分子之间的交联度较弱,结晶度较强;CWPPW与CWPP有明显的区别,CWPPW整体交联度较好;当2θ为11.88°和18.68°时,CWPPW有2个较弱的衍射峰,无较强的衍射峰,说明经过水浸泡处理后可使CWPP的结晶度减弱,使原花青素的释放量增多。
2.2.3 红外光谱
由图7可以发现,CP与CWPP的红外光谱图趋势在整体上基本一致,但CWPPW与CWPP有明显区别;乳清蛋白与壳聚糖分子间存在氢键和静电相互作用[21],在2 906.199和3 320.82 cm-1处,CWPP较CP有所变化,可能是添加乳清蛋白后,乳清蛋白中的N—H伸缩振动峰增大氢键作用力;CWPP有一个宽峰,该峰为O—H与N—H伸缩振动峰,在浸泡过程中,壳聚糖中的—OH与乳清蛋白中的—OH发生交联,导致其O—H峰消失。在752 cm-1和1 326.785 cm-1等处O—H、C—H发生伸缩及变形振动,CP和CWPP趋势一致,肩峰均比CWPPW减弱,说明经水浸泡后会使原来的分子排列发生变化。
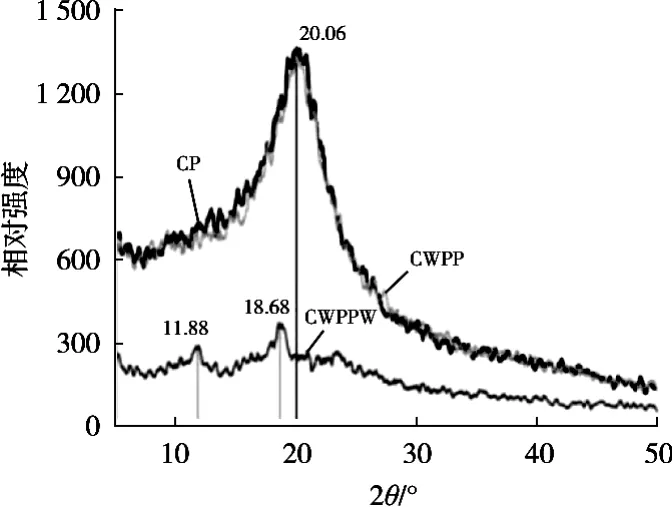
图6 不同壳聚糖复合膜的XRD图
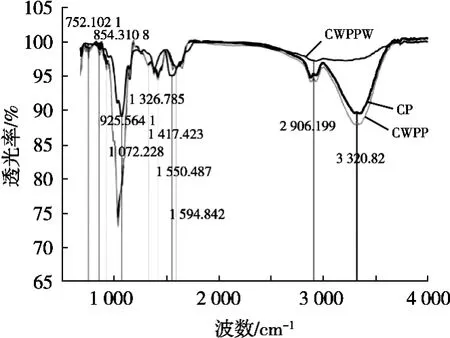
图7 不同壳聚糖复合膜的红外光谱分析图
2.2.4 TG-DTA
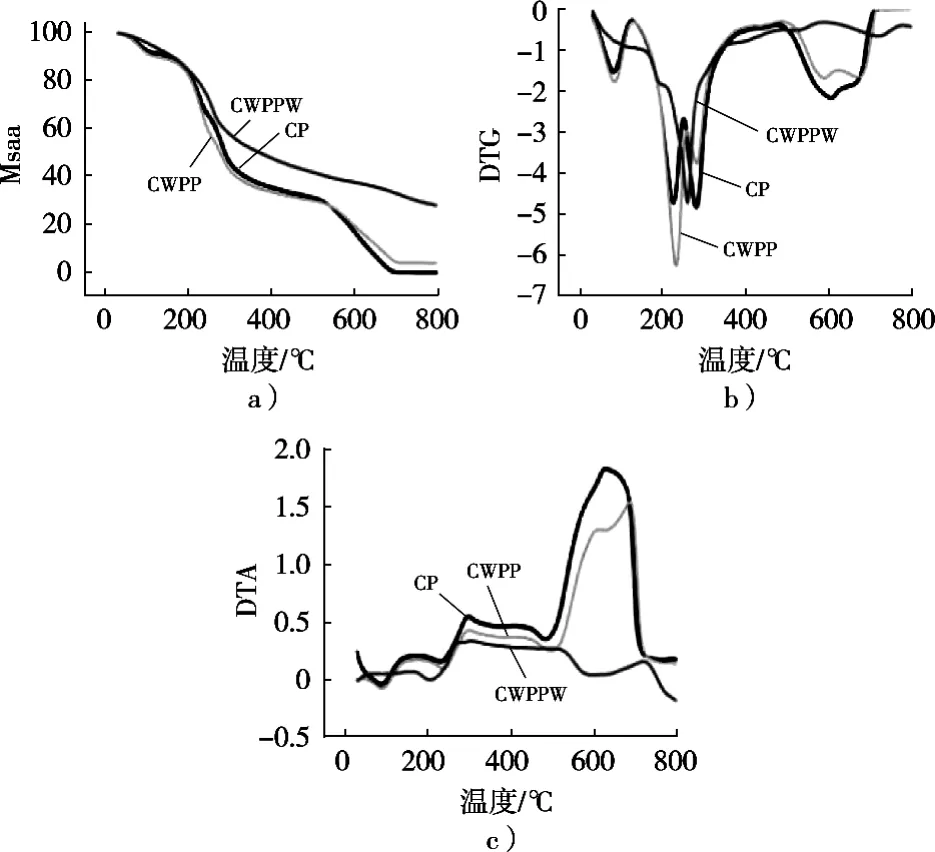
图8 不同壳聚糖复合膜的TG、DTG和DTA分析图
由图8(a)和(b)可知,CP和CWPP的TG和DTG图趋势基本一致,起始分解温度在50 ℃左右,且过程大致可分为3个阶段:第一阶段出现在100 ℃附近,主要为脱水;第二阶段出现在170~500 ℃,最大分解速率在220 ℃左右;第三阶段出现在550~700℃;较CP和CWPP而言,CWPPW的热稳定性更好,这可能是因为CWPPW的结晶度较低,其结合水较少,增大了其热稳定性[22]。由图8(c)可知,CP和CWPP的玻璃转化温度在100 ℃附近,而CWPPW的玻璃转化温度在200 ℃附近,说明CWPPW更加稳定;在650 ℃左右,CP有一明显的吸热峰,而CWPP的吸热峰向高温方向移动,说明乳清蛋白的添加提高了热稳定性。
3 结论
制备壳聚糖-乳清蛋白-原花青素复合膜,以提高原花青素的释放量为目的,研究成膜液的最适pH、复合膜中最佳乳清蛋白添加量及复合膜中最佳原花青素添加量。结果表明,在制膜工艺中,成膜液的最适pH为5.0~5.5;在100 mL成膜液中,0.5 mol/L NH4HCO3溶液的最适添加量为7 mL,1.0%的乳清蛋白的最适添加量为5 mL,1.0%的原花青素的最适添加量为7 mL;复合膜的最适保存pH为4。此外,对不同的复合膜(CP、CWPP、CWPPW)进行电镜扫描、X射线衍射、红外线检测和TG-DTA检测,发现乳清蛋白和壳聚糖与原花青素有较好的相容性和较强的氢键作用力,有明显的结晶度,但经过水浸泡干燥后,复合膜的结晶度降低,交联性变大。

