液相色谱串联质谱法测定水果中多菌灵残留量
吕小丽,朱春燕,郭平,胡重怡,张威,王栋*
1. 江西省食品检验检测研究院(南昌 330001);2. 赣州市全标生物科技有限公司(赣州 341100)
多菌灵(Carbendazim)又名棉萎灵、苯井咪唑44号,分子式为C9H9N3O2,为高效低毒内吸性杀菌剂,难溶于水和一般有机溶剂,可溶于硫酸、盐酸和醋酸等有机酸。多菌灵化学性质稳定,残留期较长,对大鼠急性口服半数致死量为8.0~10 g/kg,小鼠口服半致死量为5.0 g/kg,对人有一定的毒性,可引起精神恍惚、恶心呕吐、头昏头疼等中毒症状。因此,农产品中多菌灵的残留越来越引起人们的重视。各国对多菌灵的限量要求也越来越严格。2011年,欧盟管理委员会发布(EC)No 559/2011号令,将柑桔中多菌灵限量由原来的0.5 mg/kg调整为0.2 mg/kg[1]。2015 年,欧委会根据(EC)No 1107/2009法规,准备逐步淘汰多菌灵[2]。国际食品法典委员会规定多菌灵在黄瓜、橙等作物中的46项限量,限量最低为0.05 mg/kg[3]。美国于07年12月撤销了多菌灵的限值,而在2009年1月,美国FDA全面禁止进口有多菌灵残留的农产品[3]。为了更好地应对国外技术壁垒,建立相应的检测方法是非常必要的。
目前测定多菌灵残留的方法主要有分光光度法[4]、液相色谱法[5-10]、液相色谱质谱法[11-12]、导数同步荧光法[13]。试验在弱碱性条件下,采用乙酸乙酯提取试样中的多菌灵,用MCX固相萃取柱净化,液相色谱-质谱/质谱法进行检测,外标法定量。检测基体包括苹果、猕猴桃、脐橙、西瓜、葡萄,经方法验证后,方法的线性范围、定量限、回收率和精密度均能满足多菌灵残留量的检测要求。
1 材料与方法
1.1 仪器与设备
液相色谱-质谱/质谱仪(Agilent 6495,Agilent公司);旋涡混合器(IKA MS2,德国);振荡器(WSZ-100A,上海一恒科技);离心机(TDL-5-A,上海安亭);旋转浓缩仪(R-215,瑞士BUCHI);氮吹浓缩仪(NEVP-24,美国Organomation)。
1.2 样品、试剂和材料
苹果、猕猴桃、脐橙、西瓜、葡萄,市售。用组织捣碎机将样品匀浆,混合均匀后装入洁净容器内密封并做好标识,即为试样。所有试样均在-18 ℃冰箱中保存。
乙酸乙酯、乙腈、甲醇均为色谱纯;氢氧化钠、盐酸、氨水为分析纯;洗脱溶剂为氨水-甲醇(体积比4:96);配制溶液用水为超纯水;多菌灵标准物质(Dr.E公司)纯度≥99.0%;混合型强阳离子交换固相萃取柱为Oasis MCX(6 mL,150 mg)。使用前依次用6 mL甲醇、6 mL水和6 mL 0.1 mol/L盐酸对柱子进行活化;有机系针孔滤膜(0.22 μm,天津津腾)。
1.3 标准溶液的制备
标准储备液(100 μg/mL):准确称取10.0 mg多菌灵标准品,用甲醇溶解并定容至100 mL,混匀。在-18 ℃以下避光保存;标准中间液(10 μg/mL):在室温下取1 mL标准储备液置于10 mL容量瓶中,用甲醇稀释定容,在4 ℃冰箱内避光保存。
1.4 LC-MS/MS分析条件
1.4.1 液相色谱条件
色谱柱为C18柱,150 mm(柱长)× 2.1 mm(内径),粒度5 μm;流动相为乙腈-水(20+80,体积比);流速为300 μL/min;柱温为35 ℃;进样量为5 μL。
1.4.2 质谱/质谱条件
离子化模式为电喷雾电离(ESI)正离子模式;扫描方式为多反应监测(MRM);分辨率为单位质量分辨率(Unit);毛细管电压为3 500 V;干燥气温度为350 ℃;干燥气流量为10 L/min;雾化器压力为35 psi;碰撞气为氮气;其它质谱参数见表1。
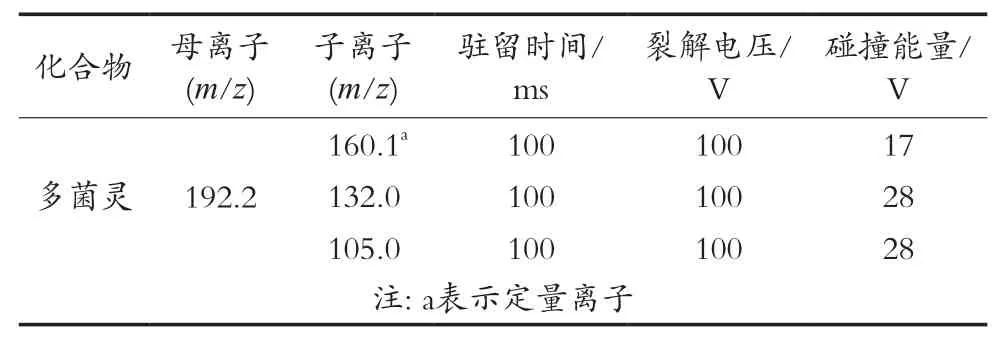
表1 主要参考质谱参数
1.5 样品前处理方法
1.5.1 提取
称取5 g(精确至0.01 g)试样于50 mL离心管中,加入0.5 mL 1.0 mol/L氢氧化钠溶液和20 mL乙酸乙酯涡旋混匀后,振荡提取30 min,以4 500 r/min离心5 min,收集上清液到150 mL浓缩瓶中。残渣再加入20 mL乙酸乙酯,重复提取1次,合并上清液,在45 ℃下旋转蒸发浓缩至5 mL左右,转移至25 mL离心管中,在45℃下氮气吹干,加入10 mL 0.1 mol/L盐酸溶液,超声5 min溶解,待净化。
1.5.2 净化
将上述待净化溶液全部转移至活化好的MCX柱中,再依次用6 mL 0.1 mol/L盐酸溶液、6 mL甲醇淋洗小柱,弃去淋洗液;真空抽干2 min,用6 mL氨水-甲醇溶液(4+96,V:V)进行洗脱,收集洗脱液。在45 ℃下氮吹干,准确加入5.0 mL乙腈-水溶液(20+80,V:V),超声2 min溶解残渣,混匀后,取部分溶解液过0.22 μm微孔滤膜后,供液相色谱-质谱/质谱仪测定。
2 结果与讨论
2.1 提取溶剂的选择
目前常用于提取多菌灵的溶剂有乙腈、甲醇、丙酮、乙酸乙酯,因此试验过程中分别选取乙腈、甲醇、丙酮、乙酸乙酯作为提取溶剂,取10份阴性的脐橙样品,添加浓度为20 μg/kg,对样品中的多菌灵进行提取,回收率如表2所示。甲醇、乙酸乙酯和碱性乙酸乙酯的提取效果都不错,但考虑到甲醇的沸点较高,在后续浓缩过程会延长时间,可能会造成待测物损失。另由于多菌灵在酸性条件下极性较强,易溶于水及一些极性溶剂,只有在中性及弱碱性条件下极性弱,更易溶于一些非极性的有机溶剂。通过试验也发现乙酸乙酯溶液中加入氢氧化钠溶液后回收率更高,因此最终选择乙酸乙酯在弱碱性条件下提取。
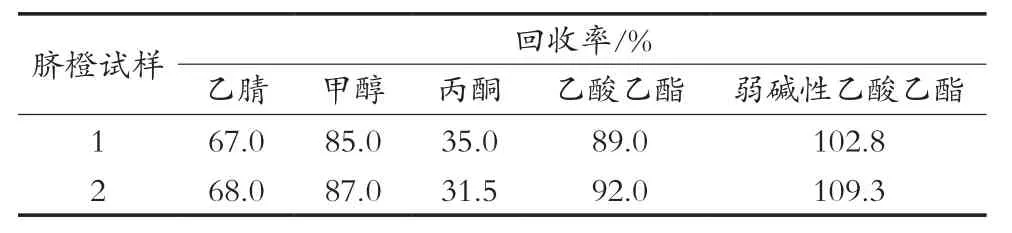
表2 不同提取溶剂的多菌灵回收率结果
2.2 提取方式的选择
目前振荡提取和匀浆提取是实验室中水果样品最常用的提取方法。取两个含有多菌灵的脐橙样品,分别采用匀浆提取和振荡提取进行3次平行试验,并对结果进行比较,结果如表3所示。结果表明,振荡提取效果更好,而且操作简便,适合于大批量检测,因此最终提取方式选用振荡提取。
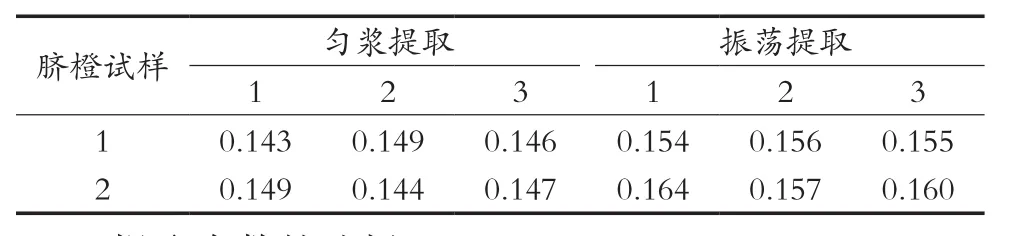
表3 不同提取方式下多菌灵检出量 mg/kg
2.3 提取次数的选择
为保证样品中多菌灵能够提取完全,对提取次数进行研究。试验采用20.0 μg/kg的添加水平,改变提取次数,多菌灵的回收率如图1所示。结果表明,振荡提取2次,多菌灵已基本提取完全。增加提取次数会导致后续操作时间延长,不利于后续的浓缩步骤,因此从试验效果、提取时间和试验成本等因素考虑,确定提取次数为提取2次。
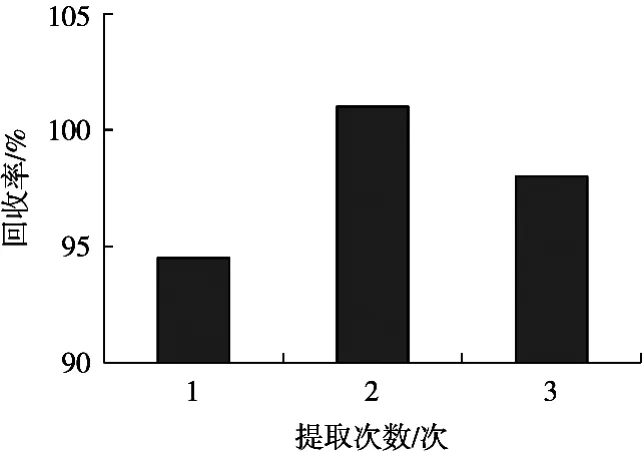
图1 多菌灵回收率与提取次数变化趋势图
2.4 净化方式的选择
目前常用于多菌灵净化的固相萃取柱有C18固相萃取柱和MCX混合型阳离子交换柱。试验采用100.0 μg/kg的添加水平,对苹果和脐橙样品分别考察C18柱和MCX柱的净化效果,多菌灵回收率结果如表4所示。从表4可以看出,MCX柱净化后多菌灵的回收率结果比C18柱净化后回收率更高,因此选用MCX混合型阳离子交换柱作为净化小柱。
Kilimall早期的买家当中,很大一部分是非洲的有钱人和政府公务员,在当地有权有势,稍有工作失误或者沟通上的误会,就容易造成险情。买家直接带着警察和律师上门是常有的事。
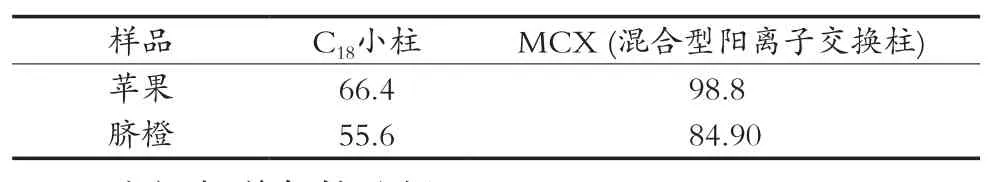
表4 C18固相萃取柱和MCX固相萃取柱净化后回收率比较 %
2.5 液相色谱条件选择
对多菌灵标准溶液进行分析时发现以甲醇-水为流动相时,多菌灵峰型宽且拖尾,改用乙腈-水为流动相后,峰宽变小,峰形变尖锐。因此试验采用乙腈-水为流动相。不同流动相下多菌灵标准图谱如图2和图3所示。

图2 不同流动相下多菌灵标准图谱(流动相:甲醇-水)
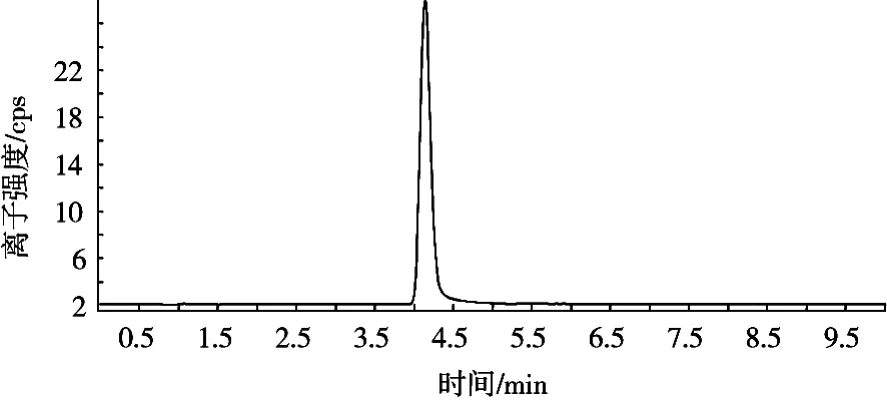
图3 不同流动相下多菌灵标准图谱(流动相:乙腈-水)
2.6 质谱条件的选择
以多菌灵标准溶液为对象,用全扫描方式进行扫描,选取m/z 192.2为母离子,通过二级质谱碎裂,获取了三个信号最强的子离子,分别为m/z 160.1,132.0和105.0。
2.7 质谱基质效应
分别采用试剂标准曲线和基质标准曲线对同时处理的多个添加回收试验进行回收率校准,各回收率如表5所示。从两种标准曲线校准所得回收率可以看出两者无很大区别,说明基质影响小,而且由于多菌灵为限用药物,很难获得完全阴性的样品作为基质,因此方法采用试剂线性进行校准。
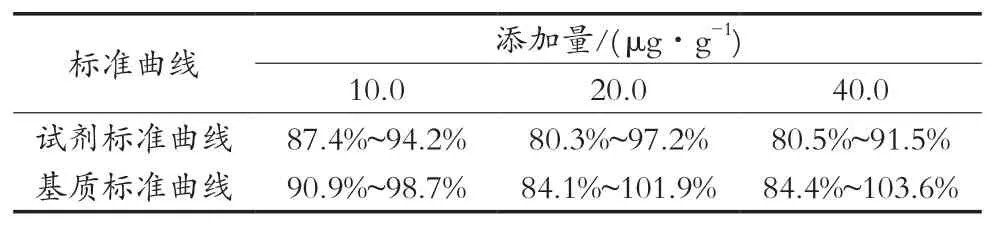
表5 试剂标准曲线和基质标准曲线校准后回收率数据(n=6)
2.8 方法学验证
2.8.1 线性范围和定量限
在方法所确定的试验条件下,多菌灵在5.0~200 ng/mL范围内呈良好的线性关系,线性相关系数为0.999 9,线性回归曲线如图4所示。当添加水平为0.01 mg/kg时,信噪比(S/N)大于10,可满足定量检测要求;方法的定量限可达0.01 mg/kg,能够满足我国对水果中多菌灵监控的需求。
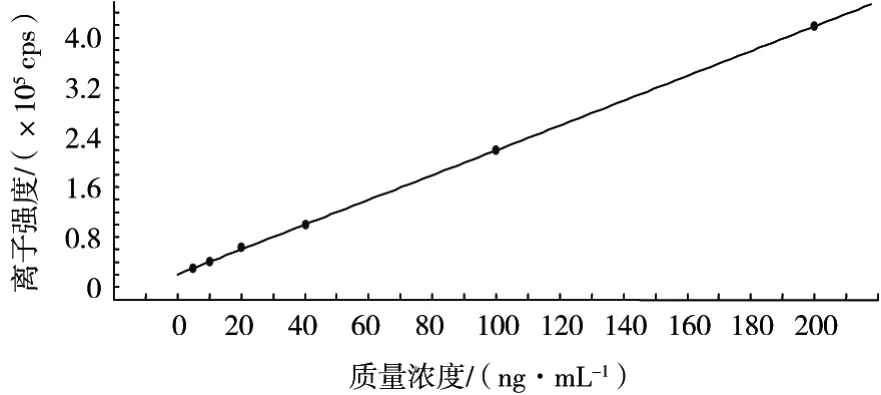
图4 线性回归曲线
方法采用向阴性样品中添加的方式进行方法学评估。以不含多菌灵的苹果、猕猴桃、脐橙、西瓜、葡萄为基质,进行10.0,20.0和40.0 μg/kg三个不同浓度水平的添加回收试验,每个水平进行6次平行测定,回收率范围在88.2%~100.5%之间,相对标准偏差在2.05%~8.78%之间,具体结果如表6所示,表明方法能够满足农兽药残留检测的需求。
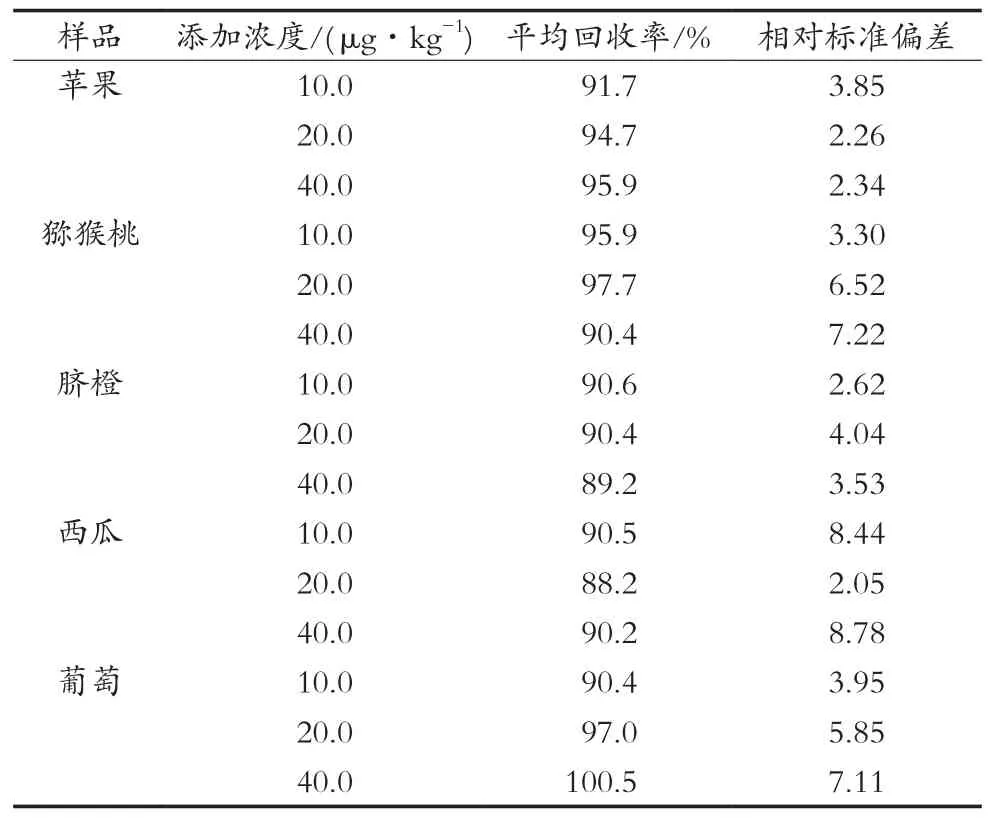
表6 不同基质加标样品的回收率和精密度试验结果(n=6)
3 结论
研究结果表明,样品在弱碱性条件下采用乙酸乙酯振荡提取后,用MCX固相萃取柱净化,液相色谱-质谱/质谱法测定苹果、猕猴桃、脐橙、西瓜、葡萄等水果中多菌灵,经方法验证后,方法的线性范围、定量限、回收率和精密度均能满足多菌灵残留量的检测要求。方法灵敏度高、回收率高,可用于水果中多菌灵的确证检测。

