提取黑果腺肋花楸果中金丝桃苷的工艺
宋健刚,钟方丽*,王晓林,牟荣琴
吉林化工学院化学与制药工程学院(吉林 132022)
黑果腺肋花楸(Aronia melanocarpa)系蔷薇科腺肋花楸属灌木,该树种集药用、食用、园林和生态价值于一体,市场前景非常广阔。其果实为黑色球形,味甜酸稍有涩感,食用方法众多,如果汁、果脯、果干和果酱等[1-3]。果实富含多酚、维生素和黄酮类化合物,具有众多的保健功能。在欧美等国家,其果实提取物已在食品、药品等领域广泛应用[4-5]。黑果腺肋花楸果具有保肝、抗微波辐射及紫外线作用,还有防治糖尿病及心脑血管疾病等生理活性[6-9]。已从黑果腺肋花楸果实中成分分离得到三萜类、黄酮类、酚酸类、甾醇类、糖及糖苷类等成分[10],黄酮类化合物以花色苷、槲皮素及其衍生物为主。槲皮素衍生物主要以金丝桃苷、异槲皮素为主,金丝桃苷具有抗炎、抗肿瘤、利尿、止咳、降血压、降低胆固醇、增强免疫力和抗抑郁等众多功能[11-12]。离子液体是在室温下呈液体的有机离子体系,具有溶解能力高、性质稳定、挥发性低等独特的物理化学性质,与传统有机溶剂相比,离子液体具有绿色环保、不易燃烧等特点,其在天然植物活性成分提取领域已有所应用[13-15]。超声波能够使植物组织破碎,加速提取溶剂在植物中的渗透,如果将离子液体与超声波联用,将提高目标物质的提取率[16-17]。因此,试验采用离子液体辅助超声波技术,通过单因素试验和正交试验优化了黑果腺肋花楸果中金丝桃苷的提取工艺条件,为黑果腺肋花楸果的深入开发提供了试验依据。
1 材料与方法
1.1 材料与试剂
黑果腺肋花楸果购自吉林省黑果花楸农业科技开发有限责任公司,干燥,粉碎,待用。
金丝桃苷对照品(成都曼思特生物科技有限公司);1-丁基-3-甲基咪唑硝酸盐、氯化-1-丁基-3-甲基咪唑、1-丁基-3-甲基咪唑四氟硼酸盐、1-丁基-3-甲基咪唑硫酸氢盐、溴化-1-丁基-3-甲基咪唑(纯度99%,上海成捷化学有限公司);甲醇、乙腈(色谱纯,天津大茂化学试剂公司);水为重蒸馏水;其余所用试剂均为国产分析纯。
1.2 仪器与设备
LC-2000型高效液相色谱仪(大连依利特分析仪器有限公司);W 5-100 SP型恒温水浴锅(上海申生科技有限公司);FA 2004 N型电子分析天平(上海精密科学仪有限公司);JBT/C-YCL型超声波药品处理机(济宁金百特电子有限责任公司);JYL型粉碎料理机(山东九阳小家电有限公司)。
1.3 方法
1.3.1 黑果腺肋花楸果提取液中金丝桃苷的HPLC含量测定方法
1.3.1.1 色谱条件
色谱柱为大连依利特ODS2 C18(4.6 mm×250 mm,5 μm);流动相A为乙腈,流动相B为0.25%醋酸水溶液;程序:0~45 min,15%~20% A;流速为1.0 mL/min;柱温为30 ℃;进样量为20 μL;检测波长为360 nm[18]。在此条件下,金丝桃苷的保留时间为16.03 min,理论塔板数为87 242,与相邻峰的分离度为2.53。HPLC色谱图见图1。
1.3.1.2 对照品溶液的制备
精密称取2.30 mg干燥至恒质量的金丝桃苷对照品,置于25 mL的容量瓶中,用甲醇溶解并定容至刻度,摇匀,配制成质量浓度为0.092 mg·mL-1的对照品溶液,置于冰箱中避光保存备用[19]。
1.3.1.3 供试样品溶液的制备
称取5 g黑果腺肋花楸果粉末,放入圆底烧瓶中,以一定的料液比加入离子液体乙醇水溶液,超声提取,过滤,收集提取液,转移至50 mL容量瓶中并用提取溶剂稀释至刻度,摇匀,用微孔滤膜(0.22 μm)滤过,取续滤液,作为供试品溶液。
1.3.1.4 流动相的选择
试验主要考察甲醇-0.1%醋酸水溶液、乙腈-0.25%醋酸水溶液、乙腈-0.25%磷酸水溶液等各种流动相对黑果腺肋花楸果提取液中金丝桃苷保留时间和分离度的影响。
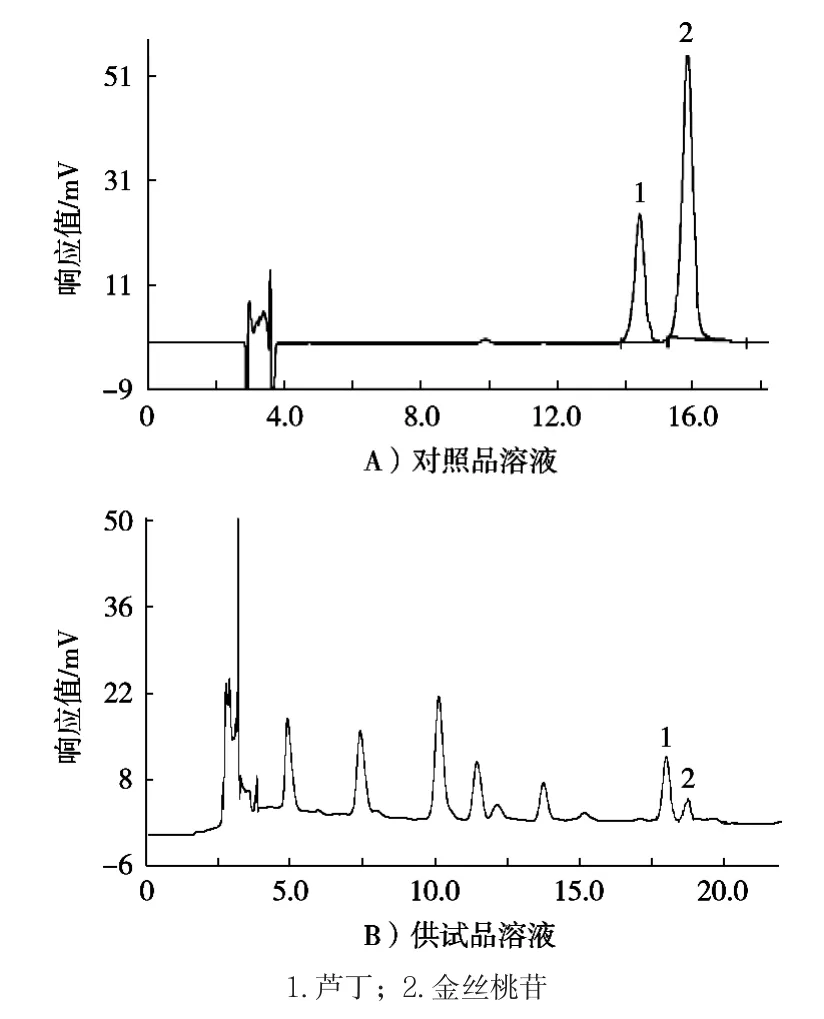
图1 对照品溶液及供试品溶液的HPLC图谱
1.3.1.5 线性关系考察
吸取金丝桃苷的对照品溶液,配制成质量浓度分别为0.97,1.84,3.68,5.52,7.36,29.0,11.04,14.72和18.40 μg·mL-1的系列对照品溶液,分别进样20 μL,测定金丝桃苷的峰面积。以金丝桃苷峰面积为纵坐标、质量浓度为横坐标,绘制标准曲线[20],得回归方程Y=56.205X+11.297,R=0.998 1(n=9)。结果表明金丝桃苷进样浓度在0.97~18.40 μg·mL-1范围内与峰面积线性关系良好。
1.3.1.6 重复性试验
取6份同一批号黑果腺肋花楸果粉末,按1.3.1.3项下方法制备供试品溶液,进样量各20 μL,测定金丝桃苷的峰面积。金丝桃苷峰面积分别为140.68,141.87,140.84,141.54,141.95和140.76,RSD为0.41%,表明该含量测定方法具有较好的重复性。
1.3.1.7 仪器精密度试验
吸取对照品及供试品溶液,连续进样6次,每次进样20 μL,分别测定对照品及供试品溶液中金丝桃苷的峰面积。供试品中金丝桃苷峰面积分别为141.84,142.28,139.87,145.62,141.95和140.88,RSD为1.37%。对照品中金丝桃苷峰面积分别为496.09,485.94,497.15,488.47,491.28和487.96,RSD为0.93%,表明仪器精密度符合要求。
1.3.1.8 供试品溶液的稳定性试验
吸取供试品溶液,分别于0,1,3,5,7和24 h进样20 μL,测定金丝桃苷的峰面积。供试品中金丝桃苷峰面积分别为141.84,140.82,138.75,142.73,141.07和142.12,RSD为0.99%,表明供试品溶液在室温下24 h内稳定,满足测定要求。
1.3.1.9 加样回收率试验
称取6份金丝桃苷含量已知的黑果腺肋花楸果粉末,每份中加入0.5 mL质量浓度为92.00 μg·mL-1的金丝桃苷对照品溶液,按1.3.1.3项下方法制备供试品溶液,在上述色谱条件下,测定金丝桃苷的峰面积。
1.3.1.10 检测限与定量限试验
吸取适量对照品溶液,逐步稀释,直到检测峰高为基线噪声的3倍为止,计算金丝桃苷的最低检测浓度。结果表明,金丝桃苷的最低检测限为0.029 44 μg·mL-1。吸取适量对照品溶液,逐步稀释,直到检测峰高为基线噪声的10倍为止,计算金丝桃苷的定量限[21]。结果表明,金丝桃苷的定量限为0.055 20 μg·mL-1。
1.3.2 离子液体超声辅助提取黑果腺肋花楸果中金丝桃苷工艺条件的优化
1.3.2.1 单因素试验
1) 离子液体类型的选择。称取5 g黑果腺肋花楸果粉末,放入圆底烧瓶中,加入浓度为0.05 mol·L-1的不同离子液体的50%乙醇水溶液,离子液体分别为:溴化-1-丁基-3-甲基咪唑、氯化-1-丁基-3-甲基咪唑、1-丁基-3-甲基咪唑四氟硼酸盐、1-丁基-3-甲基咪唑硫酸氢盐、1-丁基-3-甲基咪唑硝酸盐。放入超声机中,料液比为1:20(g/mL),设定水浴温度50~60 ℃、超声功率80 W、提取30 min,过滤,滤液转移到50 mL容量瓶中,50%乙醇水溶液定容,摇匀,用微孔滤膜(0.22 μm)滤过,弃去初滤液,取续滤液作为供试品溶液。按1.3.1.1节色谱条件进样20 μL,测定金丝桃苷的峰面积,计算金丝桃苷的提取率。
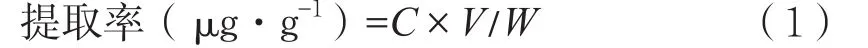
式中:C为提取液中金丝桃苷的质量浓度(μg·mL-1);V为提取液定容的体积(mL);W为黑果腺肋花楸果粉末的质量(g)。
2) 提取溶剂的选择。称取5 g黑果腺肋花楸果粉末,放入圆底烧瓶中,加入浓度为0.05 mol·L-1的1-丁基-3-甲基咪唑硝酸盐乙醇水溶液,乙醇体积分数分别设定为0,10%,30%,50%,70%和90%,放入超声机中,其他按1.3.2.1节中(1)方法提取。按1.3.1.1节色谱条件进样20 μL,测定金丝桃苷的峰面积,计算金丝桃苷的提取率。
3) 离子液体浓度的选择。称取5 g黑果腺肋花楸果粉末,放入圆底烧瓶中,加入浓度分别为0.05,0.1,0.3,0.5,0.7,0.9和1.1 mol·L-1的1-丁基-3-甲基咪唑硝酸盐50%乙醇水溶液[22],放入超声机中,其他按1.3.2.1节中(1)方法提取。按1.3.1.1节色谱条件进样20 μL,测定金丝桃苷的峰面积,计算金丝桃苷的提取率。
4) 料液比的选择。称取5 g黑果腺肋花楸果粉末,放入圆底烧瓶中,加入浓度为0.05 mol·L-1的1-丁基-3-甲基咪唑硝酸盐50%乙醇水溶液,放入超声机中,料液比分别设定为1:5,1:10,1:20,1:30,1:40和1:50(g/mL),其他按1.3.2.1节中(1)方法提取。按1.3.1.1节色谱条件进样20 μL,测定金丝桃苷的峰面积,计算金丝桃苷的提取率。
5) 提取时间的选择。称取5 g黑果腺肋花楸果粉末,放入圆底烧瓶中,加入浓度为0.05 mol·L-1的1-丁基-3-甲基咪唑硝酸盐50%乙醇水溶液,放入超声机中,料液比设定为1:20(g/mL),提取时间分别设定为5,10,15,20,30,40,50和60 min,其他按1.3.2.1节中(1)方法提取。按1.3.1.1节色谱条件进样20 μL,测定金丝桃苷的峰面积,计算金丝桃苷的提取率。
6) 超声功率的选择。称取5 g黑果腺肋花楸果粉末,放入圆底烧瓶中,加入浓度为0.05 mol·L-1的1-丁基-3-甲基咪唑硝酸盐50%乙醇水溶液,放入超声机中,超声功率分别为60,70,80,90和100 W,料液比为1:20(g/mL),提取时间为40 min,其他按1.3.2.1节中(1)方法提取。按1.3.1.1节色谱条件进样20 μL,测定金丝桃苷的峰面积,计算金丝桃苷的提取率。
7) 提取水浴温度的选择。称取5 g黑果腺肋花楸果粉末,放入圆底烧瓶中,加入浓度为0.05 mol·L-1的1-丁基-3-甲基咪唑硝酸盐50%乙醇水溶液,放入超声机中,料液比设定为1:20(g/mL),超声功率为90 W,提取时间为40 min,提取水浴温度分别设定为30~40,40~50,50~60,60~70和70~80 ℃,其他按1.3.2.1节中(1)方法提取。按1.3.1.1节色谱条件进样20 μL,测定金丝桃苷的峰面积,计算金丝桃苷的提取率。
1.3.2.2 正交试验
根据单因素试验结果,将提取水浴温度固定为70~80 ℃,离子液体固定为1-丁基-3-甲基咪唑硝酸盐,离子液体浓度固定为0.05 mol·L-1,选择提取溶剂乙醇体积分数、料液比、提取时间、超声功率作为考察因素,按四因素三水平进行试验,因素水平表见表1。

表1 正交试验因素水平表
1.3.2.3 工艺验证性试验
称取3份黑果腺肋花楸果粉末,每份5 g,放入圆底烧瓶中,加入浓度为0.05 mol·L-1的1-丁基-3-甲基咪唑硝酸盐60%乙醇水溶液,放入超声机中,料液比为1:25(g/mL),设定水浴温度70~80 ℃、超声功率80 W、提取35 min,过滤,滤液转移到50 mL容量瓶中,60%乙醇水溶液定容,摇匀,用微孔滤膜(0.22 μm)滤过,弃去初滤液,取续滤液作为供试品溶液。按1.3.1.1节色谱条件,分别进样20 μL,测定金丝桃苷的峰面积,计算金丝桃苷的提取率。
1.3.2.4 离子液体辅助提取黑果腺肋花楸果中金丝桃苷的对比试验
称取3份黑果腺肋花楸果粉末,每份5 g,放入圆底烧瓶中,加入60%乙醇水溶液,放入超声机中,料液比为1:25(g/mL),设定水浴温度70~80 ℃、超声功率80 W、提取35 min,过滤,滤液转移到50 mL容量瓶中,60%乙醇水溶液定容,摇匀,用微孔滤膜(0.22 μm)滤过,弃去初滤液,取续滤液作为供试品溶液。按1.3.1.1节色谱条件,分别进样20 μL,测定金丝桃苷的峰面积,计算金丝桃苷的提取率。
2 结果与分析
2.1 流动相条件的选择
结果表明,适宜的流动相为乙腈-0.25%醋酸水溶液梯度洗脱,它能够将黑果腺肋花楸果提取液中的金丝桃苷与其他物质分开,保留时间适中。按照金丝桃苷峰计理论,塔板数为87 242,与相邻峰的分离度为2.53,故选择在上述流动相条件下进行相关试验。
2.2 加样回收率试验
表2显示,金丝桃苷的平均回收率为98.17%,RSD为1.89%。
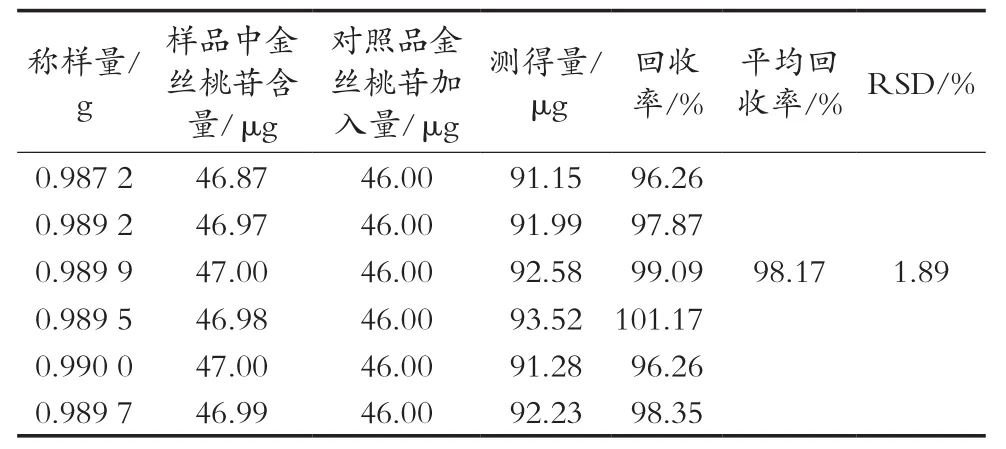
表2 回收率试验结果
2.3 离子液体超声辅助提取黑果腺肋花楸果中金丝桃苷工艺条件优化试验结果
2.3.1 单因素试验结果
2.3.1.1 离子液体类型的选择
表3显示,在5种离子液体中,1-丁基-3-甲基咪唑硝酸盐对金丝桃苷的提取效果最好,所以选择1-丁基-3-甲基咪唑硝酸盐为后续试验的离子液体。
2.3.1.2 提取溶剂的选择
由图2可知,乙醇体积分数在0~50%范围内,金丝桃苷的提取率随着乙醇体积分数的升高而增加;当乙醇体积分数达到50%时,金丝桃苷的提取率达到了最高值,继续提高乙醇体积分数,金丝桃苷的提取率逐渐下降。分析其原因可能是金丝桃苷为黄酮苷,极性较高,当提取溶剂乙醇体积分数较高时,溶剂的极性降低,其对黄酮苷金丝桃苷的溶解能力下降,提取率逐渐降低,所以选择50%乙醇水溶液为后续试验的提取溶剂。

表3 离子液体类型的选择
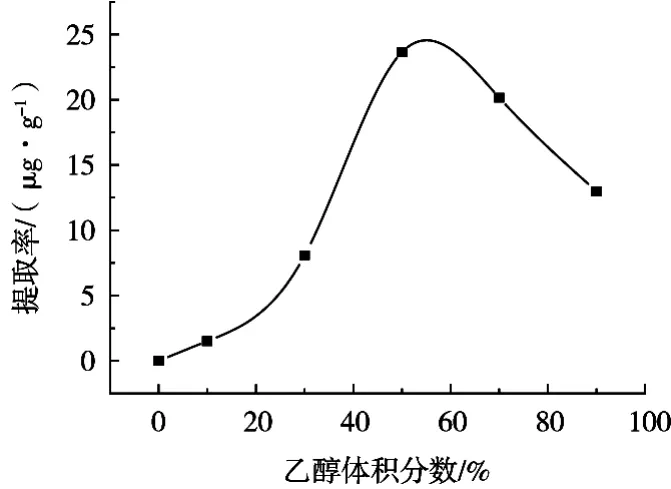
图2 乙醇体积分数对提取率的影响
2.3.1.3 离子液体浓度的选择
由图3可知,当离子液体浓度为0.05 mol·L-1时,金丝桃苷的提取率达到最高值,之后随着离子液体浓度的增加,金丝桃苷的提取率逐渐下降。分析其原因可能是随着离子液体浓度的升高,溶液的黏度增大,溶剂渗透进药材基质内的能力减小,所以提取时离子液体浓度不要太高。
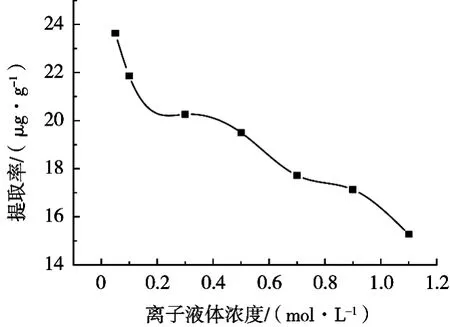
图3 离子液体浓度对提取率的影响
2.3.1.4 料液比的选择
由图4可知,随着料液比的增加,金丝桃苷的提取率逐渐升高,当料液比达到1:20(g/mL)时,金丝桃苷的提取率达到最大值。继续加大料液比,金丝桃苷的提取率缓慢下降。分析原因可能是黑果腺肋花楸果的质量固定时,在一定范围内提高提取溶剂的用量,会使黑果腺肋花楸果中的金丝桃苷更好地转移到溶剂中,所以当料液比为1:20(g/mL)时,黑果腺肋花楸果中的金丝桃苷几乎全部溶出,如果继续增大料液比,黑果腺肋花楸果中金丝桃苷的溶出变化就不明显了,所以选择1:20(g/mL)为后续试验的料液比。
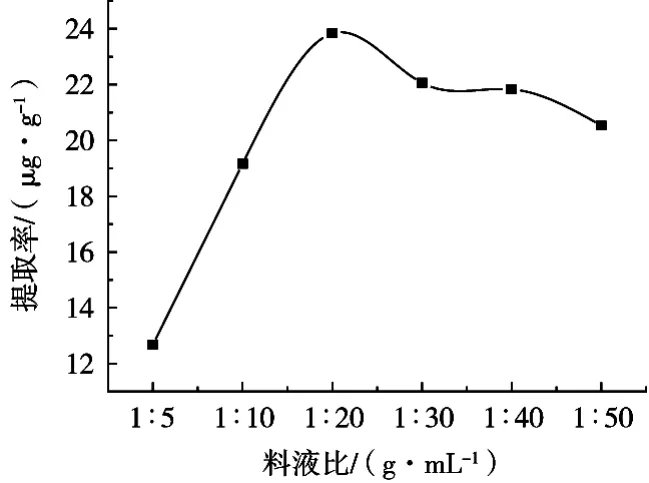
图4 料液比对提取率的影响
2.3.1.5 提取时间的选择
由图5可知,随着提取时间的不断延长,金丝桃苷的提取率不断提高,当提取时间从5 min增加到40 min时,金丝桃苷的提取率达到到最大值,当提取时间继续延长时,金丝桃苷的提取率略有下降。分析原因可能是提取时间越长,越有利于金丝桃苷的溶出,但如果提取时间过长会使杂质溶出增加,可能会对其测定有一定的影响,所以选择40 min为后续试验的提取时间。
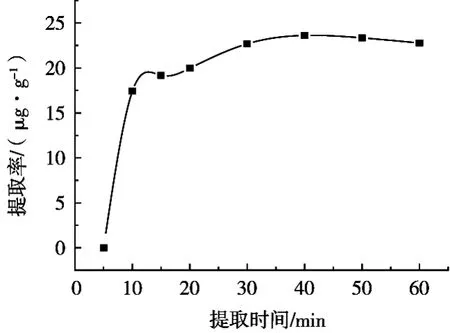
图5 提取时间对提取率的影响
2.3.1.6 超声功率的选择
由图6可知,随着超声功率的不断增加,金丝桃苷的提取率不断增加,当超声功率由60 W提高到90 W时,金丝桃苷的提取率达到最高值,继续提高超声功率,金丝桃苷的提取率略有下降。分析其原因可能是随着超声功率的提高,超声波对黑果腺肋花楸果细胞的破碎程度不断增大,从而加速了金丝桃苷的溶出,但超声功率过高,可能会对金丝桃苷的结构产生影响或可能会使杂质溶出增加,从而对其测定产生一定的影响,需要进一步研究。
2.3.1.7 提取水浴温度的选择
由图7可知,随着水浴温度的提高,金丝桃苷的提取率逐渐提高,当水浴温度达到70~80 ℃时,金丝桃苷的提取率达到最高值。分析原因可能是随着水浴温度的不断升高,提取溶剂的运动速度不断增大,当水浴温度提高到70~80 ℃时,提取溶剂处于微沸状态,此时溶剂渗透到黑果腺肋花楸果组织细胞中的能力最强,提取率最高。
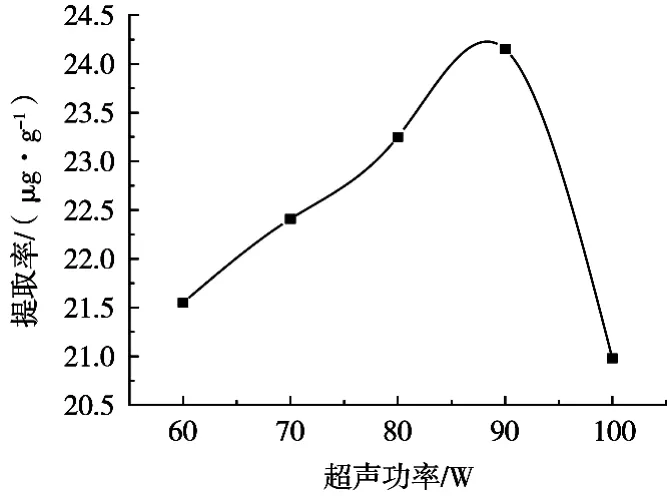
图6 超声功率对提取率的影响
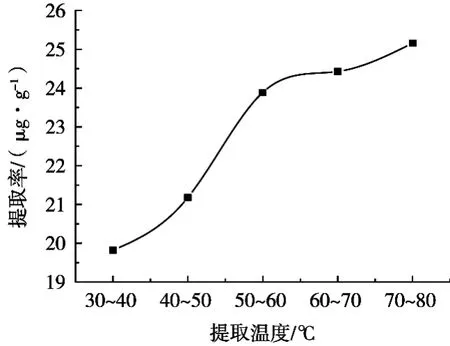
图7 提取温度对提取率的影响
2.3.2 正交试验结果
称取9份黑果腺肋花楸果粉,每份5 g,放入圆底烧瓶中,按正交试验表进行试验,将每组试验的提取水浴温度固定为70~80 ℃,离子液体浓度固定为0.05 mol·L-1,结果见表4。

表4 正交试验设计及试验结果
结果表明:离子液体超声辅助提取黑果腺肋花楸果中金丝桃苷的最优方案为A3B3C1D2,各因素的影响大小为乙醇体积分数>超声功率>料液比>提取时间,即离子液体为1-丁基-3-甲基咪唑硝酸盐,离子液体浓度为0.05 mol·L-1,料液比为1:25(g/mL),提取溶剂为60%乙醇水溶液,提取时间为35 min,提取温度为70~80 ℃,超声功率为80 W。
2.3.3 工艺稳定性验证试验
经3次验证试验,金丝桃苷的峰面积分别为158.28,165.75和168.95,平均值为164.33,其提取率分别为26.24,27.57和28.30 μg·g-1,平均值为27.37 μg·g-1,RSD为3.80%,结果表明,优选的离子液体超声辅助提取工艺比较稳定。
2.3.4 对比试验
提取体系不加入离子液体,其它操作条件与2.3.3节相同,3次试验结果中,金丝桃苷的峰面积分别为119.55,119.18和112.21,平均值为116.98,其提取率分别为19.32,19.19和17.95 μg·g-1,平均值为18.82 μg·g-1,RSD为3.98%,根据2.3.3节试验结果可知,离子液体的加入使金丝桃苷提取率提高了45.43%。
3 结论与讨论
1) 试验对黑果腺肋花楸果中金丝桃苷含量的HPLC测定方法进行了考察。结果表明,所建立的含量测定方法操作简便,精密度高,重复性及线性关系良好,金丝桃苷的平均回收率为98.17%。
2) 试验采用超声波辅助离子液体法对黑果腺肋花楸果中的金丝桃苷进行了提取,在单因素试验的基础上,通过正交试验进一步考察了提取工艺参数。结果显示,最佳提取工艺:离子液体为1-丁基-3-甲基咪唑硝酸盐,离子液体浓度为0.05 mol·L-1,料液比为1:25(g/mL),提取溶剂为60%乙醇水溶液,提取时间为35 min,提取温度为70~80 ℃,超声功率为80 W。在优化提取条件下,金丝桃苷的提取率为27.37 μg·g-1。结果表明,添加有离子液体的乙醇水溶液比纯乙醇水溶液对金丝桃苷的提取率提高了45.43%,可能是因为离子液体对植物纤维素的溶解能力较高,有利于目标成分的溶出,从而使提取率提高。该方法具有快速、高效、环保等优点,为黑果腺肋花楸果活性成分的提取提供了一种新方法。

