miR-548c-3p通过调控TRIM59表达对肝癌细胞增殖、侵袭和迁移的影响
年士艳 冯磊
肝细胞癌(简称肝癌,hepatocellular carcinoma,HCC)是全世界发病率第6高的癌症[1]。在中国,肝癌是第四大常见恶性肿瘤,致死率位居肿瘤第三位[2],严重威胁人们的生命健康。外科手术(切除、肝移植)、局部切除(消融和栓塞治疗)和放疗、全身治疗等是其主要治疗方法[3],但5年生存率仍然低于5%[4]。研究肝癌发生和发展的分子机制,为肝癌的分子诊断和治疗提供新的靶点,对临床来说尤其重要。
大量研究表明,miR-548c-3p在乳腺癌细胞[5]、胶质瘤组织和细胞[6]及骨肉瘤组织和细胞[7]中表达下调,过表达或上调miR-548c-3p可抑制肿瘤细胞的增殖、侵袭,或促进凋亡。三基序蛋白 59(tripartite motif containing 59,TRIM59)在肝癌组织[8]、骨肉瘤组织和细胞[9]中表达上调,其过表达与肝癌恶性进展和患者预后密切相关,促进骨肉瘤细胞的增殖、迁移和侵袭。TRIM59在膀胱癌组织和细胞[10]及胶质瘤细胞[11]中高表达,干扰或抑制TRIM59表达可抑制膀胱癌细胞的迁移和侵袭,降低胶质瘤细胞增殖、迁移及克隆形成能力。但miR-548c-3p在肝癌细胞中的表达及其对肝癌影响,其与TRIM59在肝癌中的关系目前还尚不明确。本课题研究miR-548c-3p影响肝癌HepG2细胞增殖、侵袭和迁移的分子机制,以及TRIM59在此机制中的作用,以期为肝癌的靶向治疗提供新的靶点。
1 材料与方法
1.1 材料
人肝癌细胞株HepG2、SMMC-7721、BEL-7402和人正常肝细胞株L02购自美国ATCC;胎牛血清(fetal bovine serum,FBS)和RPMI-1640培养基购自美国Gibco公司;牛血清白蛋白(Bovine Serun Albumin,BSA)、胰蛋白酶 Trypsin、二甲基亚矾(Dimethyl sulfoxide,DMSO)和四氮唑蓝(Thiazolyl Blue Tetrazolium Bromide,MTT)购自美国 Sigma-Aldrich公司;Transwell板购自美国Corning公司;抗TRIM59抗体、抗CyclinD1抗体、抗p21抗体、抗MMP-2抗体、抗MMP-9抗体和抗GAPDH抗体购自英国Abcam公司;引物、miR-548c-3p模拟物(miR-548c-3p)、miR-548c-3p抑制剂(anti-miR-548c-3p)、TRIM59的过表达载体(pcDNATRIM59)、TRIM59干扰物(si-TRIM59)、空载体和阴性对照(pcDNA、miR-NC、anti-miR-NC和si-NC)及双荧光载体的构建购自上海吉玛制药有限公司;双荧光素酶报告系统(Dual-Luciferase Reporter Assay System)购自美国 Promega公司;Lipofectamine 2000转染试剂、Total RNA提取试剂盒、real-time PCR试剂盒、反转录试剂盒(RT-PCR)购自美国Invitrogen公司;显微镜、发光仪、酶标仪及Real-time PCR仪购自美国Bio-Rad公司;BCA蛋白检测试剂盒购自江苏凯基生物技术股份有限公司。
1.2 方法
1.2.1 细胞培养
用含10%FBS、1%青链霉素的RPMI-1640培养基培养肝癌细胞HepG2、SMMC-7721、BEL-7402和人正常肝细胞株L02细胞。培养条件:在5%CO2培养箱中培养,温度恒定在37℃,饱和湿度。将细胞培养至对数生长期,显微镜观察,消化传代,进行后续实验。
1.2.2 细胞转染
将对数生长期HepG2稀释至1×l06个细胞/mL,接种于6孔板中,培养细胞至融合度为80%~90%时进行转染。先用无血清OptiMEM培养液稀释脂质体和各组片段及载体(包括miR-548-3p过表达组:miR-548c-3p组和miR-NC组、TRIM59抑制组:si-NC组和si-TRIM59组、miR-548-3p抑制组:anti-miR-548c-3p组和anti-miR-NC组、miR-548-3p和TRIM59同时过表达组:miR-548-3p+pcDNA组和miR-548-3p+pcDNA-TRIM59组、双荧光载体组),之后将稀释的等体积脂质体和各组载体片段轻柔混匀,室温孵育20 min,将混合液滴入到培养好的HepG2细胞中,轻柔混匀,置于37℃5%CO2培养箱培养6 h,换成RPMI-1640完全培养基,转染48 h,收集细胞,验证转染效果,进行后续实验。
1.2.3 Real-time PCR检测mRNA的表达
收集正常肝细胞和各组肝癌细胞,根据Total RNA提取试剂盒的要求提取细胞总RNA,在-80℃下保存。然后以RNA为模板按照反转录PCR试剂盒说明书合成cDNA。以cDNA为模板按照real-time PCR的说明书进行反应,反应程序为:95℃ 2 min;95℃ 30 s、60℃ 45 s、72℃ 30 s,35个循环;72℃ 10 min。运用 Bio-Rad PCR 系统,2-ΔΔCt方法进行数据分析。
1.2.4 MTT实验测定细胞活性
HepG2细胞转染48 h后,收集细胞,Trypsin消化细胞,调整细胞浓度至 1×104个/mL,2×103个/孔接种于96微孔板中,继续培养,分别在培养至24 h、48 h、72 h进行 MTT 实验,每孔加入 20 μL MTT溶液(5 mg/mL),培养4 h,弃上清培养液,再在每孔加入150 μL DMSO,室温混匀5 min,酶标仪测定OD490nm吸光度(A)值。
1.2.5 Transwell实验检测细胞迁移和侵袭
迁移实验:将转染后的各组HepG2细胞培养至对数生长期,收集细胞,加入含1%BSA的无血清RPIM-1640培养基,稀释细胞浓度为2.5×105个/mL。在 Transwell下层小室加入 500 μL含10%FBS的RPIM-1640培养基作为迁移趋化物,上层小室中加入100 μL稀释好的细胞,将上层小室放入下层小室中,置于37℃5%CO2培养箱培养24 h,用棉签拭去上层小室的细胞,冰甲醛固定迁移的细胞,结晶紫染色,显微镜观察计数。
侵袭实验:用4℃无血清培养基1∶8比例稀释Matrigel,加入上层小室,37℃3 h烘干,以下步骤同迁移实验,上层小室加入100 μL细胞,下层加入500 μL含10%FBS的RPIM-1640培养基,培养24 h,甲醛固定细胞,结晶紫染色,计数。
1.2.6 双荧光素酶报告实验
收集转染48 h的HepG2细胞,消化,稀释,以1×104个细胞/孔接种于24孔板中,继续培养24 h,当细胞融合度达到80%~90%,按照1.2.2进行转染,将构建好的TRIM59的野生型(WT-TRIM59)和突变型(MUT-TRIM59)双荧光素酶报告载体分别与miR-NC或miR-548c-3p共转染培养好的HepG2细胞,转染48 h,收集细胞,验证转染效果,用裂解缓冲液室温裂解转染的细胞20 min,离心收集上清,加入荧光素酶底物,发光仪检测荧光素酶活性。以海肾荧光素酶活性为内参照,计算萤火虫荧光素相对酶活性。
1.2.7 Western blot实验
将L02细胞和转染48 h后的各组HepG2细胞用RIPA裂解液裂解,超声破碎细胞收蛋白并检测浓度。将蛋白样本进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),转PVDF膜,5%脱脂奶粉室温封闭2 h,加入稀释的一抗,抗 TRIM59抗体(1∶1 000)、抗 CyclinD1抗体(1∶2 000)、抗 p21抗体(1∶1 500)、抗MMP-2抗体(1∶1 500)、抗MMP-9抗体(1∶2 000)和抗GAPDH抗体(1∶2 000),4℃孵育过夜。PBST洗膜2次,然后加入稀释的二抗,室温孵育1 h。以GAPDH为内参照,分析蛋白水平。
1.3 统计学处理
采用SPSS 21.0统计软件进行数据分析,数据均以平均值±标准差()表示,组间的比较采用独立样本t检验和单因素方差进行分析,以P<0.05为差异有统计学意义。
2 结果
2.1 miR-548c-3p和TRIM59在肝癌细胞和正常肝细胞中的表达
结果表明,与正常肝细胞L02相比,在肝癌细胞HepG2、SMMC-7721和BEL-7402组中TRIM59的mRNA和蛋白表达量均显著升高,差异有统计学意义(P<0.05),miR-548c-3p的表达量则均显著降低,差异有统计学意义(P<0.05),见图1和表1。TRIM59和miR-548c-3p在3个肝癌细胞株中的表达情况一致,后续实验选择HepG2细胞进行研究。
2.2 miR-548c-3p过表达可抑制肝癌HepG2细胞增殖、迁移和侵袭
与miR-NC组相比,miR-548c-3p组HepG2细胞中的miR-548c-3p表达量显著升高(P<0.05),增殖相关蛋白CyclinD1表达显著降低(P<0.05),p21显著升高(P<0.05),细胞在48 h和72 h增殖活性显著降低(P<0.05),迁移侵袭蛋白MMP-2和MMP-9表达量显著降低(P<0.05),迁移和侵袭细胞数均显著下降(P<0.05),见图2和表2。说明过表达miR-548c-3p可以抑制HepG2细胞增殖、迁移和侵袭。
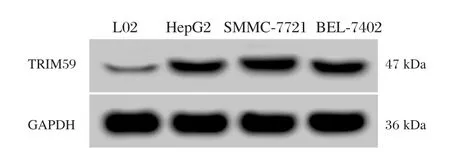
图1 TRIM59在肝癌细胞和正常肝细胞中的表达Figure1 Expression levels of TRIM59 in hepatocellular carcinoma cell lines and normal liver cells
表1 miR-548c-3p和TRIM59在肝癌细胞和正常肝细胞中的表达(±s,n=12)Table1 Expression levels of miR-548c-3p and TRIM59 in hepatocellular carcinoma cell lines and normal liver cells(±s,n=12)
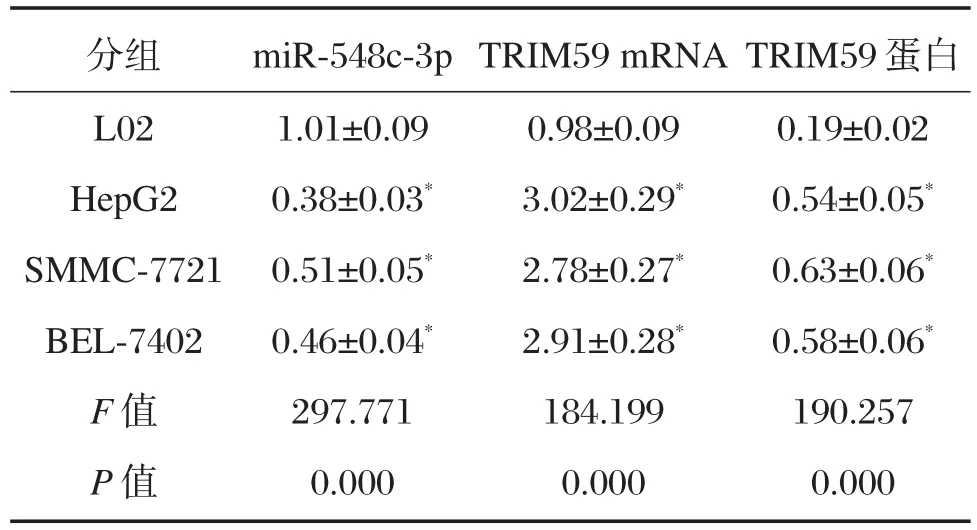
表1 miR-548c-3p和TRIM59在肝癌细胞和正常肝细胞中的表达(±s,n=12)Table1 Expression levels of miR-548c-3p and TRIM59 in hepatocellular carcinoma cell lines and normal liver cells(±s,n=12)
与L02组比较,*P<0.05
分组L02 HepG2 SMMC-7721 BEL-7402 F值P值miR-548c-3p 1.01±0.09 0.38±0.03*0.51±0.05*0.46±0.04*297.771 0.000 TRIM59 mRNA 0.98±0.09 3.02±0.29*2.78±0.27*2.91±0.28*184.199 0.000 TRIM59蛋白0.19±0.02 0.54±0.05*0.63±0.06*0.58±0.06*190.257 0.000
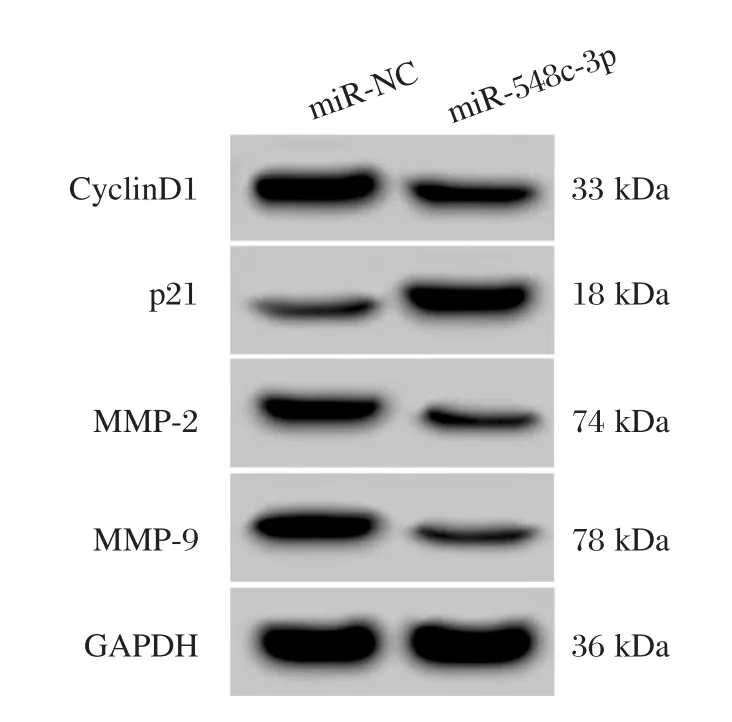
图2 增殖、迁移侵袭相关蛋白的表达Figure2 Expression of proteins related to proliferation,migration and invasion
2.3 抑制TRIM59表达可抑制肝癌HepG2细胞增殖、迁移和侵袭的影响
与si-NC组相比,si-TRIM59组HepG2细胞中TRIM59蛋白表达量显著下降(P<0.05),增殖相关蛋白CyclinD1表达显著降低(P<0.05),p21显著升高(P<0.05),细胞在48 h和72 h增殖活性显著降低(P<0.05),迁移侵袭蛋白MMP-2和MMP-9表达量显著降低(P<0.05),迁移和侵袭细胞数均显著下降(P<0.05),见图3和表3。说明抑制TRIM59可抑制HepG2细胞增殖、迁移和侵袭。
表2 miR-548c-3p过表达对肝癌HepG2细胞增殖、迁移和侵袭的影响(±s,n=6)Table2 Effects of miR-548c-3p overexpression on proliferation,migration and invasion of HepG2 cells(±s,n=6)
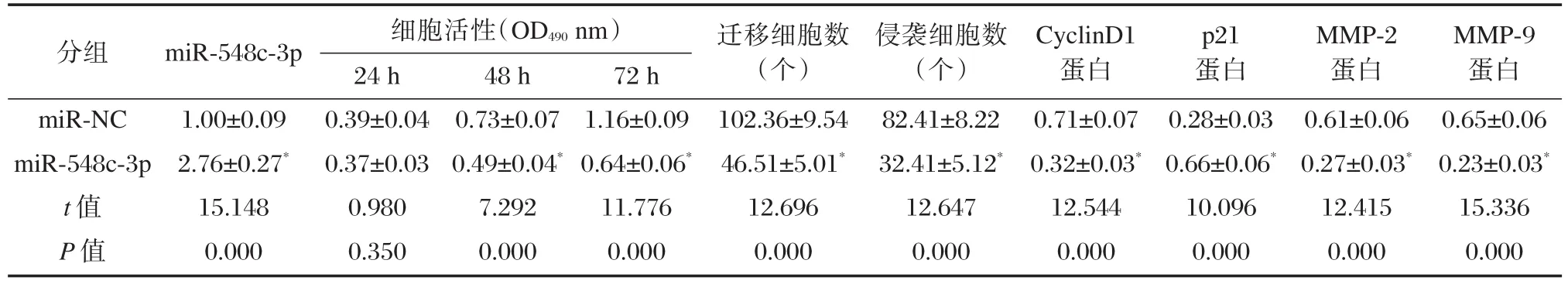
表2 miR-548c-3p过表达对肝癌HepG2细胞增殖、迁移和侵袭的影响(±s,n=6)Table2 Effects of miR-548c-3p overexpression on proliferation,migration and invasion of HepG2 cells(±s,n=6)
与miR-NC组比较,*P<0.05
分组miR-NC miR-548c-3p t值P值miR-548c-3p 1.00±0.09 2.76±0.27*15.148 0.000细胞活性(OD490nm)24 h 0.39±0.04 0.37±0.03 0.980 0.350 48 h 0.73±0.07 0.49±0.04*7.292 0.000 72 h 1.16±0.09 0.64±0.06*11.776 0.000迁移细胞数(个)102.36±9.54 46.51±5.01*12.696 0.000侵袭细胞数(个)82.41±8.22 32.41±5.12*12.647 0.000 CyclinD1蛋白0.71±0.07 0.32±0.03*12.544 0.000 p21蛋白0.28±0.03 0.66±0.06*10.096 0.000 MMP-2蛋白0.61±0.06 0.27±0.03*12.415 0.000 MMP-9蛋白0.65±0.06 0.23±0.03*15.336 0.000
2.4 miR-548c-3p靶向调控TRIM59的表达
生物信息学预测结果显示,TRIM59的3′-UTR序列中含有与miR-548c-3p互补的核苷酸序列,见图4A。双荧光素酶报告系统结果如表4所示,与miR-NC组相比,miR-548c-3p组野生型WTTRIM59的萤火虫荧光素酶相对活性显著下降(P<0.05);而突变型MUT-TRIM59的萤火虫荧光素酶相对活性没有明显变化。Western blot结果表明,与miR-NC组相比,miR-548c-3p组的TRIM59蛋白表达量显著下降(P<0.05);与 anti-miR-NC 组相比,anti-miR-548c-3p组的TRIM59蛋白表达量显著上升(P<0.05),见图4B和表5。
2.5 TRIM59过表达逆转了miR-548c-3p过表达对肝癌HepG2细胞增殖、迁移、侵袭的作用
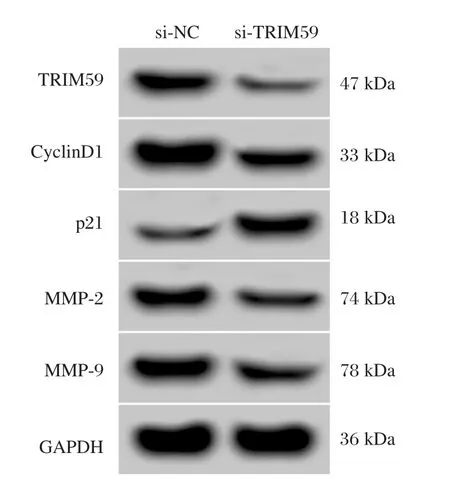
图3 TRIM59和增殖、迁移侵袭相关蛋白的表达Figure 3 Expression of TRIM59 and proteins related to proliferation,migration and invasion
与miR-NC组相比,miR-548c-3p组的TRIM59蛋白表达量显著下降(P<0.05),增殖相关蛋白CyclinD1表达显著降低(P<0.05),p21显著上升(P<0.05),HepG2细胞在48 h和72 h增殖活性显著降低(P<0.05),迁移侵袭蛋白MMP-2和MMP-9显著下降(P<0.05),迁移和侵袭细胞数均显著下降(P<0.05);与miR-548c-3p+pcDNA组相比,miR-548c-3p+pcDNA-TRIM59组TRIM59蛋白表达量显著上升(P<0.05),增殖相关蛋白CyclinD1表达显著升高(P<0.05),p21显著降低(P<0.05),HepG2细胞在48 h和72 h增殖活性显著上升(P<0.05),迁移侵袭蛋白MMP-2和MMP-9显著增多(P<0.05),迁移和侵袭细胞数均显著上升(P<0.05)。说明过表达TRIM59逆转了过表达miR-548c-3p对HepG2细胞增殖、迁移和侵袭的抑制作用。
表3 抑制TRIM59表达对肝癌HepG2细胞增殖、迁移、侵袭的影响(±s,n=6)Table3 Effect of TRIM59 inhibition on proliferation,migration and invasion of HepG2 cells(±s,n=6)
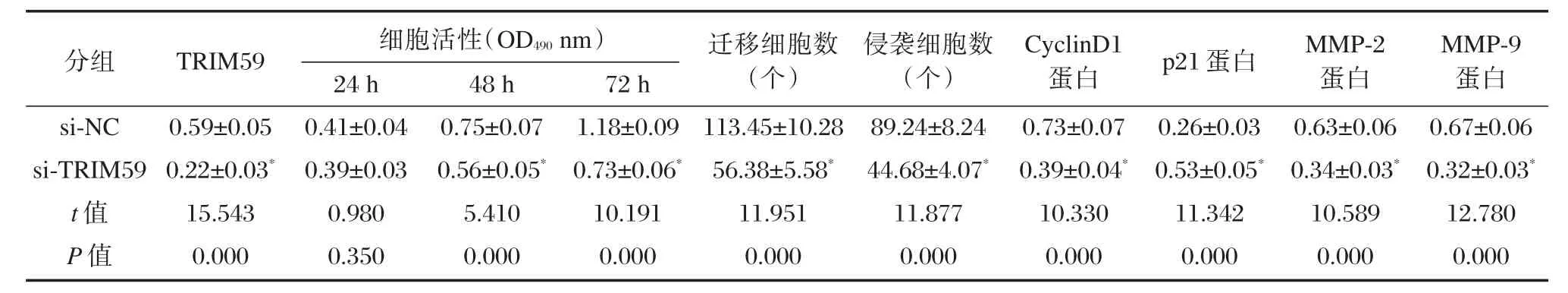
表3 抑制TRIM59表达对肝癌HepG2细胞增殖、迁移、侵袭的影响(±s,n=6)Table3 Effect of TRIM59 inhibition on proliferation,migration and invasion of HepG2 cells(±s,n=6)
与si-NC组比较,*P<0.05
分组si-NC si-TRIM59 t值P值TRIM59 0.59±0.05 0.22±0.03*15.543 0.000细胞活性(OD490nm)24 h 0.41±0.04 0.39±0.03 0.980 0.350 48 h 0.75±0.07 0.56±0.05*5.410 0.000 72 h 1.18±0.09 0.73±0.06*10.191 0.000迁移细胞数(个)113.45±10.28 56.38±5.58*11.951 0.000侵袭细胞数(个)89.24±8.24 44.68±4.07*11.877 0.000 CyclinD1蛋白0.73±0.07 0.39±0.04*10.330 0.000 p21蛋白0.26±0.03 0.53±0.05*11.342 0.000 MMP-2蛋白0.63±0.06 0.34±0.03*10.589 0.000 MMP-9蛋白0.67±0.06 0.32±0.03*12.780 0.000
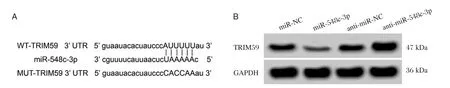
图4 miR-548c-3p靶向调控TRIM59的表达Figure4 miR-548c-3p targets and regulates the expression of TRIM59
表4 双荧光素酶报告的实验结果(±s,n=6)Table4 Dual luciferase reporter assay(±s,n=6)
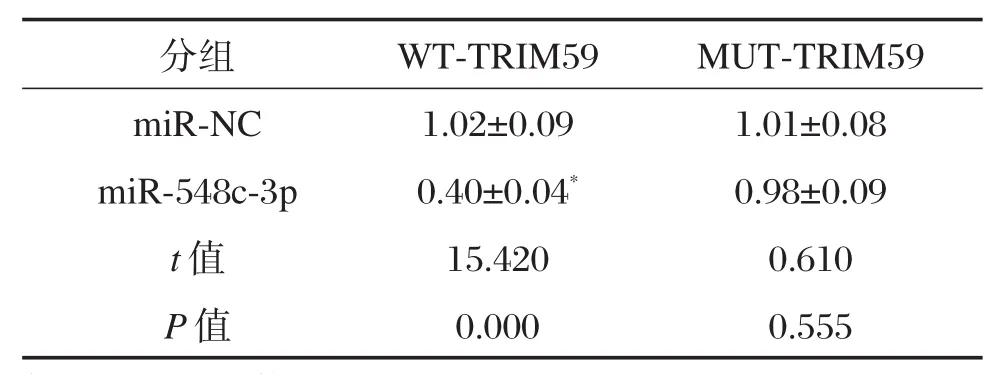
表4 双荧光素酶报告的实验结果(±s,n=6)Table4 Dual luciferase reporter assay(±s,n=6)
与miR-NC组比较,*P<0.05
分组miR-NC miR-548c-3p t值P值WT-TRIM59 1.02±0.09 0.40±0.04*15.420 0.000 MUT-TRIM59 1.01±0.08 0.98±0.09 0.610 0.555
3 讨论
尽管肝癌治疗方法有极大的改进和提高[12],中晚期患者的治疗效果仍然很差。
研究表明,miRNA参与肝癌的发生,并与肝癌的诊断、转移复发、预后及生存率评估有关[13-14]。miR-548c-5p在乳腺癌复发患者中表达显著上调,其高表达于缩短总生存期有关[15]。Chang 等[16]发现,miR-548c-3p在幽门螺杆菌阴性胃癌肿瘤组织中表达上调,与胃癌的发病机制有关。Habieb等[17]最新研究发现,miR-548-a-3p在肝癌患者中表达下调,与lncRNA-TSIX和SOGA1一起是肝癌的潜在诊断标志物,在区分肝癌患者与丙型肝炎患者和健康对照组方面显示出了很高的敏感性和特异性。miR-548c-3p在肝癌中的表达尚不清楚。本研究结果表明,与人正常肝细胞L02相比,miR-548c-3p在肝癌细胞HepG2、SMMC-7721和BEL-7402中表达均显著下调,与Habieb等研究结果类似,过表达miR-548c-3p可抑制HepG2细胞增殖、迁移和侵袭,证实了miR-548c-3p在肝癌发展中的作用。
表5 miR-548c-3p调控TRIM59的表达(±s,n=12)Table5 miR-548c-3p regulates the expression of TRIM59 in HepG2 cells(±s,n=12)
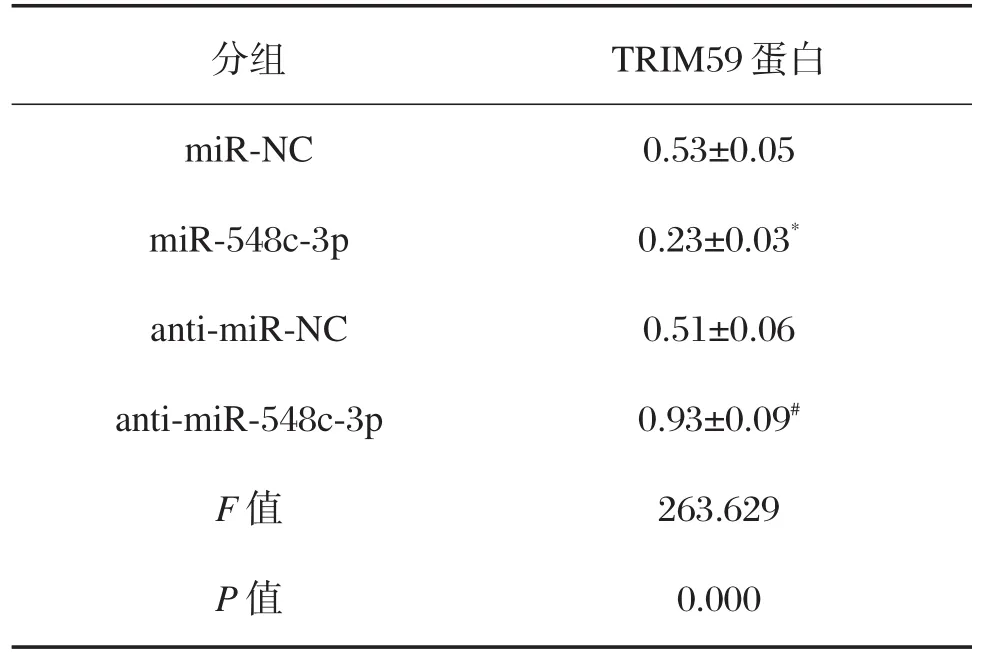
表5 miR-548c-3p调控TRIM59的表达(±s,n=12)Table5 miR-548c-3p regulates the expression of TRIM59 in HepG2 cells(±s,n=12)
与miR-NC组比较,*P<0.05;与anti-miR-NC组比较,#P<0.05
分组miR-NC miR-548c-3p anti-miR-NC anti-miR-548c-3p F值P值TRIM59蛋白0.53±0.05 0.23±0.03*0.51±0.06 0.93±0.09#263.629 0.000
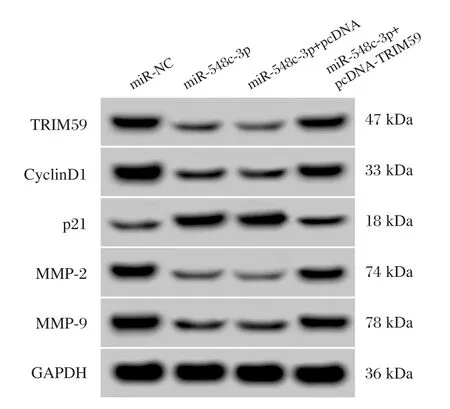
图5 TRIM59和增殖、迁移侵袭相关蛋白的表达Figure5 Expression levels of TRIM59 and proteins related to proliferation,migration and invasion in HepG2 cells
表6 TRIM59过表达逆转了miR-548c-3p过表达对肝癌HepG2细胞增殖、迁移和侵袭的作用(±s,n=12)Table6 Overexpression of TRIM59 reversed the effects of miR-548c-3p overexpression on proliferation,migration and invasion in HepG2 cells(±s,n=12)
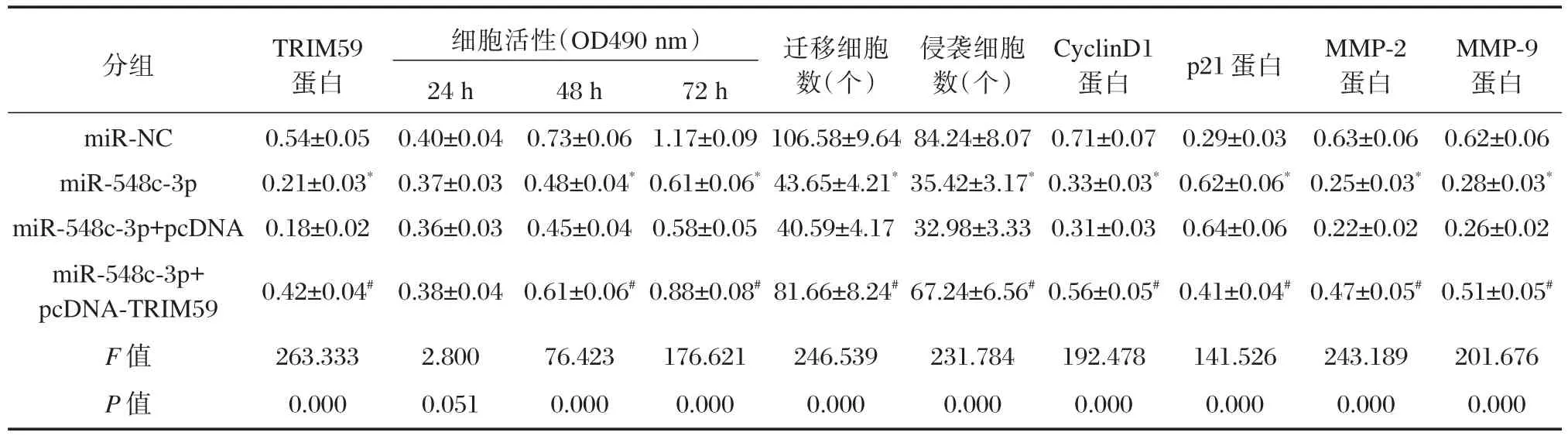
表6 TRIM59过表达逆转了miR-548c-3p过表达对肝癌HepG2细胞增殖、迁移和侵袭的作用(±s,n=12)Table6 Overexpression of TRIM59 reversed the effects of miR-548c-3p overexpression on proliferation,migration and invasion in HepG2 cells(±s,n=12)
与miR-NC组比较,*P<0.05;与miR-548c-3p+pcDNA组比较,#P<0.05
分组p21蛋白miR-NC miR-548c-3p miR-548c-3p+pcDNA miR-548c-3p+pcDNA-TRIM59 F值P值TRIM59蛋白0.54±0.05 0.21±0.03*0.18±0.02 0.42±0.04#263.333 0.000细胞活性(OD490 nm)24 h 0.40±0.04 0.37±0.03 0.36±0.03 0.38±0.04 2.800 0.051 48 h 0.73±0.06 0.48±0.04*0.45±0.04 0.61±0.06#76.423 0.000 72 h 1.17±0.09 0.61±0.06*0.58±0.05 0.88±0.08#176.621 0.000迁移细胞数(个)106.58±9.64 43.65±4.21*40.59±4.17 81.66±8.24#246.539 0.000侵袭细胞数(个)84.24±8.07 35.42±3.17*32.98±3.33 67.24±6.56#231.784 0.000 CyclinD1蛋白0.71±0.07 0.33±0.03*0.31±0.03 0.56±0.05#192.478 0.000 0.29±0.03 0.62±0.06*0.64±0.06 0.41±0.04#141.526 0.000 MMP-2蛋白0.63±0.06 0.25±0.03*0.22±0.02 0.47±0.05#243.189 0.000 MMP-9蛋白0.62±0.06 0.28±0.03*0.26±0.02 0.51±0.05#201.676 0.000
此外,生物信息学预测结果发现,TRIM59的3′-UTR序列中含有与miR-548c-3p互补的核苷酸序列,提示miR-548c-3p与TRIM59之间可能存在调控关系,假设TRIM59在肝癌中参与miR-548c-3p对肝癌的调控过程。
TRIM59是三基序家族TRIM蛋白家族成员之一,位于3号染色体上,因具有RING结构被归为泛素连接酶,在肝癌、肺癌、胃癌和结直肠癌等多种肿瘤组织中表达上调,具有致癌基因的作用[18]。Sun 等[19]研究发现,在肝癌细胞中,TRIM59表达量显著高于人正常肝细胞,敲除TRIM59可显著抑制肝癌细胞的增殖、迁移和侵袭,而过度表达TRIM59可促进癌细胞生长和转移,TRIM59的沉默降低了E-cadherin的表达,增加了N-cadherin和波形蛋白的表达,而TRIM59的过表达对上述蛋白的影响相反,p53蛋白表达水平受TRIM59调控,TRIM59可能通过p53信号通路促进HCC细胞增殖和转移,TRIM59可能是治疗肝细胞癌的潜在生物标志物和治疗靶点。本研究证实,TRIM59在肝癌细胞HepG2、SMMC-7721和BEL-7402组中mRNA和蛋白表达量均显著升高,抑制TRIM59可抑制肝癌HepG2细胞增殖、迁移和侵袭,与Sun G等研究结果一致,证实了TRIM59在肝癌发展中具有重要作用。
本研究通过Western blot和双荧光素酶报告系统结果进一步发现,miR-548c-3p靶向负调控TRIM59的表达,过表达TRIM59逆转了过表达miR-548c-3p对HepG2细胞增殖、迁移和侵袭的抑制作用,证实了在肝癌中miR-548c-3p和TRIM59之间具有调控关系。
本研究阐述了在肝癌HepG2细胞中过表达miR-548c-3p可靶向抑制TRIM59的表达,进而抑制HepG2细胞增殖、迁移和侵袭。miR-548c-3p和TRIM59有望成为肝癌诊断和治疗的分子靶点,为肝癌的诊断和治疗提供新的研究方向。
下一步将对肝癌患者血清或血浆等样本进行进一步的研究,确定miR-548c-3p和TRIM59在肝癌诊断中的价值。

