血清胱抑素C、C反应蛋白与糖尿病周围神经病变的相关性研究
周 玉,肖丽红,陈国兰,邓珊珊
(广西科技大学附属柳州市人民医院内分泌科,广西 柳州 545006)
糖尿病周围神经病变(Diabetic peripheral neuropathy, DPN)是糖尿病最常见的慢性并发症之一。新诊断的2型糖尿病(T2DM)患者中DPN发病率为7.5%[1]。有49%~92%的糖尿病患者有不同程度的DPN[2]。DPN早期诊断至关重要,目前无有效的早期诊断血清学指标。本研究选取2017年1月至2018年3月柳州市人民医院内分泌科门诊就诊及住院的糖尿病患者85例,测定DPN患者的Cys-C、CRP水平,分析Cys-C与CRP在DPN中的相关性,为诊断和防治DPN提供临床参考依据。
1 对象与方法
1.1研究对象糖尿病患者85例均符合1999年WHO糖尿病诊断标准。根据2017年版《中国2型糖尿病防治指南》诊断标准将研究对象分为2型糖尿病无周围神经病变组(NDPN)40例,其中男19例,女21例;年龄(54.9±11.9)岁;病程(5.9±2.0)年。糖尿病周围神经病变组(DPN)45例,其中男23例,女22例;年龄(55.6±12.4)岁;病程(8.7±3.4)年。门诊选取健康体检者30例为对照组(C),男16例,女14例;年龄(53.3±13.7)岁。以上各组间性别、年龄差异无统计学意义(P>0.05),具有可比性。
DPN诊断标准:(1)明确的糖尿病病史,诊断糖尿病时或之后出现的神经病变;(2)有临床症状(疼痛、麻木、感觉异常等)和体征与DPN表现相符;(3)有临床症状者,5项检查(踝反射、针刺痛觉、震动觉、压力觉、温度觉)中任1项异常;无临床症状,5项检查中任2项异常[3]。所有糖尿病患者均由糖尿病专科主治医师做多伦多临床评分(TCSS)以筛查有疑问的DPN,TCSS诊断DPN的截断点:TCSS≥6分。
排除以下疾病:糖尿病急性并发症、急慢性炎性疾病、急慢性肝胆疾病、其他原因导致的肾病及估算肾小球滤过率(GFP)<60 mL/(min×1.73m2)者、患严重心脑血管疾病及周围血管疾病者、患其他影响神经传导疾病者、甲状腺功能异常者、恶性肿瘤及妊娠。本研究方案经研究对象知情同意,均通过我院医学伦理委员会批准。
1.2研究方法临床指标检测,详细询问及记录研究对象性别、年龄、糖尿病病程和吸烟、饮酒史。测量身高、体重、血压,计算BMI。采用罗氏Cobas 8000生化检测仪检测Cys-C、CRP、胆固醇(TC)及甘油三酯(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、血肌酐(Scr)。糖化血红蛋白(HbA1C)测定采用高效液相色谱法,所用仪器为HA-8180全自动生化分析仪。肌酐清除率(Ccr)=(140-年龄)×体重(kg)/[72×Scr(mg·dL-1)],血肌酐的单位换算:1 mg·dL-1=88.41 μmol·L-1。

2 结 果
2.1各组一般资料及生化指标比较NDPN、DPN组HbA1c、TC、LDL-C和SBP、DBP高于对照组(P<0.05或P<0.01)。DPN组病程、Ccr高于NDPN组(P<0.05)。DPN组血清Cys-C、CRP高于对照组及NDPN组(P<0.01), NDPN组Cys-C、CRP水平与对照组比较,差异无统计学意义(P>0.05)。见表1。
表1 各组一般资料及生化指标比较
注:与C组比较,*P<0.05,#P<0.01; 与NDPN组比较,△P<0.05,☆P<0.01。
2.2T2DM合并DPN患者危险因素的Logistic多元逐步回归分析以是否合并DPN为因变量,以年龄、病程、BMI、SBP、DBP、HbA1c、TC、TG、HDL-C、LDL-C、Scr、Ccr、Cys-C、CRP为自变量,行Logistic多元逐步回归分析显示,血清Cys-C、CRP、HbA1c为影响T2DM患者DPN的独立危险因素(OR=2.42,95%CI1.88 ~3.22;OR=1.90,95%CI1.66 ~2.67;OR=1.32,95%CI1.02 ~2.03)。见表2。
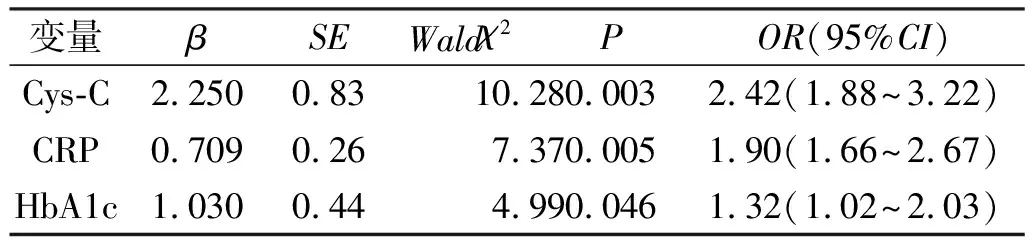
表2 DNP危险因素的Logistic多元逐步回归分析
3 讨 论
DPN是糖尿病常见的慢性微血管并发症之一,也是导致糖尿病足的重要原因。其发病机制尚未完全阐明,目前考虑其主要与代谢途径异常学说、微血管病变学说、神经递质学说和生长因子缺乏等有关[4-5]。
Cys-C即半胱氨酸蛋白酶抑制蛋白C,Cys-C是目前公认的早期判断肾小球滤过功能损害的敏感指标。DPN与糖尿病肾病同属于糖尿病微血管病变,两者之间相互作用、影响。有学者认为[6],其降解产物可激活中性粒细胞,介导炎症反应,因此高水平的CysC-C可引起炎症反应,升高CRP,高浓度CRP可损伤血管内皮细胞,导致微血管病变形成。近期有多项研究关于CysC-C与糖尿病周围神经病变的关系。Yanyun Hu等[7]对937例糖尿病和DPN患者研究,显示DPN患者CysC水平[1.1(0.9~1.3)mg·L-1,P<0.001]高于非DPN患者[1.0(0.9~1.3)mg·L-1,P<0.001],血清CysC的最佳截点DPN在男性患者中为1.25 mg·L-1,在女性患者中为1.05 mg·L-1。高血清CysC水平提示DPN发生风险增加一倍。陈兰英等[8]对219例糖尿病和糖尿病神经病变患者研究,提示DPN 组血清CysC-C水平(0.70±0.26) mg·L-1高于正常对照组(0.53±0.07) mg·L-1及2型糖尿病组的CysC-C水平(0.54±0.21) mg·L-1。这和我们的研究结果是相符的,通过危险因素的多元逐步回归分析,提示血清Cys-C为影响T2DM患者DPN的独立危险因素。因此在肾小球滤过率相似的情况下,随着血清CysC-C水平升高,可能是增加糖尿病患者DPN风险。
CyS-C有可能通过氧化应激、炎症反应等造成对微血管的特异性损害,促进DPN的发生与发展。CRP是肝脏合成的急性时相反应蛋白,是炎性反应或组织损伤时的非特异性标志物,其不仅是炎症标志物,本身也直接参与炎症过程。CRP导致糖尿病神经病变的机制考虑与以下三方面有关:(1)CRP主要受TNF-α等炎症源性细胞因子调控,可刺激血管内皮因子释放,使微血管基膜增厚,从而导致神经组织的血液供应减少,逐步缺血,甚至坏死。而由于微循环障碍导致周围神经、自主神经及神经元和髓鞘的损害,引起神经传导阻滞,从而出现一系列的各种神经损害的症状。(2)CRP与DNP发病机制关系,考虑与DPN发病机制之一的多元醇通路与糖基化终末的形成有关,糖基化终末产物的特征性受体糖基化终末产物受体(RAGE),其广泛存在于炎症细胞、肾小球上皮细胞、中枢、周围神经系统的神经细胞等各类细胞。在正常组织中,RAGE为低水平表达,在糖尿病、心血管疾病、炎症、神经退行性病变时,可表现为高水平。糖基化终末产物和RAGE结合后,可激活下游的细胞内信号转导通路,最终引起氧化应激和炎症反应[9-10]。(3)CRP有免疫调节功能,可以增强白细胞反应性增生,激活补体,并参与细胞凋亡。动物实验证实炎症反应可能是导致DPN的危险因素[11]。通过本研究提示,在DPN组血清CRP高于对照组及NDPN组,差异有统计学意义,据DPN发病机制及回归分析提示CRP为影响T2DM患者DPN的独立危险因素。
目前研究普遍认为,DPN的危险因素与病程、血糖控制不佳有关。然而,本研究中病程与DPN的发生无关,考虑与本研究中所选择病例的病程相对较短有关,另外本研究为横断面研究,也可能会影响病程的精确性。DPN与CysC-C、CRP关系的原因,还需大样本及前瞻性研究,以进一步明确。
综上所述,该研究提示检测DPN患者血清CysC-C和与CRP水平较IGT、NDPN升高,临床研究糖尿病患者检测血清CysC-C和与CRP水平,有可能可以作为临床预测诊断糖尿病周围神经病变的血清学指标,也可以为糖尿病周围神经病变发生机制提供线索。尽早予以DPN干预治疗,防止DPN因外伤、感染等原因导致糖尿病足而致残或致死。

