亚临床甲状腺功能减退症与2型糖尿病肾功能损伤的相关性研究
王珊珊 俞冰鸿 傅雯雯 杨艳辉 孔岩 王靖宇 常宝成 郑妙艳 杨菊红 王颖 许杰 单春艳
天津医科大学朱宪彝纪念医院肾内科,国家卫生健康委员会激素与发育重点实验室(天津医科大学),天津市代谢性疾病重点实验室,天津医科大学朱宪彝纪念医院&天津市内分泌研究所 300134
糖尿病和甲状腺疾病是内分泌系统常见的疾病,二者为复杂且相互作用的关系。甲状腺激素(TH)直接影响体内三大营养物质的代谢,参与血糖及胰岛功能的调节。糖尿病肾脏疾病(DKD)是糖尿病一个主要的微血管并发症,现已成为慢性肾脏疾病的主要病因,未来有可能成为终末期肾病(ESRD)的首要病因[1-2]。研究发现,TH可直接影响肾脏生长和发育、肾小球滤过率(GFR)、肾脏转运系统、钠水的体内平衡。TH的微小变化即可诱导血清促甲状腺激素(TSH)水平呈指数变化,而TSH是甲状腺功能最敏感、最特异的生化指标。亚临床甲状腺功能减退症(SCH)通常缺乏明显的临床症状和体征,在生化上被定义为TSH水平升高而血清FT4、TT4水平正常[3]。早期,临床医生关注SCH主要因其增加心血管疾病的风险及全因死亡率[4]。近10年来,SCH与DKD的相关研究越来越多,但目前对TSH的参考范围上限不统一,DKD的诊断缺乏特异性的标准和指标,研究结果异质性较大。故本研究回顾性分析了2型糖尿病(T2DM)患者中不同TSH水平与肾功能损伤的相关性。
1 对象与方法
1.1 对象 收集2017年9月至2018年8月在天津医科大学代谢病医院住院的T2DM(WHO 1999年标准)患者656例,其中男415例,女241例,年龄(56.09±11.64)岁,病程(10.67±7.55)年,体重指数(26.80±3.99) kg/m2。排除标准:(1)除T2DM外的其他类型糖尿病。(2)合并糖尿病酮症酸中毒、高渗高血糖昏迷等糖尿病急性并发症。(3)急性泌尿系统感染及其他疾病所致的急、慢性肾脏疾病。(4)严重心、肺、肝功能疾病及其他系统的严重疾病。(5)恶性肿瘤。(6)自身免疫性疾病。(7)影响代谢功能的慢性疾病,包括下丘脑、垂体、肾上腺疾病。(8)既往及新发的甲状腺功能亢进症、甲状腺功能减退症、亚临床甲状腺功能亢进症及曾行甲状腺手术、131I治疗、口服甲状腺素或抗甲状腺药物的患者。(9)长期服用胺碘酮、锂盐、抗癫痫药物、利福平药物患者。(10)妊娠或哺乳期妇女。(11)资料不全的患者。诊断标准:(1)T2DM诊断标准:空腹静脉血浆血糖≥7.0 mmol/L或口服葡萄糖耐量试验2 h静脉血浆血糖≥11.1 mmol/L。(2)DKD诊断标准:以持续性白蛋白尿[尿白蛋白排泄率(UAER)≥30 mg/24 h;尿白蛋白与肌酐比值(UACR)≥3 mg/mmol或30 mg/g]或GFR进行性下降≤60 ml·min-1·(1.73 m2)-1超过3个月,同时排除高血糖以外其他原因引起的慢性肾脏病。(3)SCH诊断标准:TSH水平升高而TT4、FT4水平正常,其中TSH>4.2 mIU/L为诊断切点[3]。本研究经医院伦理委员会批准,且所有患者均签署知情同意书。
1.2 方法 (1)检测指标及方法:研究对象在空腹状态下测量身高、体重、腰围、臀围。计算体重指数。患者平静休息至少15 min后采用台式血压计测定血压。所有研究对象生化数据来自天津医科大学代谢病医院检验学中心。研究对象晚餐后禁食至少8 h,次日空腹取静脉血。采用全自动生化分析仪测定肝肾功能、血脂等生化指标,高效液相法测定糖化血红蛋白。甲状腺功能指标测定:采用化学发光法测定,正常参考值:TSH:0.27~4.20 mIU/L,FT4:12.0~22.0 pmol/L,FT3:3.15~6.80 pmol/L,甲状腺过氧化物酶抗体(TPOAb):0~34 IU/ml。晨尿测定:研究对象血糖控制平稳后晨起空腹留取中段尿,采用免疫透射比法、生化法、ELISA法测定。24 h尿定量测定:研究对象血糖平稳后留取当日7:00至次日7:00的24 h尿液,留尿前避免剧烈运动,适量饮水,采用免疫散射比浊法检测尿液白蛋白,采用酶法检测尿肌酐,正常参考值:UAER:0~20 mg/24 h、尿肌酐:8.84~13.30 mmol/24 h。尿白蛋白排泄异常:UAER≥30 mg/24 h,大量白蛋白尿:UAER>300 mg/24 h。估算的GFR(eGFR)计算:采用慢性肾脏病流行病学合作组(CKD-EPI)公式计算。(2)分组标准:按照是否合并DKD分为两组:非DKD组(425例,男262例,女163例);DKD组(231例,男153例,女78例)。按照TSH水平分为3组:TSH正常低值组(383例,男261例,女122例):TSH<2.5 mIU/L;TSH正常高值组(199例,男119例,女80例):2.5 mIU/L≤TSH≤4.2 mIU/L;SCH组(74例,男35例,女39例):TSH>4.2 mIU/L。

2 结果
2.1 患者一般资料比较 非DKD组与DKD组间女性患者比例、谷丙转氨酶、谷草转氨酶、HbA1c、空腹静脉血糖、低密度脂蛋白-胆固醇、TPOAb阳性率差异均无统计学意义。与非DKD组相比,DKD组血尿酸、年龄、病程、体重指数、收缩压、舒张压、高血压患病率、甘油三酯、总胆固醇、糖尿病视网膜病变及大量白蛋白尿患病率、24 h尿蛋白定量、TSH水平、SCH患病率均升高,血清白蛋白、eGFR降低、FT3及FT4水平均降低(P均<0.05),见表1。不同TSH水平患者间谷丙转氨酶、谷草转氨酶、血尿酸、舒张压、高血压患病率、HbA1c、空腹静脉血糖、甘油三酯、总胆固醇、低密度脂蛋白-胆固醇差异均无统计学意义。与TSH正常低值组、TSH正常高值组相比,SCH组女性患者比例、体重指数、24 h尿蛋白定量、TSH、TPOAb阳性率、大量白蛋白尿及DKD患病率均升高,eGFR、FT4水平均降低(P均<0.05)。与TSH正常低值组相比,SCH组年龄、病程、收缩压、血清白蛋白、糖尿病视网膜病变患病率均升高(P均<0.05)。与TSH正常低值组相比,正常高值组各指标差异均无统计学意义,见表2。

表2 3组不同TSH水平患者临床特征比较中位数(四分位数)]

注:ALB:血清白蛋白;ALT:谷丙转氨酶;AST:谷草转氨酶;eGFR:估算的肾小球滤过率;UA:血尿酸;BMI:体重指数;SBP:收缩压;DBP:舒缩压;HBP:高血压;FPG:空腹血糖;TG:甘油三酯;TC:总胆固醇;LDL-C:低密度脂蛋白-胆固醇;DKD:糖尿病肾脏疾病;DR:糖尿病视网膜病变;TSH:促甲状腺激素;TPOAb:甲状腺过氧化物酶抗体;U-Pro:尿蛋白;与TSH正常低值组相比,aP<0.05;与TSH正常高值组相比,bP<0.05;1 mmHg=0.133 kPa
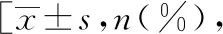
表1 非DKD组与DKD组患者的一般资料中位数(四分位数)]
2.2 不同TSH水平与DKD的logistic回归分析 以不同TSH水平为自变量,DKD为因变量进行logistic回归分析,结果显示:校正年龄、性别、病程、体重指数、HbA1c、甘油三酯、总胆固醇、高血压后(Mode2),SCH与DKD呈正相关。以SCH为自变量,DKD为因变量进行logistic回归分析,结果显示,无论是否校正危险因素,SCH与DKD均相关,见表3、4。

表3 不同TSH水平与DKD的logistic回归分析

表4 SCH与DKD的logistic回归分析
3 讨论
近来一项荟萃分析显示,T2DM合并SCH的患病率为10.2%,T2DM患者SCH的危险性增加1.93倍(95%CI: 1.66~2.24)[5]。Díez等[6]研究显示,T2DM患者SCH的患病率8.5%,其中女性10.4%,男性5.8%。本研究中,T2DM患者SCH的患病率为11.3%(74/656)。女性患者SCH的患病率(16.1%,39/241)明显高于男性(8.4%,35/415),性别相关的差异可能与性激素导致下丘脑-垂体-甲状腺轴异常,使T4向T3转换异常,TT3、FT3水平下降及rT3水平升高等有关[7]。
甲状腺功能异常和糖尿病微血管病变的相关性越来越受到关注,但相关的研究结果不一。TSH的参考范围上限不统一是造成研究结果不一致的原因之一。我国以TSH>4.2 mIU/L为SCH的诊断切点,而美国国家临床生物化学研究院发布的实验室指南显示,95%以上的正常人TSH水平低于2.5 mIU/L,而TSH超过2.5 mIU/L的这类人群,大多数可能是桥本甲状腺炎或其他具有临床意义的原因所致[8]。因此,有学者提出应该将TSH参考范围的上限定义为<2.5 mIU/L[9]。Qi等[10]研究发现,TSH 2.5~4.2 mIU/L可增加DKD的患病风险。但韩国学者Kim等[11]研究表明,SCH与重度糖尿病视网膜病变(DR)独立相关,而与DKD无关。TSH正常上限值是否应该下调?本研究将TSH正常值组以2.5 mIU/L为切点,进一步分组比较,研究结果显示,与TSH正常低值组相比,TSH正常高值组各指标差异均无统计学意义。随着TSH水平的升高,DKD的患病率逐渐升高,SCH增加DKD的发病风险,调整年龄、性别、病程、体重指数、HbA1c、甘油三酯、总胆固醇、高血压后,其风险仍然增加(OR=2.187,95%CI:1.244~3.847),但TSH在正常高值时(2.5~4.2 mIU/L)与DKD患病风险增加无关。研究结果与Zou等[12]的一致。
Yasuda等[13]研究发现,与甲状腺功能正常者相比,SCH患者UACR水平升高,TSH是T2DM患者白蛋白尿的独立危险因素。SCH与DKD相关的机制可能为:SCH引起心排血量减少及肾内血管收缩,导致肾血流量减少、GFR下降[14]。SCH引起血脂代谢紊乱、凝血及纤溶系统异常,加速动脉粥样硬化,累及肾血管,最终导致肾缺血、DKD进展[15]。SCH时可导致内皮型一氧化氮合酶活性下降,引起血浆一氧化氮含量下降而出现内皮功能障碍[16]。系统性内皮功能紊乱是DKD的致病机制之一。SCH患者体内氧化-抗氧化系统失衡,氧化应激产物堆积,通过激活蛋白激酶C、多元醇代谢通路及晚期糖基化终末产物的形成,促进DKD的发生与进展[17]。另外,SCH患者伴有慢性低度炎性反应,血清肿瘤坏死因子-α、白细胞介素-6、C反应蛋白水平升高。慢性低度炎性反应使内皮通透性增加,血管舒缩功能异常,同时可以促进系膜细胞增生及细胞外基质产生异常、诱导细胞凋亡和坏死,在DKD发病和发展发挥作用[18-19]。SCH常伴有胰岛素抵抗,而胰岛素抵抗可以增加肾毛细血管的静水压和通透性,从而在早期DKD的发病机制中起作用[20-21]。研究显示,甲状腺自身抗体特别是TPOAb的滴度与SCH的发生及进展相关[22-23]。本研究中SCH组TPOAb的阳性率明显高于TSH正常值组(23.0%比5.7%)。肾脏和甲状腺自身免疫来源相关,甲状腺自身抗体、甲状腺球蛋白及其相关的免疫复合物可沉积在肾小球基底膜,从而引起肾脏的损伤[24]。肾小球基底膜最初的改变,可能对邻近的足细胞、内皮细胞、系膜细胞产生了功能上的重要影响,从而影响肾小球滤过[25]。
当然,本研究也存在一些缺陷。首先,本研究是一个单中心、横断面研究,存在一定的选择偏移,且无法证明SCH与DKD之间的因果关系。其次,仅用1次甲状腺功能测定的结果定义SCH,无法排除SCH的短暂升高,说明SCH与DKD关系的复杂性。总之,T2DM患者SCH与DKD、肾功能损伤密切相关。

