腹部脂肪分布对2型糖尿病患者人体成分及胰岛功能的影响
赵楠 许杰 李晓晨 穆标 常宝成
国家卫生健康委员会激素与发育重点实验室(天津医科大学),天津市代谢性疾病重点实验室,天津医科大学朱宪彝纪念医院&天津市内分泌研究所 300134
2型糖尿病(T2DM)、非酒精性脂肪性肝病(NAFLD)及肥胖的患病率逐年上升[1]。NAFLD是代谢综合征在肝脏的表现,其特征是肝细胞脂肪变性。
人体成分分布的改变,尤其是脂肪组织增多与非脂肪肝组织的相对减少,如肌少症,可导致多种疾病状况,如糖耐量减低、胰岛素抵抗、高脂血症、冠心病等。生物电阻抗分析法利用人体内脂肪组织、非脂肪组织、细胞内外水分等不同成分的导电性差异,测定人体成分含量[2]。以其操作简便、安全、无痛、经济的特点得到广泛的研究和应用,可准确地将指标量化[3]。已有文献证实,生物电阻抗分析法与双能X线及MRI扫描测得的内脏脂肪面积具有较强的相关性[4]。虽然此项检查广泛用于正常以及肥胖人群,在特殊人群应用的研究却比较有限。本研究创新性的运用生物电阻抗分析法对T2DM伴NAFLD患者进行人体成分分析,了解其与T2DM非NAFLD患者人体成分含量、构成比特点、生化指标及胰岛功能的差异,并通过内脏脂肪面积进一步划分为腹型肥胖组与非腹型肥胖组,探讨脂肪肝与腹型肥胖对T2DM患者胰岛功能的影响。
1 对象与方法
1.1 研究对象 选取2017年1月—2019年1月在天津医科大学朱宪彝纪念医院住院治疗的T2DM患者,排除标准:酒精性(每日饮酒量男>40 g、女>20 g)、病毒性、药物性、自身免疫性肝炎患者;严重感染、恶性肿瘤、甲状腺功能异常等患者。最终纳入患者519例,其中男性304例,女性215例,平均年龄(53.52±11.08)岁,糖尿病病程(9.01±6.65)年。根据有无脂肪肝以及是否合并腹型肥胖分为4组,组1:T2DM+NAFLD伴腹型肥胖组242例,组2:T2DM+NAFLD无腹型肥胖组59例,组3:T2DM无NAFLD伴腹型肥胖组101例,组4:T2DM无NAFLD无腹型肥胖组117例。所有患者均采用口服降糖药物或胰岛素治疗。T2DM诊断标准依据1999年WHO制订的诊断标准;NAFLD的超声诊断及病因判断参照中华医学会肝病学分会脂肪肝和酒精性脂肪肝病学组2010年修订的酒精性肝病和NAFLD诊断标准[5]。
1.2 研究方法 (1)所有患者行腹部超声检查,询问病史、家族史及个人史。禁食、水12 h,于次日清晨测量身高、体重、腰臀围。抽取静脉血检测血常规、糖化血红蛋白、血脂、肝功能、肾功能、凝血功能、C反应蛋白,用酶联免疫吸附法测定空腹及口服75 g葡萄糖耐量试验后30 min、60 min、120 min、180 min血糖、胰岛素分泌及C肽分泌水平;用稳态模型评估-胰岛素抵抗指数(HOMA-IR)评价胰岛素抵抗,以稳态模型评估-β细胞功能指数反映基础胰岛素的分泌。计算胰岛素敏感性指数(ISI);计算葡萄糖、胰岛素、C肽曲线下面积[AUC=0.5×(空腹值+180 min值)+60 min值+120 min值]。(2)采用生物电阻抗分析法测定人体成分,仪器品牌Jawon。受试者宜空腹,测试前停止剧烈活动,穿着轻便服装,脱掉鞋袜,双脚踩在足形电极上,握住手柄1~2 min完成测试。测试结果包括体重、体重指数、腰臀比、脂肪百分比、内脏脂肪面积、内脏脂肪含量、腹部皮下脂肪含量、骨骼肌含量、蛋白质含量、矿物质含量。

2 结果
2.1 一般资料及人体成分分布特征指标比较 4组患者间病程、年龄差异无统计学意义(P均>0.05);组1人体成分指标矿物质含量、蛋白质含量、身体总水分、体重指数大于组4(P均<0.05);组1~组4脂肪百分比组间逐渐下降(P<0.05);组2骨骼肌含量高于组1(P<0.05),见表1。

表1 4组患者一般资料、人体成分分布特征指标比较
2.2 临床生物化学指标比较 组1~组4白细胞、C反应蛋白、总蛋白、γ-谷氨酰转肽酶、谷丙转氨酶、谷草转氨酶、估算的肾小球滤过率、血尿酸、甘油三酯、低密度脂蛋白-胆固醇、极低密度脂蛋白-胆固醇(VLDL-C)、血红蛋白呈下降趋势,高密度脂蛋白-胆固醇(HDL-C)呈上升趋势,其中组1与组4差异有统计学意义(P<0.05)。其余指标差异无统计学意义(P>0.05),或组间无规律变化趋势,见表2。

表2 4组患者临床生物化学指标比较中位数(四分位数)]
2.3 胰岛功能指标比较 组1~组4胰岛素分泌水平、C肽分泌水平(0 min、30 min、60 min、120 min、180 min)、HOMA-IR、HOMA-β、ISI、葡萄糖负荷后胰岛素曲线下面积、C肽曲线下面积呈下降趋势,其中组1与组4差异有统计学意义(P<0.05),见表3。

表3 4组患者胰岛功能指标比较中位数(四分位数)]
2.4 相关分析 校正年龄、性别后,内脏脂肪面积与体重指数、腰臀比、内脏脂肪含量、皮下脂肪含量、基础代谢量、γ-谷氨酰转肽酶、谷丙转氨酶、谷草转氨酶、血尿酸呈正相关,与HDL-C呈负相关(P均<0.05),见表4。

表4 内脏脂肪面积及相关指标的相关性
2.5 二元logistic回归分析 内脏脂肪含量、VLDL-C为T2DM患者NAFLD的独立危险因素,见表5。
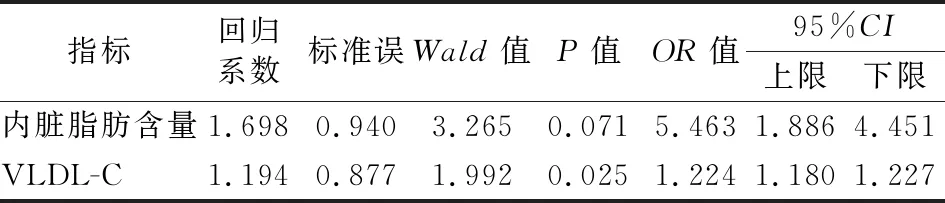
表5 2型糖尿病患NAFLD的独立危险因素
3 讨论
近几年来有学者通过双能X线、CT等定量测定内脏脂肪面积来评价胰岛功能,从而更准确地研究腹型肥胖(又称内脏肥胖、中心性肥胖、向心性肥胖)与糖代谢、胰岛素抵抗的关系[6]。本研究创新的将人体成分分析应用在T2DM患者中,并将人体成分对胰岛功能的影响进行细化分析,提出T2DM+NAFLD伴腹型肥胖患者会出现明显的胰岛功能异常,罕见于其他研究。
T2DM+NAFLD患者的人体成分与非NAFLD有区别,特别是脂肪的量和分布[7]。当成年男性脂肪百分比>25%,女性>30%时,即为肥胖[8]。本研究中T2DM+NAFLD组(组1+组2)比非NAFLD组(组3+组4)有较高的肥胖率(82.3%比31.6%,χ2=102.930,P<0.05),同时并不是所有脂肪肝患者都有肥胖,也并不是所有肥胖患者都发生脂肪肝[9]。
既往大量报道提出NAFLD患者的胰岛素抵抗明显,且胰岛β细胞功能代偿性升高,但并未将腹型肥胖同时导致的影响考虑其中[10-11]。因此笔者进行了细化分组,创新性地将T2DM+NAFLD组及非NAFLD组根据内脏脂肪面积的大小,即男性>100 cm2,女性>80 cm2,进一步分为:T2DM+NAFLD伴腹型肥胖组(组1)、T2DM+NAFLD无腹型肥胖组(组2),T2DM非脂肪肝腹型肥胖组(组3),以及T2DM非脂肪肝非腹型肥胖组(组4)。
组1中242例患者伴有腹型肥胖,他们的脂肪不仅分布在肝脏,同时也分布于胰腺、阑尾等其他实质脏器,以及大网膜与肠系膜。胰腺周围的脂肪沉积可造成胰岛素第一分泌时相延迟,产生胰岛素抵抗。另有59例患者为非腹型肥胖。经统计,NAFLD中的非腹型肥胖者(组2),骨骼肌含量超过与其年龄、体重和体重指数匹配的腹型肥胖者(组1),提示加强体育锻炼,增强运动耐力,增加骨骼肌含量,有助于改善腹型肥胖[12]。有研究结果提示,内脏脂肪增加伴有高胰岛素血症,与胰岛素抵抗密切相关,并出现血压、血脂、尿酸、脂肪酸、胰岛素等多项代谢指标异常[13]。本研究与此研究结果基本吻合。内脏脂肪面积与胰岛素介导的葡萄糖利用率密切相关[14]。内脏脂肪的堆积可伴有高甘油三酯血症、高胆固醇血症,伴或不伴有血糖升高,同时HDL-C降低,这与本研究得出的结论保持一致。
肥胖患者由于胰岛素抵抗代偿性高分泌胰岛素,长期胰岛β细胞高分泌,导致胰岛β细胞衰竭,最终导致糖尿病的发生。既往有报道认为,腹型肥胖在导致胰岛素抵抗以及非胰岛素依赖性糖尿病(NIDDM)中发挥重要作用[15]。Choe等[16]研究提示,腹型肥胖会增加T2DM患者胰岛素抵抗的风险。用吸脂术祛除占体脂18%~19%的腹部皮下脂肪,并不明显的改变各组织器官对胰岛素的敏感性,亦不能改善内脏脂肪堆积导致的代谢紊乱[17]。而行网膜切除术祛除占总体脂0.8%的大网膜脂肪,相比行可调节胃束带手术的患者,可以明显改善口服葡萄糖耐量,减轻胰岛素抵抗[18]。以上两种手术资料有利的说明了由内脏脂肪堆积形成的腹型肥胖是胰岛素抵抗的标志。因此,腹型肥胖者的胰岛素抵抗要比均匀性肥胖(又称全身性肥胖、周围性肥胖)者更为严重[19]。后者的脂肪主要沉积于臀部以及大腿等皮下组织;这与本研究得出的胰岛功能结果相统一。
有研究提出,与内脏脂肪相比,阑尾或腿部脂肪与胰岛素抵抗呈负相关[20]。经统计,笔者得出T2DM单纯脂肪肝(组2)及单纯腹型肥胖无脂肪肝的患者(组3)其胰岛功能较非脂肪肝非腹型肥胖组(组4)无统计学差异,只有当患者同时出现脂肪肝及腹型肥胖(组1)时才会出现胰岛素抵抗及胰岛β细胞功能代偿性增高(P<0.05)。因此糖尿病患者患有脂肪肝并不可怕,可增强运动量,控制内脏脂肪面积达标,即可避免胰岛功能损伤;单纯腹型肥胖的患者亦可不必担心,只要控制好脂代谢,避免出现肝脏脂肪变,即可收到良好的胰岛功能指标。
另有提示通过生物电阻抗法对成年一般人群进行内脏脂肪面积测量,结果显示内脏脂肪面积与糖尿病、高血压病的发病率呈正相关,并与腰臀比、体重指数、空腹血糖、甘油三酯、血尿酸等代谢指标呈正相关[21-22]。以上均与本研究的结果相似。本研究还发现HLD-C水平与内脏脂肪面积呈负相关,推测HLD-C越高,NAFLD的发病风险可能越低,与近年来的研究结果相似[23]。
徐芸等[24]认为,腹型肥胖是脂肪肝最重要的危险因素之一,并且用内脏脂肪面积来描述腹型肥胖是最佳的方法。内脏脂肪蓄积有较高的代谢性疾病的风险[25]。根据日本肥胖学会的研究显示,内脏脂肪面积达100 cm2时,合并健康损害的状况约1.5倍多,冠心病患者中70%内脏脂肪达100 cm2以上[26]。关于NAFLD的危险因素,不同报道给出的结论不甚相同,究其原因可能与纳入的研究样本量大小以及相关因素不同有关,本研究得出T2DM+NAFLD的危险因素为内脏脂肪含量与VLDL-C,希望引起流行病学的关注,以便更明确NAFLD发病的危险因素,提早预防,为今后的研究提供参考。
综上所述,T2DM+NAFLD的特点是内脏脂肪面积增加,治疗疾病时应控制血脂、减重,进行科学的有氧运动及适量的阻抗运动,提高骨骼肌含量及运动耐力,选择具有减重作用的降糖药物。控制体重指数≤24 kg/m2,将腰围保持或控制在男85 cm、女80 cm以下,是预防和控制T2DM的有效措施。生物电阻抗分析法测量的禁忌人群有:孕妇、儿童、心脏起搏器植入术后以及患有皮肤病损者[22]。其是简便、快捷、无创、安全、经济的操作方式,具有良好的敏感性及较高的应用价值,建议在临床中广泛推广。

