以低血糖为首发表现的伴肝脏多发转移的恶性胰岛素瘤1例并文献复习
殷美琦 凌菁 陆而立 徐书杭 刘超 黄菲
1南京中医药大学附属苏州市中医医院内分泌科(殷美琦、凌菁、陆而立、黄菲) 215000; 2南京中医药大学附属江苏省中西医结合医院内分泌科(徐书杭、刘超) 210028
严重低血糖为内分泌科的急症,胰岛素瘤是其病因之一。大多数胰岛素瘤为良性,仅有10%为恶性[1]。苏州市中医医院最近诊治了1例伴肝脏多发转移的恶性胰岛素瘤患者,该患者接受了肝脏穿刺及手术治疗最终明确了病理诊断,现报道如下。
1 病例介绍
患者32岁,女性,2018年1月7日因清晨5时左右突感头晕,意识模糊,呼之可应,对答不切题,口齿欠清,右侧肢体动摇无法自制,无口吐涎沫,家属给予口服蜂蜜,症状好转不明显,出现恶心、呕吐一次,遂至苏州市中医医院急诊就诊。急诊查随机血糖2.9 mmol/L,静推葡萄糖后症状好转,头颅CT未见明显异常。追问病史,近半个月每日清晨3时至5时有汗出湿衣、心慌等症状,曾于2017年12月28日至当地社区医院就诊,查空腹血糖2.44 mmol/L。故为进一步查明低血糖原因收住入院。入院时,患者无明显不适,进食正常,近半年体重增加2.5 kg。既往史、个人史均无特殊,无特殊用药史。婚育史:适龄婚配,目前产后9个月,已停哺乳,配偶体健。生育史:2-0-0-2。家族史:患者母亲患有“糖尿病”,否认其他家族性遗传性疾病。入院查体:体温36.6℃,脉搏88次/min,血压120/86 mmHg(1 mmHg=0.133 kPa),神志清楚,步入病房,对答切题,皮肤黏膜无黄染,无色素沉着,甲状腺无肿大,心率88次/min,律齐,腹软,无压痛反跳痛,肝脾肋下未及,神经系统检查阴性。
入院后,监测患者末梢血糖。1月9日凌晨3时测得患者指尖血糖1.8 mmol/L,立即抽取静脉血测定血浆葡萄糖,结果为1.76 mmol/L,同步查胰岛素水平为40.18 μU/ml,胰岛素释放指数为1.27(正常参考值<0.3),提示内源性胰岛素分泌增多引起的低血糖[2]。多次监测血糖(图1),提示血糖较低,故给予静脉滴注葡萄糖及静脉注射高糖以预防低血糖的发生。同时,完善了其他实验室检查:血促肾上腺皮质激素8时、16时、0时分别为29.70、34.50、37.40 ng/L(参考范围7.20~63.30,下同),血皮质醇8时、16时、0时分别为392.60、295.70、363.80 nmol/L(7~10时:171~536 nmol/L,16~20时:64~327 nmol/L);生长激素:1.056 μg/L(0.010~3.607);促甲状腺激素1.2 mIU/L(0.27~4.20),FT32.91 ng/L(2.00~4.40),FT40.93 ng/dl(0.93~1.70);卵泡刺激素6.49 IU/L,黄体生成素10.54 IU/L,血清催乳素2.04 ng/ml,睾酮81.56 ng/dl,雌二醇279.79 pg/ml;尿常规:葡萄糖2+,尿蛋白±,pH5.5,比重1.017,酮体-;糖化血红蛋白4.6%(3.8%~6.0%);抗胰岛素抗体阴性;肿瘤指标未见显著异常;肝功能:丙氨酸氨基转移酶106.2 U/L(5~40),天门冬氨酸氨基转移酶45.1 U/L(5~40),γ-谷氨酰基转移酶64.9 U/L(5~55),余未见异常;肾功能:尿素3.04 mmol/L(2.86~8.20),肌酐43.8 μmol/L(35~104);电解质:血清碳酸氢盐24.0 mmol/L(19~29),血钾、钠、氯、钙、磷未见异常;血常规正常。
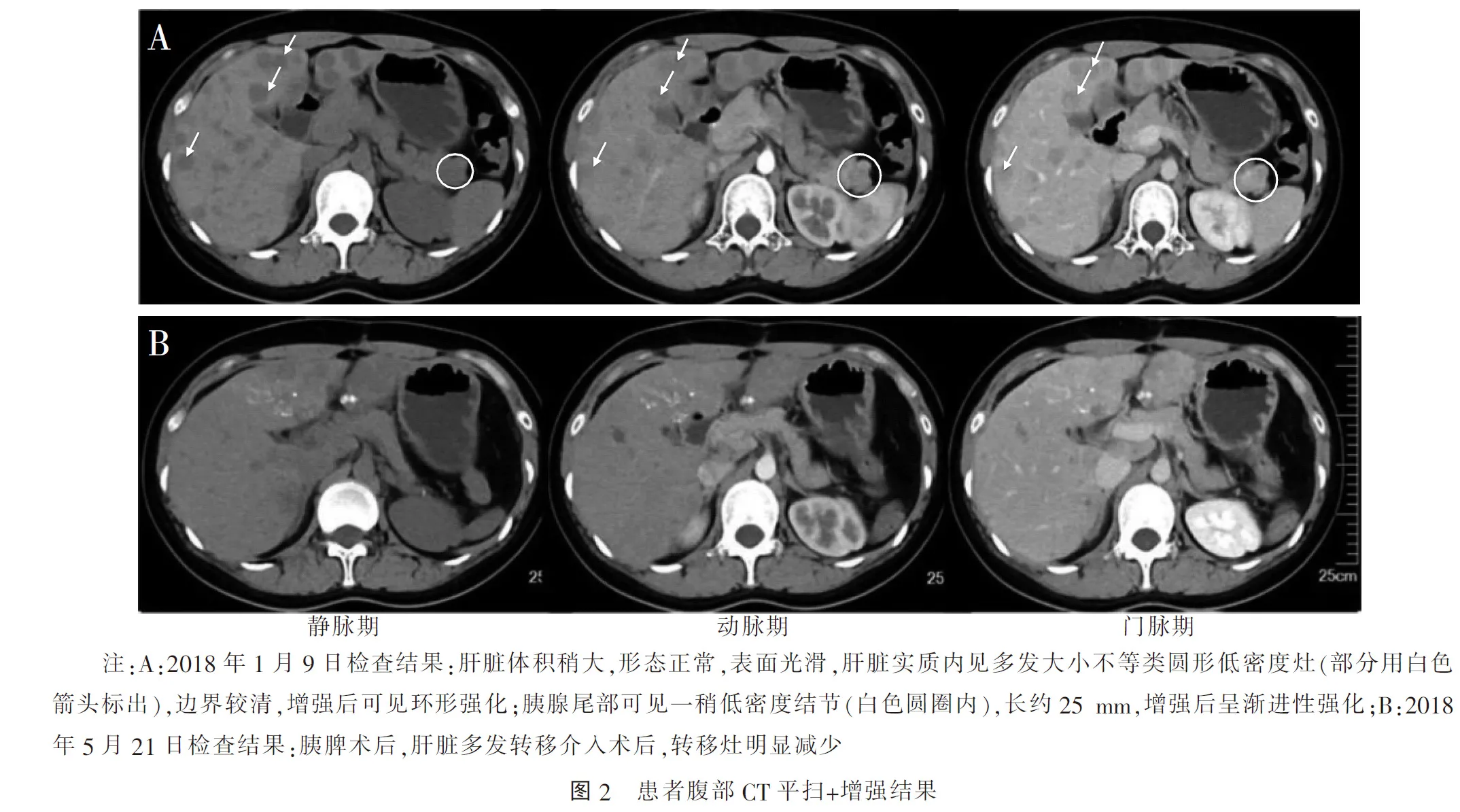
进一步完善影像学检查。患者入院前胸部CT未见异常(2017年12月28日)。2018年1月9日行腹部CT平扫+增强:肝脏多发低密度灶,考虑为转移瘤,胰尾部占位灶(长约25 mm),考虑为神经内分泌肿瘤可能(图2A)。2018年1月10日查肝、胆、胰、脾、肾、输尿管彩色超声:肝脏多发实质性占位灶(转移肿瘤可能),余未见异常。结合临床特点和实验室检查,排除垂体前叶功能减退症、肾上腺皮质功能不全、孤立性生长激素缺乏及甲状腺功能异常等,考虑胰岛素瘤。
为明确胰腺占位及肝脏多发病灶性质,2018年1月18日患者从苏州市中医医院内分泌科出院至复旦大学附属中山医院住院。1月23日在超声引导下行肝穿刺活检,病理提示:(肝穿刺)转移性神经内分泌肿瘤(G2),可见约5个核分裂相(镜下穿刺肿瘤组织约10个HPF),结合病史及免疫组化结果,符合胰腺来源。免疫组化:突触素(+),嗜铬素蛋白A(+),CD56(+),肝细胞(-),精氨酸酶-1(-),甲胎蛋白(-),磷脂酰肌醇蛋白聚糖3(-),CD34(血管+),Ki-67(20%阳性),细胞角蛋白7(+),细胞角蛋白19(+),糖类抗原199(-),肝细胞核因子1β(+),胰岛因子1(+),Nk同源异形盒基因家族-6(+),胰腺十二指肠同源盒-1(+),尾型同源盒基因-2(+),甲状腺转录因子1(-),胃泌素(-),生长抑素(-),胰高血糖素(-),P.P(+),血管活性肠肽(-),胰岛素(部分+),生长抑素受体2(+),生长抑素受体5(+)。2018年1月25日在中山医院行胰腺体尾、脾脏切除及淋巴结清扫手术。术后巨检:胰腺体尾切除标本,胰腺大小3.5 cm×3.5 cm×2 cm,已剖开,胰腺切缘大小2.5 cm×1 cm,距胰腺切缘1 cm,紧贴胰腺被膜见一灰白色肿块,大小约1.6 cm×1.5 cm×1.3 cm,质硬,界欠清;脾脏大小11 cm×6.5 cm×3 cm,切面红褐色质软;另送11 p组淋巴结。病理提示:(胰腺体尾+脾脏)胰腺神经内分泌肿瘤(G2),可见核分裂相(2~5个/10HPF);胰腺切缘未见肿瘤累及;检出脾门淋巴结1枚,未见肿瘤转移(0/1);送检11p组淋巴结1枚,未见肿瘤转移(0/1)。免疫组化:突触素(+),嗜铬素蛋白A(+),CD56(+),Ki-67(5%阳性),生长抑素受体2(+),生长抑素受体5(+),α-地中海贫血/精神发育迟滞综合征X染色体相关基因(+),死亡结构域相关蛋白(+),胰岛素(+),血管活性肠肽(-),P.P(弱+),胃泌素(-),生长抑素(-),胰高血糖素(-),第10号染色体缺失的磷酸酶张力蛋白同源物(+),P53(-),广谱细胞角蛋白(+),上皮膜抗原(部分弱+)。最终,该患者诊断为:恶性胰岛素瘤伴肝转移。
术后,患者仍有低血糖发作,但次数较术前减少,考虑肝脏多发肿块分泌过多的胰岛素,导致低血糖发生。术后第8天,患者接受了首次肝脏介入治疗,治疗后最低血糖可维持在2~3 mmol/L,1个月后再次行介入治疗,此后血糖稳定,未再发生低血糖。目前平均1~2个月行肝脏介入治疗1次。5月21日苏州市中医医院复查腹部CT平扫+增强提示胰脾术后,肝脏多发转移介入术后,转移灶明显减少(图2B)。
2 讨论
该患者以意识模糊入院,具有典型的Whipple三联症,诊断符合低血糖诊断,入院后除了预防低血糖反复发作,重点要明确低血糖病因。患者在血糖1.76 mmol/L时,同步血胰岛素40.18 μU/ml,提示有不适当的胰岛素分泌[1]。该患者凌晨3时出现低血糖,符合空腹低血糖。常见的内源性胰岛素分泌过多导致低血糖的原因包括[3]:糖尿病患者口服磺脲类药物、胰岛素自身免疫综合征、非胰岛素瘤所致的胰源性低血糖综合征或胰岛细胞增生症以及胰岛素瘤。本例中患者既往无糖尿病、胰腺炎病史,此次入院查糖化血红蛋白正常,也未接受磺脲类药物治疗。实验室检测未见胰岛素相关抗体升高,不符合胰岛素自身免疫综合征。影像学检查提示胰腺、肝脏占位,进一步活检,最终诊断为胰岛素瘤。胰岛素瘤以良性多见,但本例患者肝脏穿刺和胰腺肿块切除后的病理和免疫组化均提示为神经内分泌肿瘤,均能产生胰岛素,故是较为少见的伴肝脏多发转移的恶性胰岛素瘤。
胰腺神经内分泌肿瘤(PNET)是一类起源于肽能神经元和神经内分泌细胞的异质性肿瘤。胰岛素瘤是最常见的功能PNET,估计每年发病率为0.1/10万~0.3/10万[4]。其中仅有10%伴有转移,为恶性胰岛素瘤。50岁左右是发病高峰年龄段,女性发病率略高于男性。大约5%~8%的胰岛素瘤与多发性内分泌腺瘤1型有关[1,5-7]。
胰岛素瘤的病因尚不清楚。一项来自国内的病例对照研究发现,居住在农村地区、有胰腺内分泌肿瘤家族史和其他癌症家族史者,罹患胰岛素瘤的风险增加[8]。国际癌症基因组联盟发布的PNET基因组图谱显示,多发性内分泌腺瘤1型、Von Hippel-Lindau综合征、结节性硬化症基因1和2的失活、磷脂酰肌醇3-激酶/哺乳动物雷帕霉素靶蛋白通路的过度激活以及端粒酶α-地中海贫血/精神发育迟滞综合征X染色体相关基因/死亡结构域相关蛋白的失活与PNET发生有关,但未特别指出何者与胰岛素瘤相关性更大[9]。
胰岛素瘤的诊断主要是基于临床表现、相关实验室检查和影像学定位[1,6,10]。患者除了存在典型的低血糖症状外,还会有阳性的实验室检查结果,如空腹低血糖<3.05 mmol/L时胰岛素水平升高>3.0 mcIU/mL(通常>6.0 mcIU/mL,排除外源性胰岛素干扰)或计算胰岛素释放指数≥0.3或胰岛素原水平≥5.0 pmol/L、C肽浓度≥0.6 ng/ml。影像学定位一般采用薄层多期增强CT和超声内镜,联合或不联合MRI,除非以上检查不成功,才进行侵入性检查,包括向特定的胰腺动脉注射钙剂并测量右或左肝静脉的胰岛素水平来定位。目前,生长抑素受体显像的定位作用已经减弱,因为胰岛素瘤的生长抑素受体密度很低。SRS仅在考虑奥曲肽或兰瑞肽治疗时使用。本例患者有典型的低血糖症状,实验室检查发现空腹血糖1.76 mmol/L时,同步血胰岛素40.18 μU/ml,在排除垂体前叶功能减退、肾上腺皮质功能不全、孤立性生长激素缺乏及甲状腺功能异常等疾病之后,考虑胰岛素瘤。腹部CT增强明确定位于胰腺及肝脏,因此没有进行超声内镜及MRI等检查,更没有进行选择性动脉钙刺激肝静脉采血这种侵入性检查,而是直接接受了肝脏穿刺活检,肝穿刺病理提示转移性神经内分泌肿瘤,来源于胰腺。胰岛素瘤作为神经内分泌肿瘤,其分期参照美国癌症联合委员会胰腺外分泌肿瘤的TNM(肿瘤、淋巴结和转移)分期标准[11]。本患者结合术后结果,仍考虑原发于胰腺的神经内分泌肿瘤伴肝脏转移,临床分期Ⅳ期,为恶性的胰岛素瘤。
手术切除病灶是胰岛素瘤主要的治疗手段[1,6,12]。通过腹腔镜或开腹进行治愈性手术是治疗的最佳选择,由于90%的胰岛素瘤为良性,因此多采用腹腔镜手术治疗;但如果怀疑肿瘤是恶性的,应该直接选择开腹手术,因为对于没有远处转移的恶性肿瘤也需要进行淋巴结清扫。术中超声检查可以帮助确定肿瘤大小以及肿瘤与周围解剖结构的关系。肝脏是胰岛素瘤最常见的转移部位,如果可以,也建议切除所有可以看到的肝脏转移灶,这样有助于缓解症状,改善长期生存。如果无法切除,则可以考虑明胶海绵栓塞或经动脉化疗栓塞、运用放射微球放射治疗栓塞、射频消融、冷冻消融、经皮酒精消融等介入方法[1]。对于原发灶已切除,不伴肝外转移,但有肝脏弥漫性转移的恶性胰岛素瘤患者,肝脏移植可以作为一种治疗手段,但需考虑到目前肝脏来源短缺,同时应评估潜在临床获益[13]。另外,还可以选择使用链脲佐菌素、阿霉素、5-氟尿嘧啶、氯脲霉素、达卡巴嗪、替莫唑胺等进行全身化学治疗[1]。本例患者胰腺的原发肿瘤经手术完全切除,但因为肝脏左、右叶均有弥漫性多发转移,无法完全切除,而肝脏移植费用昂贵、器官短缺,因此术后接受了肝脏介入栓塞治疗,低血糖症状完全消除,血糖恢复正常,拥有了良好的生活质量,目前也未接受全身化学治疗。但对于胰岛素瘤患者,围手术期或术后经多种治疗仍持续低血糖时,可考虑给予口服药物控制危及生命的低血糖,常用的药物包括二氮嗪、生长抑素类似物如兰瑞肽、奥曲肽,mTOR抑制剂依维莫司以及糖皮质激素等[14]。但值得注意的是,本患者由于脾脏已经切除丧失了免疫功能,故如有持续低血糖发作,不适合使用糖皮质激素。未来,抗CD90单克隆抗体通过直接靶向胰岛素瘤细胞或靶向胰岛素瘤微环境可能成为一种潜在的新型辅助治疗方式[15]。
恶性胰岛素瘤的预后差。在巴西进行的一项研究中,恶性胰岛素瘤患者的5年生存率为16%,而良性胰岛素瘤患者的5年生存率为100%[16]。目前认为,预测PNET良、恶性最有意义的因素包括肿瘤大小、增殖活性、血管侵犯、周围或基质浸润和肿瘤坏死[17-18]。有研究显示,肿瘤蛋白D52在恶性胰岛素瘤中的表达较良性胰岛素瘤低,可能是新的判断预后的标志物[19]。本例患者有肝脏弥漫性转移,确诊恶性胰岛素瘤,推测5年生存率低,笔者将继续随访其疾病治疗及进展情况。

