瑞博西林联合氟维司群用于激素受体阳性、人表皮生长因子受体2阴性晚期乳腺癌的Ⅲ期研究
——MONALEESA3研究解读
【简评】
MONALEESA-3研究证实选择细胞周期蛋白依赖性激酶4/6(cyclin-dependent kinase 4/6,CDK4/6)抑制剂瑞博西林(ribociclib)联合氟维司群内分泌治疗,可给患者带来优异的临床疗效,因此这项治疗方案将积极推动强强联合内分泌治疗时代的到来,但是其有效性在亚裔人群中,仍需开展更多的临床研究来证实。基于此项研究笔者有以下体会:
① 氟维司群是目前内分泌联合治疗的首选:MONALEESA-3研究的亚组分析显示,氟维司群单药治疗组达到了18.3个月的无进展生存期(progression-free survival,PFS),这一结果印证了此前的FIRST和FALCON等研究,提示氟维司群是晚期乳腺癌内分泌治疗的最强单药。CDK4/6抑制剂最初与AI联合治疗,后来因为氟维司群在晚期乳腺癌的一线治疗中的良好疗效,研究者开始关注CDK4/6抑制剂联合氟维司群的治疗,既往POLAMA-3和MONARCH-2两项Ⅲ期研究分别比较了palbociclib和abemaciclib联合氟维司群二线治疗的效果,证实CDK4/6抑制剂联合氟维司群均能显著延长PFS,整体疗效出色。此项MONALEESA-3研究结果也证明ribociclib联合氟维司群可成为对激素受体(hormone receptor,HR)(+)/人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)(-)晚期乳腺癌一线治疗的首选。因此更多CDK4/6抑制剂将选择氟维司群作为目前联合内分泌治疗的药物。
② 靶向联合内分泌治疗成为晚期乳腺癌治疗的新模式:MONALEESA-3等系列研究的结果显示,CDK4/6抑制剂联合氟维司群将成为绝经后HR(+)/HER2(-)晚期乳腺癌患者一线/二线治疗的新选择,虽然联合治疗方案的不良反应发生率较单药治疗组高,但安全性仍在可控范围内。目前随着靶向治疗的兴起,如磷脂酰肌醇3激酶(phosphatidylinositol 3-kinases,PI3K)抑制剂和哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抑制剂等联合内分泌治疗,都将是临床研究积极探索的方向。因此选择疗效最好的内分泌药物联合靶向治疗,进行强强联合,才可能得到最佳的临床疗效。
本期分享的是2018年6月3日在线发表在J Clin Oncol的MONALEESA-3研究[1]。这是一项针对激素受体(hormone receptor,HR)(+)/人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)(-)晚期乳腺癌患者的Ⅲ期临床研究,探索细胞周期蛋白依赖性激酶4/6(cyclin-dependent kinase 4/6,CDK4/6)抑制剂瑞博西林(ribociclib)联合氟维司群相比氟维司群单药的疗效和安全性。
1 研究背景
众所周知,乳腺癌是全球女性最高发的癌症。30%~40%的早期乳腺癌会发展为转移性乳腺癌,5%~10%初诊即为晚期乳腺癌。晚期乳腺癌通常不可治愈,早期研究数据显示,中位生存期2~3年,仅25%能存活5年[2]。因此,晚期乳腺癌的治疗目标是延长生存时间与保证生活质量,既要生命的长度,也要生命的宽度。
既往研究显示,对于HR(+)/HER2(-)的患者,化疗或内分泌治疗总生存期(overall survival,OS)相似,但内分泌治疗患者生活质量和一线无进展生存期(progression-free survival,PFS)优于化疗。因此,美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南与中国晚期乳腺癌诊治专家共识等国内外诊疗规范文件均指出,内分泌治疗是雌激素受体(estrogen receptor,ER)阳性晚期乳腺癌的优选方案,即使内脏转移,除非有内分泌耐药的顾虑或疾病需要快速缓解,否则都应优选内分泌治疗。
乳腺癌内分泌治疗始于20世纪70年代,三苯氧胺(他莫昔芬)是第一个用于HR(+)晚期乳腺癌的内分泌药,一线中位PFS为6~9个月。到90年代,三类芳香化酶抑制剂(aromatase inhibitors,AI)的应用使晚期乳腺癌一线PFS延长到10~13个月。2002年,新的选择性ER下调剂氟维司群获批用于晚期乳腺癌的治疗,开启内分泌治疗的新篇章。研究表明,高剂量氟维司群(500 mg)可使患者一线PFS延长到16.6个月,是目前乳腺癌一线内分泌治疗的最强单药。
人类追求理想的疗效永无止境,在单药疗效发挥到极致的情况下,联合靶向药物疗效是否会更好?2014年,依维莫司和依西美坦联合开启了晚期乳腺癌内分泌+靶向治疗的新时代。2015年,CDK4/6抑制剂帕博西林(palbociclib)崭露头角,可联合来曲唑。CDK4/6抑制剂的作用原理是抑制D型细胞周期蛋白-CDK4/6复合物,从而抑制细胞周期进展。到2016年,证实帕博西林可联合氟维司群。2017年第2种CDK4/6抑制剂瑞博西林获批,即本研究的主要研究药物。现已知道,2018年3种CDK4/6抑制剂(帕博西林、瑞博西林、玻玛西林)均获批可与AI类、氟维司群、他莫昔芬等多种药物联合用于晚期乳腺癌的治疗(图1)。

图 1 2014—2018年NCCN指南HR阳性晚期乳腺癌基于内分泌治疗的可选方案汇总[3]Fig. 1 NCCN guidelines for HR positive-advanced breast cancer from 2014 to 2018
在MONALEESA3之前,PALOMA、MONALEESA、MONARCH 3个系列研究已证实,对于绝经前、围绝经期和绝经后HR(+)/HER2(-)晚期乳腺癌,CDK4/6抑制剂+传统内分泌治疗较单纯内分泌治疗可显著延长PFS;CDK4/6抑制剂+氟维司群联合用于HR(+)乳腺癌二线及后线治疗也具有一定疗效。但尚无研究评估CDK 4/6抑制剂+氟维司群用于HR(+)/HER2(-)晚期乳腺癌一线治疗或既往内分泌治疗>12个月后复发但仍未接受后续治疗的患者。
MONALEESA3即旨在评估瑞博西林+氟维司群用于绝经后HR(+)/HER2(-)晚期乳腺癌一线治疗或仅接受≤1线内分泌治疗的晚期患者疗效。
2 研究方法
2.1 设计概况
研究入组绝经后女性或男性、HR(+)/HER2(-)患者,既往无内分泌治疗或仅接受过≤1线内分泌治疗。以2∶1随机分配至试验组瑞博西林(600 mg/d口服,治疗3周,停药1周)+氟维司群(500 mg)或对照组安慰剂+氟维司群(500 mg)。预设分层因素包括是否伴肝/肺转移、既往内分泌治疗情况。主要研究终点是当地中心评估的PFS,次要终点包括OS等(图2)。
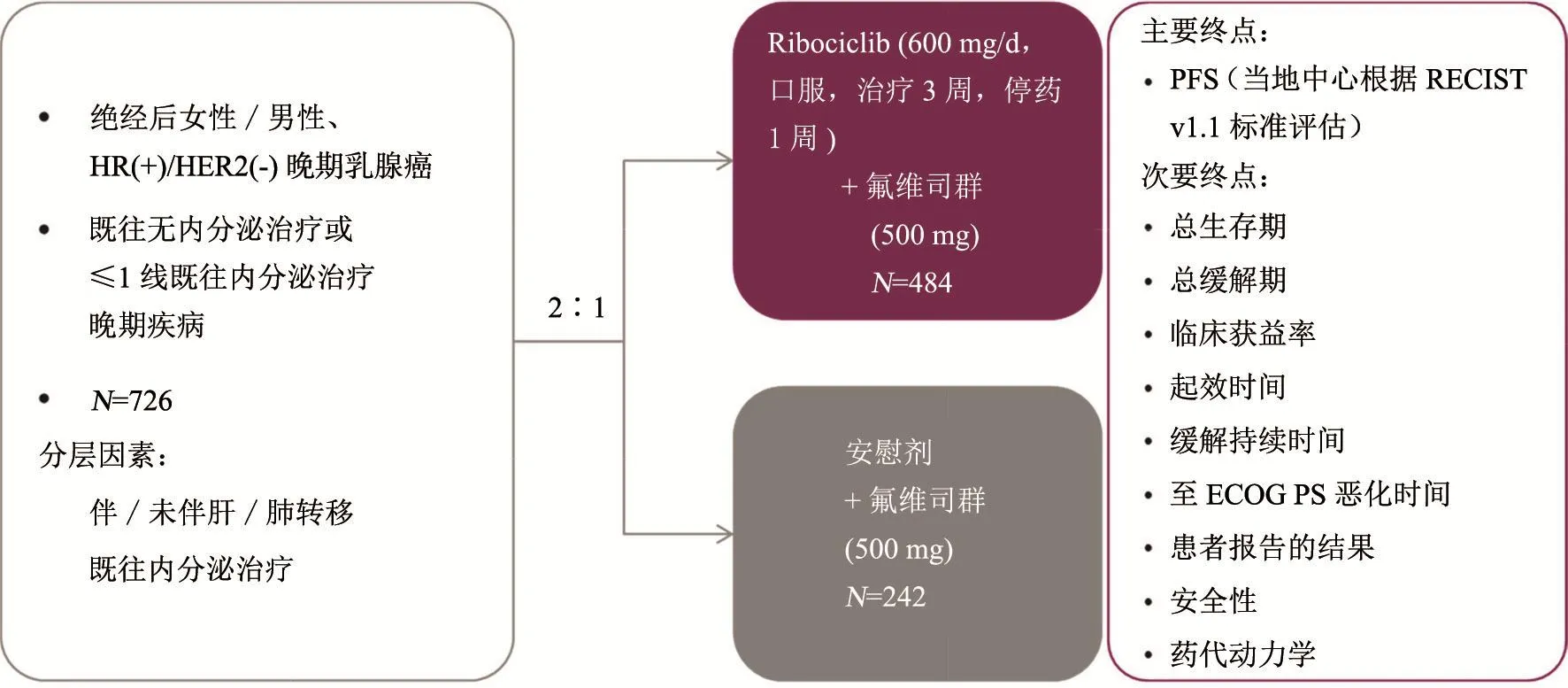
图 2 患者入组与随机分配情况Fig. 2 Enrollment and randomization
2.2 研究对象关键入排标准
关键纳入标准:绝经后女性/男性;≥1个可评估病变或≥1个主要的溶骨性病变;既往无内分泌治疗或≤1线既往内分泌治疗晚期疾病;ECOG PS≤1。关键排除标准:既往化疗、氟维司群、CDK4/6抑制剂治疗晚期乳腺癌;炎性乳腺癌;临床显著的心律不齐和(或)控制不佳的心脏病,包括QTcF>450 ms;由于疾病负荷不适合内分泌治疗。
可见本研究涵盖了一线和二线治疗。其中一线是针对完成(新)辅助内分泌治疗>12个月后复发或新发晚期/转移性疾病(未接受既往内分泌治疗)。二线及早期复发是针对(新)辅助内分泌治疗期间或完成治疗12个月内早期复发,或完成(新)辅助内分泌治疗>12个月后复发且经一线内分泌治疗(抗雌激素/AI)后进展,或初始诊断晚期乳腺癌且经一线内分泌治疗(抗雌激素/AI)后进展。
2.3 研究方案修正
回顾研究方案,经历了2次修正。第1次在2016年2月17日,主要更新和明确了安全性监测内容,在所有瑞博西林相关试验中保持一致,同时允许男性乳腺癌患者入组。第2次在2016年7月28日,已完成全部入组,主要有3处重大改动:① 鉴于该药其他研究及同类药物均显示CDK4/6抑制剂有效,故删去无效性中期分析(futility interim analysis);② 考虑一线事件发生比二线慢,故删去有效性中期分析(efficacy interim analysis)并增加最终分析时对于一线亚组的PFS事件数要求,以保障将来一线亚组检验效能;③ 基于独立评估委员会(Blinded Independent Review Committee,BIRC)评估的PFS改完全评估为抽检评估(抽40%),不作为次要终点,仅作为主要终点补充。值得注意的是,一般认为BIRC评估比研究者评估的PFS更客观。
2.4 样本量估计
根据文献回顾,对照组中位PFS一线预计18.0个月,二线预计6.5个月,假设40%来自一线,60%来自二线,预计总体疗效为9.0个月。假设研究组可降低风险33%,即HR=0.67,推测其中位PFS为13.4个月。在单侧α=0.025、power=95%的条件下,预计入组19个月,总随访26个月,考虑10%失访,总样本量需660例,相应事件数364例。方案修正后,一线事件数应≥125例,故最终实际纳入样本量更多。
2.5 统计分析计划
主要终点当地中心评估的PFS与次要终点OS采用层次检验,即仅在PFS差异有统计学意义时才能进行OS检验。基于现有样本量,对OS预期HR=0.71,需事件数351例(预计随机后56.0个月观察到)将有85%的power检验出差异有统计学意义;预设2次中期分析,第1次在PFS分析同时(约26.0个月),第2次在观察到75%的OS事件数时(约39.0个月)。
3 结果
2015年6月—2016年6月共726例患者完成了随机分组。截至2017年11月3日,中位随访时长20.4个月,全分析集包括试验组484例和对照组242例患者,分别发生210例和151例PFS事件,最终接受治疗的483例和241例患者纳入安全性分析集。
患者基线特征如表1所示。中位年龄63岁,在CDK4/6抑制剂系列研究中最大,因为仅入组绝经后女性。种族以高加索人为主,亚裔不到10%,达不到中国同步审批上市的要求。内脏转移患者约为60.0%,骨转移患者约为21.0%;由于单纯骨转移患者PFS可达22个月以上,因此研究尽量避免过多入组这类患者,否则较难观察到疗效差异。既往内分泌一线治疗、二线+早期复发约各占一半。仍接受治疗的患者试验组为42.1%、对照组为26.0%。停止治疗的主要原因是疾病进展,对照组为58.7%,试验组为39.9%;其次包括不良反应、医师决定等。
全分析集之中,研究者评估的PFS显示试验组明显获益,氟维司群单药中位PFS为12.8个月,联合瑞博西林中位PFS达20.5个月,平均风险比为0.593,即与对照组相比,氟维司群联合瑞博西林的疾病进展风险降低了40.7%,超过了预计的33.0%。基于盲态BICR评估的支持性分析结果相似,对照组中位PFS为10.9个月,试验组尚未达到,预计在20.0个月以上,HR=0.492(95%CI:0.345~0.703,图3)。
亚组分析显示,既往内分泌治疗一线与二线的患者,联合治疗都优于氟维司群单药(图4、5)。除种族以外,其余各个亚组均显示联合治疗显著优于氟维司群单药。种族中高加索人也获益,但亚裔及其他组由于人数过少,风险比可信区间跨1且非常宽,故无法推断组间差异,因此亚裔人群有必要重做研究。
一线治疗亚组中,联合治疗尚未观察到中位PFS,预计超过24.0个月,将达到最长一线缓解时间;氟维司群单药中位PFS达18.3个月,高于FALCON研究的16.6个月。后者入组初治Ⅳ期患者,从未接受过内分泌治疗,是对内分泌治疗非常敏感的人群;而临床上更多是内分泌治疗后发生复发转移的患者,氟维司群单药疗效究竟如何?本研究间接回答了这个问题,一线纳入既往接受过辅助内分泌治疗后进展的患者,同样达到了18.3个月的中位PFS。因此,即使患者无法用CDK4/6抑制剂,氟维司群单药对这种辅助内分泌治疗>12.0个月以后进展的患者同样具有较好的疗效。
二线+早期复发的亚组中,中位PFS从对照组的9.1个月提高到试验组的14.6个月,相比单药PFS延长5.5个月。同类研究显示,二线治疗CDK4/6抑制剂的确会带来生存期的延长,但主要体现在PFS,而OS差异并无统计学意义。

表 1 患者基线特征Tab. 1 Demographics and baseline characteristics
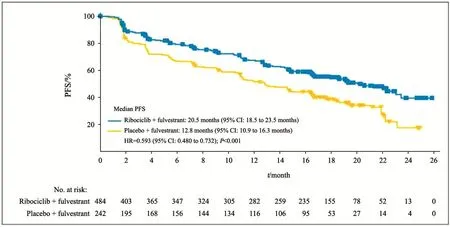
图 3 主要研究结果当地中心评估的PFSFig. 3 Kaplan-Meier analysis of locally assessed PFS
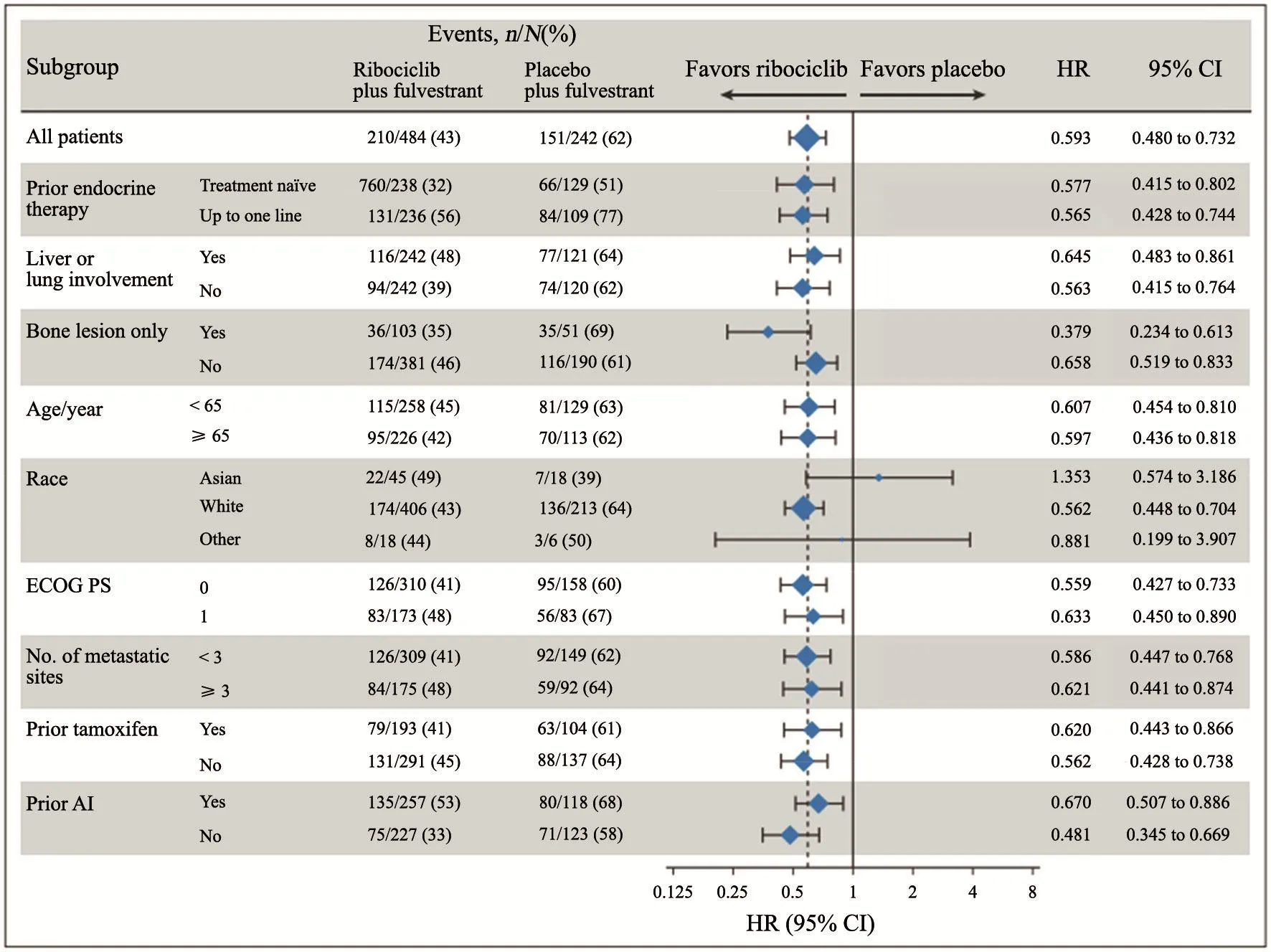
图 4 当地中心评估的PFS亚组分析结果Fig. 4 Locally assessed PFS outcomes in patient subgroups
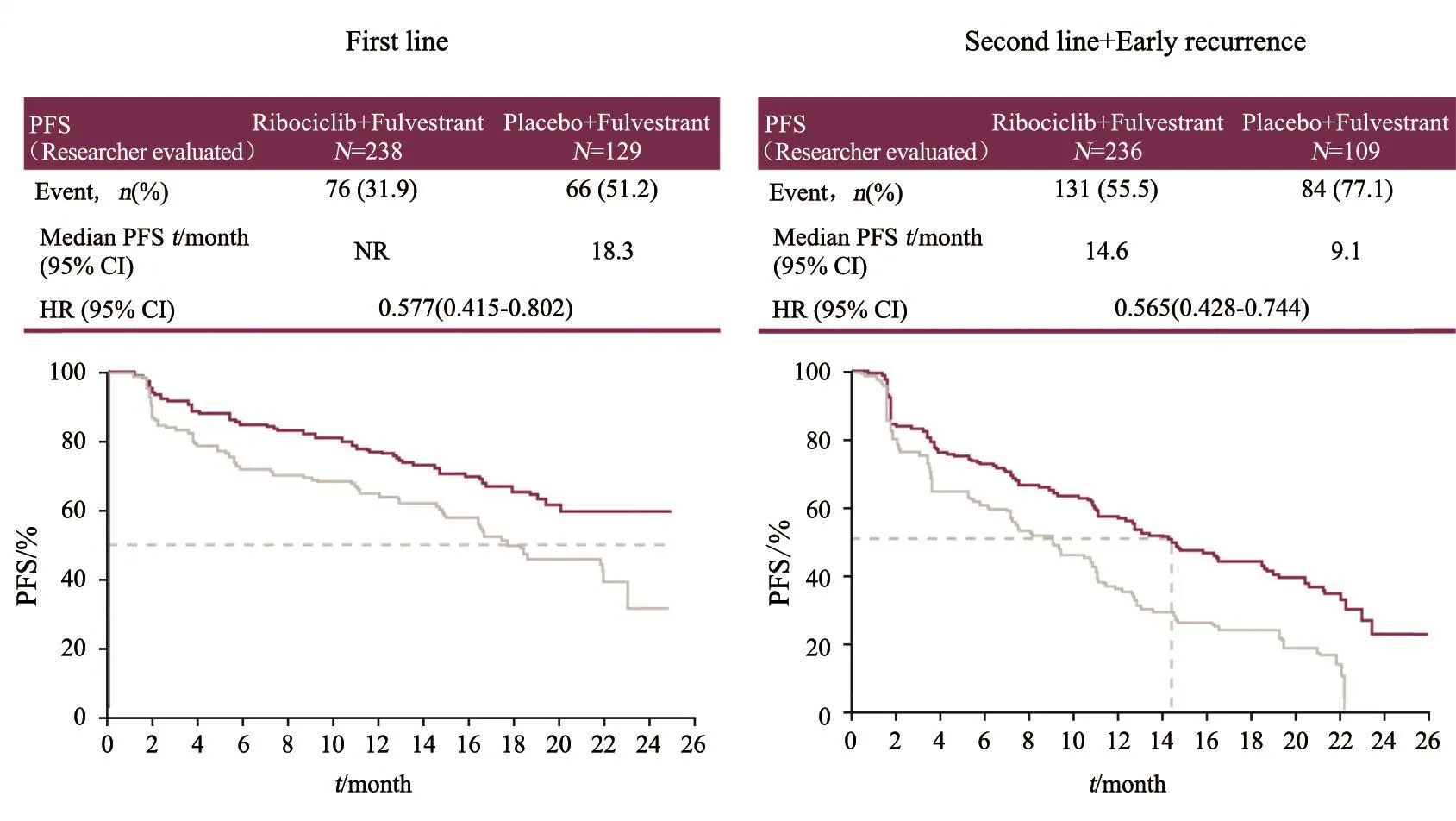
图 5 不同既往内分泌治疗亚组的PFS结果Fig. 5 Locally assessed PFS outcomes in patient subgroups according to prior endocrine therapy status
次要研究终点客观缓解率(objective response rate,ORR)和临床获益率(clinical beneficial rate,CBR)均观察到联合治疗相比单药显著提高,但OS数据尚不成熟。
两组药物治疗相对剂量强度相似,试验组发生较多的剂量减少和中断情况。安全性方面,试验组有较多血液系统不良事件发生,患者1周内基本可恢复到正常水平。非血液系统不良事件主要包括恶心、疲劳、腹泻、呕吐和关节痛。
总之,与氟维司群单药相比,瑞博西林联合氟维司群时PFS显著改善且具有临床意义。安全性可管理,与CDK4/6抑制剂既往Ⅲ期研究结果一致。因此,瑞博西林联合氟维司群可成为绝经后HR(+)/HER2(-)晚期乳腺癌患者一线或二线治疗新选择。这是首项证实CDK 4/6抑制剂+氟维司群用于既往未接受内分泌治疗的晚期乳腺癌患者或完成既往(新)辅助内分泌治疗>12个月后复发患者有效的研究。
4 讨论
MONALEESA3研究设计很精巧,涵盖了一线和二线,但也存在几个遗憾。首先是亚裔人群纳入太少,导致在中国上市延迟。第2个遗憾是仍然不能回答临床关注的原发性内分泌耐药患者是否可从CDK4/6抑制剂逆转耐药的问题。原发性内分泌耐药是指根治性手术后内分泌治疗2年内发生复发转移,MONALEESA3研究纳入了这类患者,但比例很低,仍有待后续研究来解答。
CDK4/6抑制剂联合氟维司群在绝经后HR(+)晚期乳腺癌二线及以上的应用主要涉及三大研究:PALOMA3、MONARCH2和MONALEESA3,其中MONALEESA3为亚组结果。PALOMA3纳入二线及后线治疗患者,MONARCH2和MONALEESA3针对二线患者,联合CDK4/6抑制剂可达到14~16个月,风险比下降都在40%以上。
CDK4/6抑制剂在绝经后HR(+)晚期乳腺癌一线的应用,其中PALOMA2、MONALEESA2、MONARCH3都是联合AI类,结果也是相似的,单药PFS达到14~16个月,联合CDK4/6抑制剂后可达25个月以上,风险比下降40%以上。而本研究联合的是氟维司群,即单用疗效最好的内分泌治疗药物,效果也是相似的,中位PFS目前尚未达到,预计在24个月以上(HR=0.58)。
此外,绝经前患者也有3个研究涉及。PALOMA3、MONARCH2研究都有绝经前或围绝经期亚组,MONALEESA7专门纳入绝经前患者,三项研究结果都具有临床意义,无论之前是否使用过内分泌治疗,无论一线还是二线,联合CDK4/6抑制剂均具有更好的疗效。
综上所述,晚期乳腺癌已进入内分泌+靶向治疗时代,可选治疗策略非常多。传统选择是先用AI类药物8~14个月的缓解;后续可更换其他AI类药物获得3~4个月的延长,或用AI类/氟维司群+靶向药物依维莫司获得7~11个月的延长,或二线氟维司群+CDK4/6抑制剂获得最长11个月以上延长。第2种选择,一线最强单药500 mg氟维司群获得16~22个月的PFS,但后续治疗AI+靶向尚无循证医学证据。第3种选择是一线AI+CDK4/6抑制剂,证据来自PALOMA2、MONALEESA2、MONARCH3研究,获得约24个月的PFS;后续治疗氟维司群+靶向药物,仅有回顾性研究数据显示可获得约6.5个月的延长。第4种选择就是本研究提供的一线氟维司群+CDK4/6抑制剂,强强联合,预计可获得26个月以上的缓解;后续治疗AI+靶向治疗预计可获得7~11个月的延长,但仅为预测数据(图6)。
以上策略对于OS都没有显著提高,因此,如何将PFS延长转换成OS获益,是后续临床试验需重点考虑的问题。
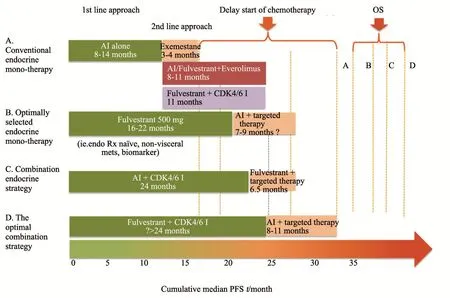
图 6 晚期乳腺癌内分泌+时代的治疗选择Fig. 6 Treatment strategies for advanced breast cancer based on endocrine therapy
致谢:本文部分内容借鉴了国际国内同行专家观点,在此感谢!

