儿童青少年甲状腺癌诊治指南解读及其进展
——核医学部分
杨 珂,郑 容,林岩松
1.中国医学科学院肿瘤医院核医学科,北京 100021;
2.中国医学科学院北京协和医学院北京协和医院核医学科,北京 100730
核医学以其独特的放射性核素示踪及靶向特征在甲状腺癌诊治中具有其独特的地位及意义。甲状腺癌尤其是分化型甲状腺癌(differentiated thyroid carcinoma,DTC)保留了部分甲状腺组织的摄碘等碘代谢功能,为核医学在其治疗中的应用提供了分子生物学依据。自1946年第一次将131I应用于DTC的治疗以来,核医学已成为术后降低中高危DTC患者复发及死亡风险的重要手段。之前有关DTC的诊治指南及其证据多侧重于成人DTC(adult DTC,aDTC)的指导,但儿童DTC(children DTC,cDTC)的病理生理、临床特征及远期预后与成人均存在较大差异。用于指导成人的指南及治疗策略可能会造成过度治疗并增加长期不良反应的风险,因此其可能并不适用于指导死亡风险较低的cDTC的诊治。有鉴于此,2014年由来自美国弗吉尼亚联邦大学Richmond儿童医院的Francis教授牵头的美国甲状腺协会(American Thyroid Association,ATA)儿童甲状腺指南编写工作组启动了cDTC指南的编写,历时1年余成文并发表于Thyroid杂志。虽然该指南中有关cDTC的研究涵盖多个年龄段,其中最大年龄为21岁,但考虑到大多数儿童患者在18岁前已发育完全,因此,为了更准确地评估发育过程中生理学的改变对肿瘤生物学行为的影响,该指南将儿童的年龄界定为≤18周岁。文中广泛纳入现有cDTC的研究证据,针对儿童DTC的病理及分子学特征、术后危险分层及术后评估、131I治疗的指征、剂量选择及不良反应、cDTC的随访等形成29条推荐意见,为cDTC的诊治提供了指导依据。本文仅就cDTC的病理特征及核医学诊治加以解读。
1 病理分类及病理分子特征
儿童甲状腺癌的病理学分类与成年人同样基于世界卫生组织(World Health Organization,WHO)标准。与成年人相比,儿童DTC以儿童甲状腺乳头状癌(children papillary thyroid cancer,cPTC)所占比例更高(90%以上)[1-6],而儿童甲状腺滤泡癌(children follicular thyroid cancer,cFTC)并不常见,儿童髓样甲状腺癌(children medullary thyroid cancer,cMTC)及低分化甲状腺癌和未分化癌则较为罕见。有文献报道[7]对于0~4岁的儿童,cMTC为主要的病理类型,但随着年龄增加,cPTC及cFTC所占比例逐渐增高并占据主要病理类型。
cPTC包括以下亚型:经典型、实体型、滤泡亚型、弥漫硬化型。与成年人相比,弥漫硬化亚型所占比例较高[8]。对于<10岁的cPTC患者,并未呈现典型的乳头状形态学特征,肿瘤可表现为无包膜并且腺体内外的广泛侵犯,还会有滤泡状和实体状的结构、独特的核型及伴随大量砂粒体[9-10]。对于cPTC患者尤其是年龄<5岁者,其诱发主要危险因素是甲状腺的放射性暴露[11-12]。
cPTC与cFTC的临床病理学特征存在较大差异。cPTC常表现为多灶及双侧分布,并且易出现区域性颈部淋巴结转移[1,5,10,13-21];经血循环转移至肺的发生率可达25%[10,16,19,22-30],通常仅发生于广泛的淋巴结转移之后[1,31]。典型的cFTC则多呈单一灶分布,初期就容易经血循环转移至肺和骨,而区域淋巴结转移并不常见。cFTC的组织学变异包括Hurthle细胞亚型、透明细胞型和孤立型(低分化)。
与aPTC相比,cPTC分子病理学特征呈更高的基因重排率以及更低的原癌基因点突变率。BRAF基因突变为aPTC最常见的基因事件,其突变率为36.0%~83.0%[32]。该指南中引用的文献发现在cPTC尤其是年龄较小的患者,BRAF基因突变较为罕见(0.0%~3.2%)[33-34]。然而近期多篇研究发现,BRAF基因突变在cPTC并不少见,最高可达40.0%,尤其在经典型PTC中更为常见[35-37]。这种差异可能与不同研究纳入的样本量不同有关。RAS基因突变为aDTC常见的基因事件,其在FTC、滤泡型甲状腺乳头状癌(follicular variant of papillary thyroid carcinoma,FVPTC)和PTC的发生率分别为30.0%~55.0%、25.0%~45.0%及10.0%~15.0%[38-41],但在cDTC中较为少见(文献报道为2.5%~13.0%)[35,42]。由于RAS和BRAF的点突变可导致基因的不稳定状态及失分化,并表现为NIS的表达降低[43-44],因此,cPTC较低的BRAF突变率从另一个角度解释了131I治疗cDTC有效及预后良好的机制,及其相对较低的疾病死亡率及罕见失分化特征。其他aDTC出现的基因点突变事件如TERT、PIK3CA、PTEN突变,在cDTC中则更为少见[42]。此外,尽管在该指南中未提及cPTC中NTRK基因融合的发生率及其对疾病预后的影响,但近期多项研究显示NTRK基因融合在cPTC中的发生率较aPTC更高(5.0%~25.0%),并且在发生于辐射暴露导致的cPTC中更为常见,其与淋巴结转移及更具侵犯性的临床病理特征相关[45-47]。近期美国食品药品管理局(Food and Drug Administration,FDA)批准了拉洛替尼用于治疗携带NTRK基因融合的局部晚期或转移性实体瘤的成人及儿童实体瘤患者,这将为部分碘难治性或局部晚期并存在NTRK基因融合cPTC患者提供新的治疗靶点。
2 cDTC危险分层系统及术后评估
目前最广泛应用于描述成人的疾病侵犯性程度及判断预后的分期系统是美国癌症联合会(American Joint Committee on Cancer,AJCC)的TNM分期。但是由于cPTC极低的疾病特异性死亡率,以及所有<45岁(AJCC第8版<55岁)患者仅以远处转移界定的过于简单的Ⅰ、Ⅱ期分期特征,使得TNM分期在预测cPTC预后方面存在局限性。但TNM分期系统在描述疾病侵犯情况及分层评价,特别是有关淋巴结累及情况方面,仍对儿童甲状腺癌的风险分层有指导作用。有研究发现,与不伴可触及的淋巴结患者相比,在诊断时伴有可触及的肿大淋巴结的cPTC更易呈多灶性(89.0% vs 16.0%),同时呈现更高概率的肺转移(20.0% vs 0.0%)、疾病持续状态(30.0% vs 0.0%)和(或)复发率(53.0% vs 0.0%)[31,48]。
该指南参照aDTC术后复发危险评估系统,并基于TNM分期系统,特别是针对区域淋巴结转移和远处转移的分期,制定了儿童版cDTC危险分层系统,与aDTC相近,该分层更侧重于识别出患者存在的持续淋巴结病灶风险而非死亡风险,以协助制定长期随访方案。该分层将cDTC进行低中高危分层(表1)。

表 1 ATA甲状腺癌儿童危险分层Tab. 1 ATA pediatric thyroid cancer risk level
可以看出,cDTC复发危险分层和aDTC(ATA指南2015版)存在较大差别,淋巴结转移以及病灶局部侵犯程度是其分层的主要依据,这可能与cDTC病例数量本身较少导致研究数据不足有关。另外从cDTC分层可以看出,颈侧区淋巴结转移对患者复发风险有着较大影响,这方面亦与aDTC存在较大差异。其他影响cDTC复发危险分层的因素尚有待进一步研究。
关于术后的再评估,该指南推荐大多数患者在术后12周内进行初步分期及风险评估,旨在评价其是否仍存在病灶及能否从后续131I治疗中获益。虽然目前在cPTC中基于危险分层制定诊疗策略及治疗前评估的前瞻性研究较少,但指南仍推荐根据患者的复发危险分层来选择合适的手段进行评估。
本设计APP的特色与优势是坚持以为游客提供最优质、最全面的旅游服务为核心,专一服务于游客为准则,以一站式的服务为理念,对口景点服务,解决了传统出游不方便、信息来源过于繁杂、资料过时等问题,实现了目的地及景区信息查询、游记分享、导航功能、展示游玩路线、搜索周边酒店及餐厅以及查询美食相关信息等功能。
对于cDTC低危分层患者,可仅监测其抑制性甲状腺球蛋白(thyrogloblin,Tg)并定期随访。而对cDTC中高危患者,则推荐行促甲状腺激素(thyroid-stimulating hormone,TSH)刺激性Tg及诊断性131I(或123I)全身显像(diagnostic whole body scan,DxWBS)等影像学检查,以决策后续治疗。指南推荐针对cDTC患者尽可能使用123I进行DxWBS显像,以减少患者的辐射剂量。针对DxWBS所示甲状腺床无摄碘或少量摄碘者,进一步采取刺激性Tg量化分层来决策131I(图1)。针对甲状腺床外的颈部摄碘灶,其他影像学检查包括颈部超声和单光子发射计算机断层成像术(single-photon emission computed tomography,SPECT)/电子计算机断层扫描(computed tomography,CT)等有助于其更准确的定位,如经外科会诊对其可行手术切除者,建议手术。针对无需再次局部手术干预的远处转移患者,指南推荐行131I治疗及治疗性全身显像(post-treatment whole body scan,RxWBS),这部分患者的后续治疗及随访见后文及图3。
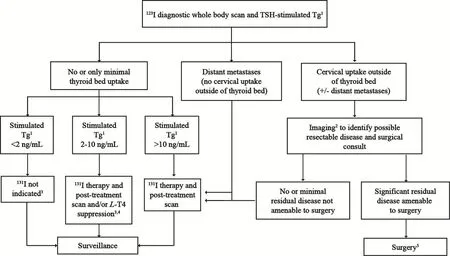
图 1 cDTC中、高危分层患者的术后评估Fig. 1 Initial postoperative staging for American Thyroid Association intermediate- and high-risk pediatric thyroid carcinoma
针对术后刺激性Tg预测疾病预后的研究在cDTC中仍较少。一项小样本单中心研究发现,经过5年随访后无病生存(disease-free survival,DFS)患者的术后刺激性Tg中位数为8.5 ng/mL,预测DFS的最佳cut-off值则为31.5 ng/mL,其灵敏度及特异度均为100%[49]。另一项研究则发现预测远处转移的术后刺激性Tg的cut-off值为154.0 ng/mL,灵敏度及特异度分别为87.5%及91.7%[50]。可以看出,上述cDTC的Tg界值点均高于aDTC的相应数据。
3 131I治疗目标
自1946年首例伴有转移灶的成年甲状腺癌患者接受131I治疗并证实有效后,131I被提议作为DTC特异性的治疗方法,并被广泛应用于aDTC的治疗。尽管从文献可知早在1947年就已尝试用131I治疗cDTC[51],但相比aDTC,探索cDTC的131I治疗潜在获益的研究证据仍相对较少,这可能与cDTC样本量较少,以及不论是否进行辅助131I治疗其预后较好有关。目前多数研究显示,具有摄碘功能的肺转移cDTC患者可从131I治疗中获益,其中约47%的患者可达完全缓解,38%达到部分缓解,特别是那些微小和较小肺转移患者[22,52-55],不难看出,相较于肺转移性aDTC患者,131I在肺转移性cDTC的治疗效果更佳,因此,对于肺转移的cDTC131I具有其治疗意义。而对于有残留病灶的患者,部分研究发现131I治疗可以降低疾病的复发风险[19,22,27,54]。131I可用于手术不可切除的摄碘性局部病灶、淋巴结或远处转移灶的治疗。
对于131I治疗后仍存在持续病灶的cDTC患者,需结合临床特征及前次治疗后疗效进行利弊权衡及个体化131I治疗决策。
由于cDTC本身预后好于aDTC,加之近年来有关131I治疗引起继发肿瘤的相关报道,该指南对cDTC的131I治疗指征把握也较前更为严格,例如,指南中并不推荐以清除残余甲状腺为目的的131I治疗,这也与最新成人ATA指南的思路相近。
4 cDTC 131I剂量选择
目前尚无标准化的cDTC131I治疗剂量公式,以及有关cDTC给予不同剂量131I时的有效性、安全性和长期预后的研究。经验性治疗剂量具有简便易行的优点,另外就是根据体质量或体表面积折算[如儿童体质量(kg)/70 kg]131I的剂量,这是基于治疗相似病情成人的标准剂量来确定的[56-58]。总的来说,在病情相似的情况下,15岁的cDTC患者需给予成人剂量的5/6,10岁者给予成人剂量的1/2,5岁者则需要给与成人剂量的1/3[59]。
对于存在摄碘性弥漫性肺转移灶或其他远处转移灶需要多次131I治疗的cDTC患者,或经过之前化疗、放射性治疗已经达到骨髓剂量上限值者,应使用全身剂量学计算最大可给予的131I剂量,以确保血液的吸收剂量不超过200 cGy[60-62]。在广泛肺转移或存在其他远处(例如骨)转移瘤等肿瘤负荷较重时,也可以通过病灶的吸收剂量来确定131I有效的给予剂量[61,63-66]。由于儿童相比成人体质量和碘清除率差异较大,指南建议由经验丰富的医师来确定131I剂量。
5 cDTC的监视与随访
该指南中对Tg、超声、DxWBS在儿童PTC随访中的作用,以及Tg阳性DxWBS、颈部持续/复发疾病、肺转移患者的诊疗分别进行了阐述。
5.1 Tg及甲状腺球蛋白抗体(thyroglobulin antibody,TgAb)检测
此外,有研究发现,cDTC患者的Tg水平也许会稍高于病情程度类似的aDTC患者[53,74]。其原因尚不清楚,推测其部分可能源于cDTC的生物学行为及临床病理特征与aDTC存在较大差异,因此,是否可将aDTC的有关Tg对疾病状态预测的相关界值直接应用于cDTC仍有待进一步研究。
5.2 超声诊断
指南推荐对cPTC采用颈部超声进行随访,初次手术后治疗至少6个月后行颈部超声检查,此后进行分层随访,低危者每12个月、中高危者每6~12个月行颈部超声检查。5年后则根据患者的复发风险进行个体化随访。
5.3 DxWBS
① 与在aDTC的应用相似,DxWBS可用于探测cDTC残留病灶,并为再次131I治疗及剂量决策提供依据。对于已行131I治疗并经评估提示无病的患者,DxWBS是证实已无摄碘灶、无需再次治疗的重要证据。② 推荐已经接受过131I治疗的高危患者,或前次RxWBS提示存在摄碘转移灶的患者行DxWBS,并且至少随访12个月后再行DxWBS检查。③ 若DxWBS结果为阴性且患者无持续疾病的临床证据,在之后的随访中不建议继续常规采用DxWBS探查是否存在疾病复发。
5.4 Tg阳性但DxWBS或超声阴性的cDTC处理
对于抑制性Tg阳性但颈部超声和DxWBS阴性的cDTC患者,应当考虑行颈胸增强CT检查。由于18FDG-PET/CT在cDTC应用较少,指南不常规推荐将18FDG-PET/CT用于持续疾病cDTC患者的随访。临床处置方面亦不推荐对这类患者采用常规经验性131I治疗及将RxWBS用于探查病灶,除非存在临床疾病进展(如Tg升高等)和前次131I治疗有效的证据[血清学如Tg/TgAb和(或)CT等影像学],与aDTC相比,对cDTC的经验性治疗指征显然把握更加严格。
5.5 颈部持续/复发疾病的处理
对于已探查到的患者颈部病灶的处置,指南推荐根据患者年龄、初始的cDTC危险分层、是否存在远处转移灶、之前的诊疗史(包括之前治疗的并发症)等行个体化处理,同时将病灶大小、侵犯范围、解剖位置及摄碘情况纳入考虑(图2)。由经验丰富的外科医师对病灶>1 cm的患者评估手术的可行性。对于存在摄碘性颈部病灶应根据患者的个体风险和是否存在远处转移灶进行个体化治疗决策,若病灶在颈部,尤其是位于之前未行清扫的淋巴结区,则手术更为推荐。再次施行手术后的患者,应进行术后再分期来决定是否行131I治疗。可以看出,儿童指南对于局部复发或疾病持续患者的处置原则与成人版也是大体一致的,即优先根据患者的临床特点评估是否可行手术,并建议术后再次评估能否从131I治疗中获益。
5.6 cDTC伴有肺转移的治疗
儿童发生DTC肺转移的风险高于成人,但其长期预后(尤其在接受131I治疗后)明显好于成人。根据cDTC肺转移的特点,该指南列举了6个推荐条目:① 经DxWBS证实的摄碘性肺转移患者推荐行131I治疗。② 针对不摄碘(DxWBS阴性)及对前次131I治疗无反应者不推荐131I治疗,这与aDTC的治疗策略相近。③ 针对131I治疗大于12个月且抑制性Tg呈上升趋势者,以及131I治疗后病情一度稳定后抑制性Tg上升者或12个月内出现疾病进展者,需进一步行DxWBS和刺激性Tg检查,依据病灶摄碘情况及对前次131I治疗反应进行后续个体化131I治疗决策(图3)。④ 而对于摄碘但疾病仍持续进展的患者,由于需将其远期不良反应等因素纳入考虑,因此需多方面综合判断其获益情况之后再决定是否继续行131I治疗。⑤该指南特别强调,需持续动态监测Tg的变化(每3~6个月)直至其对前次治疗达到完全的治疗响应再考虑是否进行下一步治疗。⑥ 对所有存在肺转移的患者,尤其是计划或接受多次131I治疗者,应对其肺功能进行监视及检测。
5.7 对于不再摄取131I或131I治疗无效的进展型甲状腺癌儿童患者的处置原则
指南推荐大多数无症状及非进展型131I难治性cDTC患者,在TSH抑制治疗下可安全地进行监控及随访。关于儿童进展型131I难治性甲状腺癌系统治疗的相关研究较少,在一些无法进行系统治疗的特殊病例,可选择临床试验或考虑口服激酶抑制剂。
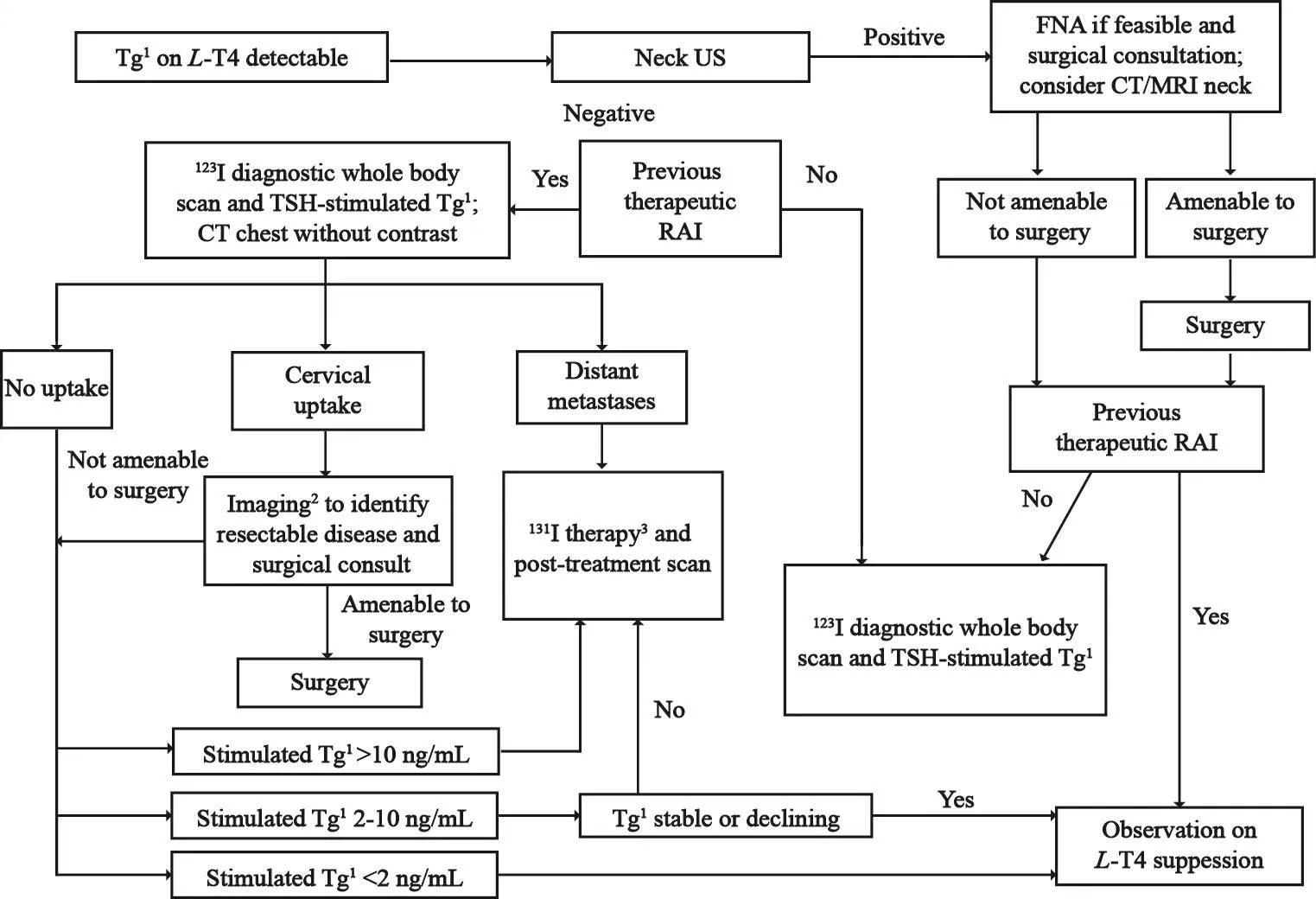
图 2 存在已知或可疑残留或复发疾病患者的处置(无确定的远处转移)Fig. 2 Management of pediatric patient with known or suspected residual/recurrent disease (no known distant metastases)

图 3 伴有已知远处转移患儿的处置Fig. 3 Management of pediatric patient with known distant metastases
2015年针对aDTC的ATA指南正式引入动态风险评估系统以实时评估疾病的转归,而在该指南中由于缺乏相关研究的证据支持仍未纳入该系统。在该指南发布后,近期有多项研究利用成人版动态风险评估系统来评价cDTC的疗效,并认为该系统同样可用于预测cDTC的疾病状态并调整后续随访及治疗方案[75-78]。其中一项研究预测治疗满意(excellent response,ER)的术后刺激性Tg的cut-off值为37.8 ng/mL,其灵敏度及特异度分别可达81%及100%[77]。因此相信在未来该指南的更新中,整合更多的研究数据后将会纳入动态风险评估系统以更有效地指导cDTC的随访及治疗。
6 cDTC 131I治疗的急性和长期不良反应
针对131I治疗可出现的急性和长期不良反应,该指南进行了阐述。大多数的作用机制与给药方式以及药物的吸收、分布、排泄途径等有关。
急性不良反应主要包括一些可以摄取131I组织的辐射损伤,造成唾液腺炎、口干、龋齿、胃炎、眼干、鼻泪管堵塞[79-80]。由于专门针对儿童的研究数据较少,因此急性不良反应的预防措施主要参考成人的指南,如131I治疗后24 h给予酸性糖果或柠檬汁,并在3~5 d内充分饮水。生殖系统的不良反应主要为性腺损伤[81-82],女性还可出现一过性闭经及月经失调。儿童不涉及短期内的生育问题,但需要注意的是对于131I累积剂量大于等于14.8 GBq的青春期后男性,应考虑预先储存精子等问题[83]。
部分cDTC患者可出现急性的骨髓抑制,但一般131I治疗后60 d内血常规检查一般会恢复至正常值。长期骨髓抑制较为罕见。指南推荐多次131I治疗期间需留出一定时间待骨髓恢复至正常。对于存在肺转移的cPTC患者,当滞留的131I剂量超过3.0 GBq时,131I引起肺纤维化的风险显著增高[84-85]。因此,指南建议对于DxWBS观察到转移灶摄碘明显的儿童患者,应根据剂量学确定131I剂量或相应地减少131I剂量。
关于131I治疗与继发肿瘤风险增高以及总死亡率升高的研究近年来已引起广泛关注,尤其是2017年发表于Leukemia及2018年发表于Journal of Clinical Oncology上的两篇重磅文章[86-87],指出131I治疗与血液系统肿瘤风险增加存在一定关系,因此引起了不少的议论。然而这两篇文章并未将儿童单独进行分组并加以分析,因此131I是否增加儿童血液系统肿瘤风险仍需进一步的研究。由于cDTC患者相对较少、儿童患者生存期较长等因素,目前有关其长期安全性研究的证据很少,因此,该指南未推荐出131I治疗累积剂量限值,亦未明确131I治疗与继发肿瘤风险之间的联系。由于儿童身体各部位及器官仍处于发育阶段,相比成人器官的体积更小,细胞增殖潜能更大,这些因素使cDTC131I治疗的安全性问题会被过度关注甚至引发恐慌,因此对于cDTC来说,面临的挑战是识别出哪些儿童患者可以从131I治疗中获益,哪些即使终止131I治疗也不会影响其生存或疾病特异性死亡率。
综上,该指南首次针对cDTC提出诊疗推荐。指南基于现有的研究证据及临床经验,并根据儿童较为特殊的病理生理及临床特征提出一系列建议及推荐,在131I治疗评估及诊治体系中,提出了cDTC术后风险分层及131I个体化治疗理念;强调131I治疗后动态评估在随诊中的作用和意义;强调131I治疗效果的充分发挥,严格把握再次治疗指征以避免过度治疗,以达到cDTC131I治疗获益最大化为目的的治疗原则。这些理念的更新将有助于核医学科医师针对cDTC 的131I治疗决策及其规范化。应当指出的是,循证医学证据相对较少、级别较低是该指南的不足。但可以看到,继该指南发布后,后续的研究进展正不断地填补着之前的不足及空白。

