阿柏西普类似药电荷异构体的药代动力学研究
安 红,刘万卉,,沈振铎,沙春洁,杨博璐,赵燕燕,
(1.烟台大学新型制剂与生物技术药物研究山东省高校协同创新中心、分子药理和药物评价教育部重点实验室,山东 烟台 264005;2山东绿叶生命科学集团长效靶向药物传递系统重点实验室,山东 烟台 264005;3.山东绿叶生命科学集团博安生物技术有限公司,山东 烟台 264005;4.中国药科大学药学院,中国 南京 211100)
在过去的几十年中,抗体类药物,包括Fc融合蛋白,在临床恶性肿瘤、自身免疫病、感染、心血管疾病和器官移植等重大疾病的治疗中取得了快速发展.截至2016年3月,已有超过60个抗体类药物经美国食品药品管理局 (FDA) 批准上市,其中有9个是Fc融合蛋白药物[1].
阿柏西普 (Aflibercept) 是一种全人源化的重组Fc融合蛋白,使用基因工程技术将血管内皮生长因子受体 (VEGFR)-1的第2结构域和VEGFR-2的第3结构域与人IgG1的恒定区融合而产生[2-3],因此对VEGF-A,VEGF-B和胎盘生长因子的亲和力远远高于第一代抗VEGF药物,从而有效地发挥抗血管生成作用[4].2011年,阿柏西普在美国上市,目前在FDA已获批了4个适应证,包括视网膜静脉阻塞继发黄斑水肿、湿性年龄相关性黄斑变性、视网膜中央静脉阻塞继发黄斑水肿和糖尿病性黄斑水肿[5].
本实验室开展了阿柏西普类似药的开发研究,发现经过proteinA柱纯化后的蛋白具有较宽的等电点 (pI) 范围,为6.7~9.2,而阿柏西普的pI范围为6.7~8.1,即存在多种电荷异构体.已知电荷异构体作为一种关键质量属性 (CQA),可能潜在的影响药代动力学 (PK) 特性以至于影响药物的安全性和有效性[6-8].因此,把经过protein A柱纯化后的蛋白作为起始材料,制备得到3个具有不同pI范围的电荷异构体组分,按pI值从低到高分别为Fr 1、Fr 2和Fr 3;采用成像毛细管等电聚焦电泳 (iCIEF)、分子排阻色谱 (SEC) 和肽图分析对3个电荷异构体组分进行表征,并检测其寡糖和唾液酸含量.单次静脉给药SD雄性大鼠进行PK研究,通过与阿柏西普进行对照,观察不同电荷异构体的PK性质,并初步揭示了机理.
1 实验部分
1.1 材料
使用弱阳离子交换色谱法,将经过protein A柱纯化阿柏西普类似药细胞收获液得到的蛋白作为起始材料,pI范围为6.7 ~ 9.2,分离制备得到3个pI不同的电荷异构体组分,按pI值从低到高分别命名为Fr 1、Fr 2和Fr 3; 阿柏西普购自SANOFI.
1.2 仪器
405LS洗板机购自BIO-TEK公司;Infinite F50酶标仪购自TECAN公司;PHMP-4孵化箱购自三洋公司;Heraeus Multifuge XIR 离心机和Fresco21微量台式离心机均购自Thermo Fisher公司;Advantage A10 Milli-Q超纯水制备仪购自Millpore公司
1.3 试剂
PBST pH值7.4、PBS pH值7.4、牛血清白蛋白 (BSA) 购自Sigma;TMB microwell peroxidase substrate、过氧化物酶底物B、TMB过氧化物酶底物均购自KPL;捕获抗原rhVEGF购自RD;二抗Anti-Human IgG购自Sigma;85% 磷酸购自天津市永大化学试剂有限公司.
1.4 实验动物
健康成年的清洁级SD大鼠,16只,雄性,年龄8周,体重约250 ± 10 g,由济南朋悦实验动物有限公司提供.
1.5 动物试验
将SD大鼠随机分为4组,Fr 1、Fr 2、Fr 3和阿柏西普组,给药剂量10 mg/kg,给药体积0.4 mL/kg,尾静脉注射.
给药前禁食12 h,自由饮水,给药后3 h,统一进食,进食时间分别在首次给药前 (0) 及给药后5 min、30 min、6 h、24 h、2 d、3 d、7 d、10 d、14 d、17 d、21 d、24 d、28 d、35 d、42 d.
从大鼠的眼眶静脉丛采血略大约0.35 mL,血液置于预冷的肝素化的抗吸附离心管中,混匀后,4 ℃,3 000×g离心5 min后,取上清液至另一抗吸附离心管中,-70 ℃保存待测.为避免时间影响,除第一天外,其他采样时间为早上9:00左右.
本实验有关动物实验方案已获得烟台大学伦理委员会批准.
1.6 血浆药物浓度的测定
首先,将0.2 μg/mL抗原加入到96孔聚苯乙烯微量滴定板中,100 μL/孔,4 ℃过夜.用PBST 300 μL/孔洗涤4次.然后加入1% BSA/PBS,200 μL/孔,37 ℃孵育1 h.加入空白、标液、质控(QC) 样品和血浆样品(复孔),100 μL/孔,37 ℃,1 h.再用PBST 300 μL/孔洗涤4次.加入1∶5 000稀释的猴血浆吸附的羊抗人-HRP二抗100 μL/孔,37 ℃孵育1 h,随后进行另一次洗涤.然后,将100 μL 四甲基联苯胺 (TMB) 过氧化物酶底物 [Kirkegaard&Perry Labs (KPL) 50-76-0]和过氧化物酶溶液B,0.02%过氧化氢 (KPL 50-65-00) 的1∶1混合物添加到每个孔中.温育30 min后,加入100 μL 1 mol/L磷酸终止反应,颜色由蓝绿色变为黄色.使用酶标仪在可见光 450 nm和630 nm处读数.采用四参数拟合分析数据.
2 结果和讨论
Fr 1—Fr 3的iCIEF、SEC和唾液酸分析结果如表1所示,测得Fr 1—Fr 3的pI范围分别为6.7~7.7、7.3~8.4和7.5~9.2;且pI> 8.14的碱性电荷异构体含量逐渐增加;单体百分比分别为98.7%、98.8%和96.5%,表明Fr 1—Fr 3均具有相对较高的单体纯度.从Fr 1到Fr 3,唾液酸Neu5Ac的物质的量的比显著降低,可能是由于损失了含唾液酸Neu5Ac的糖链造成的.因此,推测从Fr 1到Fr 3,pI升高可能与唾液酸Neu5Ac的含量依次降低也有关.同样未观察到唾液酸Neu5Gc,表明不存在潜在的免疫原性.

表1 Fr 1—Fr 3的iCIEF、SEC和唾液酸分析结果
肽图分析的结果如表2所示,Fr 1—Fr 3均含有5种翻译后修饰 (PTMs),分别为C-末端赖氨酸 (CTL)、甲硫氨酸氧化、天冬酰胺脱酰胺、天冬氨酸异构化和去糖基化.且CTL的比例从50.5%依次增加至66.2%;5个糖基化位点的去糖基化比例依次变大(N36,从0.1%~0.3%;N68,从23.7%~41.7%;N123,从0.1%~0.5%;N196,从0.9%~11.3%;N282,从0.5%~6.4%).甲硫氨酸氧化、天冬酰胺脱酰胺和天冬氨酸异构化在各组分之间没有显著变化.这些结果表明,从Fr 1到Fr 3,pI升高可能是由于CTL含量和去糖基化比例显著增加造成的.

表2 Fr 1—Fr 3的肽图分析结果
寡糖分析的结果见表3,表明:Fr 1—Fr 3均含有14种糖型,没有检测到含潜在免疫原性的糖型,如Neu5Gc、Gal-α-1和3Gal.糖型Man5的含量有轻微升高趋势 (从8.6%~24.8%),但其作为中性糖不影响pI值.其他糖型的含量在各个组分间没有显著性差异.
使用间接酶联免疫吸附法(ELISA) 测定单次静脉给予Fr 1、Fr 2、Fr 3和阿柏西普至SD雄性大鼠后的血浆药物浓度.方法学验证结果表明:该方法具有较高的特异性;且在0.469~30 ng/mL范围内线性良好,其中r为0.999;回收率、日内精密度和日间精密度范围分别为86.4%~113.2%、2.1%~7.9%和4.3%~10.6%.以上数据均符合方法学验证的要求.

表3 Fr 1—Fr 3的寡糖分析结果
Fr 1—Fr 3和阿柏西普的血浆药物浓度-时间曲线如图1所示. 使用Phoenix WinNonlin 6.3 非房室分析 (NCA) 计算药代动力学参数.其中,关键药代动力学参数包括浓度曲线下面积(AUC0-t)、清除率 (CL)、半衰期 (t1/2),结果如表4所示.阿柏西普的AUC0-42d为231 ± 43(μg/mL)·d,t1/2为4.14 ± 2.0 d,CL为44.3 ± 7.2 mL/d/kg.与阿柏西普相比,Fr 1的AUC0-42d,t1/2和CL值没有显著差异,因此可以看作是阿柏西普的类似物;Fr 2的AUC0-42d降低到17.1 ± 4.5(μg/mL)·d,t1/2降低到3.43 ± 1.8 d,CL升高到618 ± 161 mL/d/kg;Fr 3的AUC0-42d降低到2.49 ± 0.55(μg/mL)·d,t1/2降低到0.365 ± 0.066 d,CL升高到4 125 ± 880 mL/d/kg.表明:从Fr 1到Fr 3,组分的AUC0-42d和t1/2逐渐降低,CL逐渐升高,即PK特性逐渐变差.
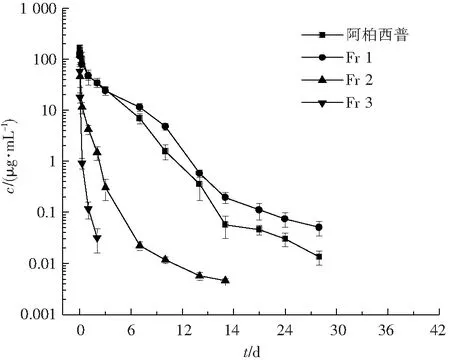
图1 Fr 1—Fr 3和阿柏西普的血浆药物浓度-时间曲线(mean ± SD,n=4)
Fig.1 Plasma concentration-time profiles of Fr 1-Fr 3 and Aflibercept (mean±SD,n=4)

表4 Fr 1—Fr 3和阿柏西普的关键血浆PK参数 (mean ± SD, n=4)
基于上述结果,Fr 1—Fr 3的主要差异包括CTL、Man5和唾液酸Neu5Ac含量的差异,如表5所示.从Fr 1到Fr 3,虽然Man5含量有升高趋势,但其作为中性糖不影响pI.且研究表明,Man5可能会增加单克隆抗体的CL[9],但不是影响Fc融合蛋白PK性质的关键糖基化模式[10-12].肽图分析和唾液酸分析的结果表明,从Fr 1到Fr 3,pI升高可能是由于CTL含量逐渐升高和唾液酸Neu5Ac含量依次降低造成的.然而,文献报道,CTL通过血液中羧肽酶的内源性循环从注射的抗体中快速去除,因此对产品的安全性和有效性影响极小[13].另有研究表明,唾液酸Neu5Ac对降低Fc融合蛋白的CL至关重要,主要作用机制是通过掩盖半乳糖 (Gal) 以防止相关蛋白被肝脏中的去唾液酸糖蛋白受体 (ASGPR) 识别并移除[14-15].因此,推测从Fr 1到Fr 3,组分的AUC0-t和t1/2逐渐降低,CL逐渐升高,可能是由于唾液酸Neu5Ac含量降低造成的.
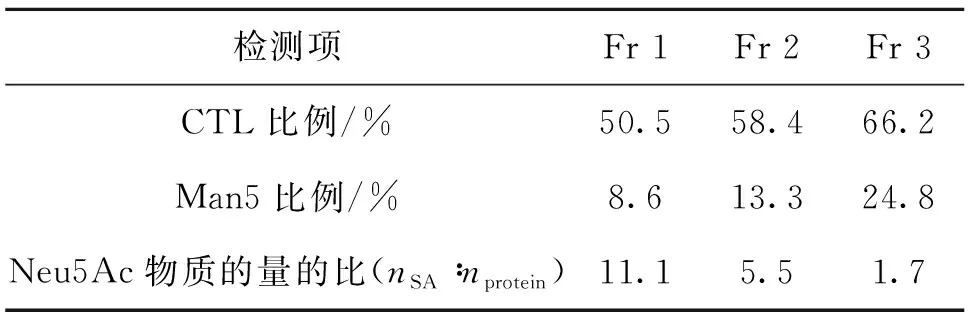
表5 Fr 1—Fr 3的主要差异比较
3 结 论
研究结果表明,从Fr 1到Fr 3,pI升高可能是CTL含量逐渐升高和唾液酸Neu5Ac含量依次降低的结果;组分的AUC0-t和t1/2逐渐降低,CL逐渐增加,推测可能是由于唾液酸Neu5Ac的含量降低造成的.因此,在阿柏西普类似药的研制过程中,为了确保产品的安全性和有效性,建议要控制唾液酸Neu5Ac的含量.

