13C6-酪氨酸标记的蛋清溶菌酶的表达及NMR测定
王瑞英,余 飞,2,刘万卉,2
(1.烟台大学新型制剂与生物技术药物研究山东省高校协同创新中心、分子药理和药物评价教育部重点实验室(烟台大学),山东 烟台 264005;2.绿叶制药集团有限公司,山东 烟台 264003)
核磁共振波谱(Nuclear magnetic resonance,NMR)技术是少数几种能在原子尺度上对蛋白质的精细三维结构进行表征的技术之一,目前能对分子质量高达几十万的蛋白质结构进行表征[1-3].采用15N和13C全同位素标记中等大小的蛋白质,NMR表征其结构并收录在蛋白质数据库(PDB)里[4-5].对分子质量大的蛋白质(>40 kU),因NMR信号重叠及峰宽增加,全同位素标记的样品已不能满足NMR表征蛋白质结构的要求.另外,某些蛋白质很难获得全同位素标记的样品,且其标记耗费昂贵.为了克服全同位素标记的难题,发展了一系列的蛋白标记技术,其中包括选择性标记技术,即仅对一到两种氨基酸进行标记[6-7].选择性标记可以大幅度提高蛋白质中特定氨基酸的信号,达到简化谱图的目的.
核磁共振研究中所利用的同位素标记蛋白大多是在大肠杆菌表达系统中得到的.大肠杆菌遗传背景清楚、操作简单且表达外源基因产物的水平远高于其他基因表达系统[8-10],是现阶段最常用的表达系统,也是获得同位素标记蛋白最为经济的一种表达系统[11-12].但大肠杆菌表达系统有其局限性,表达产物有时会形成不溶性的聚积物沉淀,称为包涵体.包涵体蛋白通常没有蛋白活性,需要进行变复性处理,折叠成天然结构的蛋白质[13-14].
蛋清溶菌酶(hen egg-white lysozyme,HEL)的酶学结构、分子结构以及酶蛋白基因结构都已经研究的很清楚,因此本文作为模型蛋白进行基础研究.已知HEL是由129个氨基酸残基组成的一条多肽链,分子质量为14.3 kU,含有4对二硫键,空间结构为较紧密的椭球形[15].酪氨酸(Tyr)为芳香族氨基酸,常位于蛋白质的疏水核心,且位于配基结合的界面上,其残基侧链上空间约束对于大部分蛋白质空间结构的研究具有非常重要的价值.HEL含有3个Tyr,对其芳香环的13C进行标记,可以简化核磁谱,便于重叠信号的区分,从而对酪氨酸的信号进行指认[13].本研究利用蛋清溶菌酶对酪氨酸的选择性标记进行了方法优化,其中包括诱导温度、诱导时间、诱导剂(IPTG)的诱导浓度、可溶性表达等,然后经过分离纯化,得到高纯度的目标蛋白,为进一步制备选择性标记的蛋白以及利用核磁研究蛋白质的结构与功能奠定基础.
1 实验部分
1.1 材料与仪器
1.1.1 菌株 大肠杆菌Ε.coliBL21(DE3)购自上海科研生物科技有限公司,HEL-pET15b(含6个His标签,酶切位点为NdeⅠ和XhoⅠ)重组质粒(图1)由南京金斯瑞生物科技有限公司合成.

图1 重组质粒HEL-pET15b图谱
1.1.2 试剂 酵母粉、胰蛋白胨、琼脂(OXOID)、氯化钠(国药集团化学试剂有限公司)、M9基础盐溶液2X(Thermo)、氨苄青霉素(北京全式金生物有限公司)、异丙基-β-D-硫代半乳糖苷(IPTG,翊圣生物)、蛋清溶菌酶、DTT、氧化型谷胱甘肽、还原型谷胱甘肽、盐酸胍、葡萄糖、氯化钙、盐酸镁(Sigma)、分子质量标准蛋白Marker(Thermo)、13C6-酪氨酸(CIL).
1.1.3 仪器 电子天平(METTLER TOLEDO)、高压灭菌锅(ZEALWAY)、恒温摇床(上海知楚)、培养箱(上海一恒科技)、高速低温离心机(Thermo)、电泳系统(Thermo)、凝胶成像仪(Bio-Rad)、核磁共振仪(Bruck 600 MHz)、紫外-可见分光光度计(Thermo NanoDrop 2000).
1.2 单菌落的培养与摇瓶培养
将表达载体pET-HEL转入到大肠杆菌Ε.coliBL21(DE3)中,得到携带有pET-HEL的BL21(pET-HEL)菌株,在含100 μg/mL Ampicillin LB(LB/Amp100)固体培养基平板上划线,37 ℃培养过夜.挑取单菌落接种至LB/Amp100液体培养基,37 ℃、220 r/min培养过夜,然后按照1∶20比例接种至M9培养基,37 ℃、200 r/min扩增培养,直到吸光度A600为0.6~0.8.用于后续优化培养基的选择.
1.3 蛋白质表达条件的优化
1.3.1 诱导温度的选择 取“1.2”所得菌液3管,每管5 mL,加入IPTG至终浓度为0.6 mmol/L,分别于25 ℃、30 ℃、37 ℃,200 r/min诱导6 h,各收集菌液1 mL,离心,弃上清,加入100 μL Loading Buffer,5 μL DTT,80 ℃煮沸5 min,取15 μL进行SDS-PAGE检测.
1.3.2 诱导剂浓度的选择 取“1.2”所得菌液6管,每管5 mL,加入IPTG至终浓度分别为0、0.2、0.4、0.6、0.8、1.0 mmol/L,于37 ℃、200 r/min诱导培养6 h,各收集菌液1 mL,按照“1.3.1”方法进行样品处理与分析.
1.3.3 诱导时间的选择 取“1.2”所得菌液1管15 mL,加入IPTG至终浓度为0.6 mmol/L,于37 ℃、200 r/min诱导培养,分别于0、2、4、6、8、10、20 h取样1 mL,按照“1.3.1”方法进行样品处理与分析.
1.3.4 HEL的可溶性分析 取诱导培养的菌液10 mL,5 000 r/min离心10 min,弃上清,沉淀反复冻融几次,加入2 mL裂解液悬浮,超声裂解,4 ℃、12 000 r/min离心10 min,分别收集上清和沉淀,加入Loading Buffer与DTT,各取15 μL进行SDS-PAGE分析.
1.4 HEL的大量培养与分离纯化
1.4.1 HEL的大量表达以及包涵体的变性与复性 在选定的蛋白质表达条件下,培养菌液1 L,4 ℃、4 500 r/min离心30 min收集菌体,加入50 mL PBS悬浮沉淀,反复冻融3次,离心,弃上清,加入50 mL裂解液(PBS缓冲液,pH值7.0),超声裂解,离心,弃上清,收集沉淀.将包涵体沉淀用50 mL变性溶液(20 mmol/L Tris,50 mmol/L NaCl,6 mol/L GuHCl,10 mmol/L DTT,pH值7.0)溶解,室温放置2 h;然后缓慢滴加至500 mL复性溶液(50 mmol/L Tris,5 mmol/L GSH,0.5 mmol/L GSSG,pH值7.0),搅拌,过夜,离心,取上清,0.45 μm微孔滤膜过滤.
1.4.2 Ni柱亲和层析分离纯化HEL 取复性溶液流穿2 mL Ni柱亲和层析液,分别用洗涤液(50 mmol/L NaH2PO4,300 mmol/L NaCl,2 mmol/L咪唑,pH值8.0)洗涤3~4次,洗脱液(50 mmol/L NaH2PO4,300 mmol/L NaCl,50 mmol/L咪唑)洗脱6~8次,取15 μL进行SDS-PAGE分析.
1.5 选择性标记蛋白样品的表达
按照上述优化的最佳实验条件进行大量表达.1∶20转至1 L的M9培养基时,加入100 mg的13C6-酪氨酸与50 mg其他19种未标记的氨基酸进行扩增培养,至吸光度A600为0.6~0.8时加入0.4 mmol/L IPTG于37 ℃诱导8 h,然后按照上述变复性方法与分离纯化条件得到选择性标记酪氨酸的蛋清溶菌酶.Ni柱纯化后的蛋白质进行超滤(3 000 MW),然后用紫外分光光度计测定蛋白浓度.
1.6 选择性标记HEL的NMR测定分析
1.6.1 NMR样品的制备 将所得到的蛋白溶液置换至500 μL的氘代乙酸盐缓冲溶液(pH值3.6)中,然后转移至5 mmol/L的核磁管中.另取5 mg自然丰度的蛋清溶菌酶溶于500 μL的氘代乙酸盐缓冲液(pH值3.6),转至5 mmol/L的核磁管中.
1.6.2 测定NMR谱图 采用Bruker 600MHz 核磁共振波谱仪测定,仪器探头为5 mmol/L超低温探头,进行1H-13C HSQC谱图测定.设定的HSQC测定条件为:测定温度为25 ℃、T1扫描次数scan为32次,increment为128次.
2 结果与讨论
2.1 蛋白表达条件的优化
2.1.1 诱导温度对蛋白表达的影响 质粒pET-15b选用的酶切位点为NdeⅠ和XhoⅠ,构建质粒时含有6个his标签便于后续纯化,故pET-HEL诱导表达的蛋白分子质量约为16.61 kU,经过诱导培养后可见目标蛋白的条带.培养温度在25~37 ℃的范围内,37 ℃蛋白表达量相对最高,后续实验均采用37 ℃进行诱导培养(图2).

M.蛋白标准Marker; 1.25 ℃; 2.30 ℃; 3.37 ℃
Fig.2 SDS-PAGE pattern of HEL expression at different tem-eratures
2.1.2 诱导浓度对蛋白表达的影响 诱导剂IPTG浓度在0~1.0 mmol/L范围内,蛋白表达量在0.8 mmol/L时降低,0.2~0.6 mmol/L之间差别不大,选取中间值0.4 mmol/L作为诱导浓度(图3).

M.蛋白标准Marker; 1—6为诱导浓度0、0.2、0.4、0.6、0.8、1.0 mmol·L-1表达组
图3 不同诱导浓度下HEL表达的SDS-PAGE
Fig.3 SDS-PAGE pattern of HEL expression at different con-centration of inducer
2.1.3 诱导时间对蛋白表达的影响 HEL蛋白表达量开始随时间延长而增加,到8 h后表达量差异不明显(图4),考虑到时间成本,后续实验均选择诱导表达8 h.
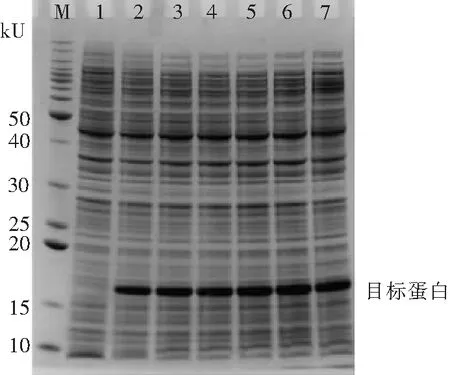
M.蛋白标准Marker; 1—7为诱导时间0、2、4、6、8、10、20 h表达组
Fig.4 SDS-PAGE pattern of HEL expression at different time
2.2 HEL的可溶性分析
将菌体超声上清与沉淀进行SDS-PAGE测定,转化菌经裂解液处理之后,上清中没有目的蛋白条带,而在沉淀中出现了明显的蛋白条带,提示表达HEL主要是以包涵体形式进行表达,与文献一致[16].说明蛋白质的结构折叠不正确,因此需要进行变复性处理(图5).
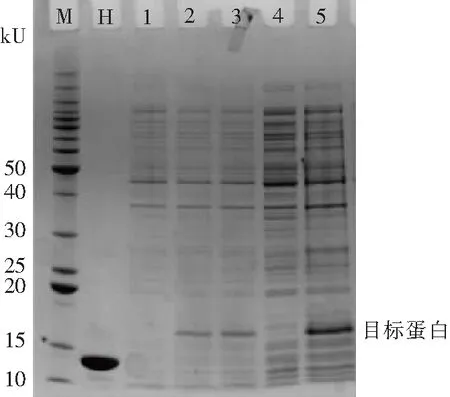
M.蛋白标准Marker; H.天然HEL; 1.诱导前; 2.诱导后; 3.诱导后; 4.超声上清; 5.超声沉淀
图5 可溶性分析的SDS-PAGE
Fig.5 SDS-PAGE pattern for soluble analysis
2.3 HEL的大量表达与分离纯化
按照前期的优化条件扩大表达后得到菌体,超声破碎获得包涵体,经过盐酸胍变性与稀释复性之后,将复性溶液过Ni柱进行纯化,然后进行SDS-PAGE分析检测,测定结果显示:变性上清中含有目标蛋白,Ni柱纯化的洗脱液的SDS-PAGE结果显示纯化后得到单一条带的蛋白带,而在变性后离心沉淀以及流穿与洗涤液中都没有目标蛋白条带的出现(图6).

M.蛋白标准Marker; H.天然HEL; 1.变性上清; 2.变性沉淀; 3.复性上清; 4.流穿液; 5.洗涤液 6.洗脱液
图6 Ni柱纯化的SDS-PAGE
Fig.6 SDS-PAGE pattern of purified protein through Ni col-umn
2.4 蛋白收率
紫外分光光度法测得蛋白收率为3 mg/L培养基.
2.5 天然与标记状态下HEL的NMR谱图
天然与标记状态下HEL的HSQC全谱如图7所示,图谱中的横纵坐标一致,图7A为天然状态下HEL的HSQC谱,图7B为标记状态下HEL的HSQC谱,a部分为烷烃区域;b部分为芳香环区域.由图7可知,自然丰度下HEL的信号重叠较为严重,标记后主链区(A烷烃区域)信号明显减少,芳香环部分的信号只有标记氨基酸的信号.
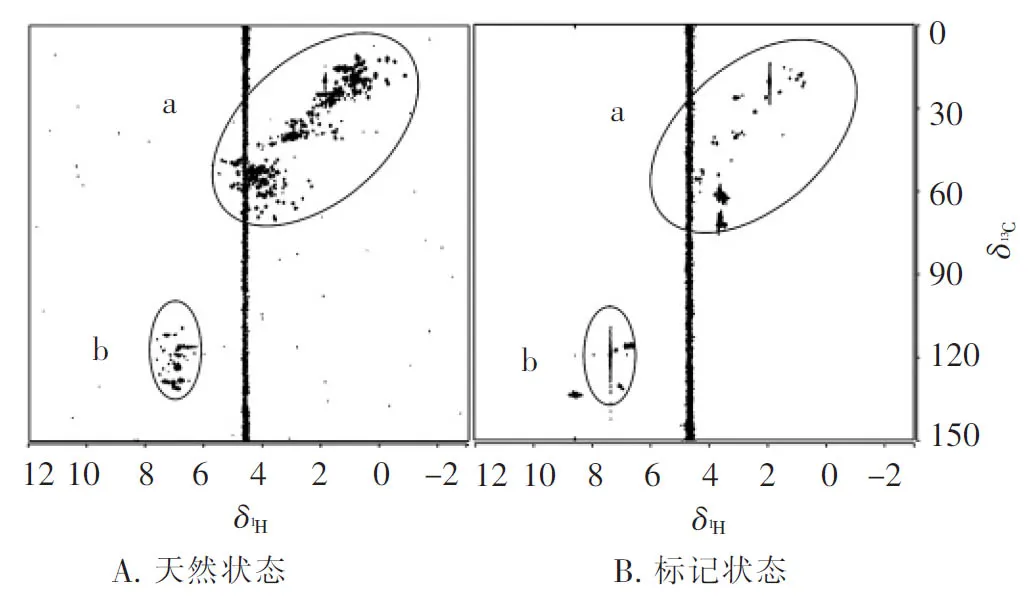
图7 天然与标记状态下HEL的HSQC全谱
图8为天然与选择性标记下HEL的HSQC谱图的芳香环部分谱图.图中信号主要是酪氨酸的信号,其中c部分为溶剂与缓冲盐溶液的信号.经过信号归属,a为酪氨酸α部分的CH信号,b为酪氨酸β部分的CH信号.

图8 天然与标记状态下HEL的HSQC谱图芳香环部分
Fig.8 The part of aromatic rings of HSQC spectrum of HEL in natural and labeled state
3 结 论
通过对蛋清溶菌酶(HEL)中酪氨酸(Tyr)进行选择性标记,阐明了选择性标记HEL的表达方法,并将利用此法得到的标记的蛋清溶菌酶与天然的蛋清溶菌酶进行HSQC谱图的比较,结果表明标记的蛋清溶菌酶简化了核磁谱图,简化后Tyr的信号更加清晰,使得核磁信号指认困难的问题得以解决.为将来蛋白质的特殊标记提供了指导意义,同时为未来蛋白质核磁研究中的特殊标记样品的制备提供了节约成本与人力的借鉴意义.

