红鳍东方鲀精原干细胞鉴定、分离及纯化
任玉芹 周 勤 孙朝徽 宋立民 于清海 姜秀凤 王玉芬 王青林
(中国水产科学研究院北戴河中心实验站,秦皇岛 066100)
红鳍东方鲀(Takifugu rubripes)因其味鲜肉嫩,营养价值高, 是我国北方海水鱼养殖的主要种类之一[1]。相比红鳍东方鲀鱼肉, 俗称“白子”的雄鱼精巢更是被人们视为珍品。由于养殖市场对雄鱼苗种的需求, 科研工作者开始重视对其性别选择育种尤其全雄化技术[2—6]。近十年来, 激素诱导性转化在单性鱼制备中是一个十分有效并广泛采用的技术[7]。本课题组已经通过17-β雌二醇成功诱导出伪雌鱼, 待其性成熟后与天然雄鱼人工授精, 获得全雄苗种的父本来源——“YY”超雄鱼, 最终实现全雄苗种规模化生产。但是红鳍东方鲀需要3年才能达到性成熟, 而且亲鱼个体较大(体重2—5 kg), 需要大量的时间和空间来保存亲鱼。因此通过激素诱导最终获得全雄苗种的选择育种技术存在养殖成本高的问题。
近年来, 生殖细胞移植技术(Germ cell transplantation, GCT)在各种鱼类中广泛应用[7—13], 均获得了源自供体的功能配子或后代。一般地进行生殖干细胞移植多采用的细胞是原始生殖细胞(Primordial germ cells, PGCs)、精原细胞(Spermatogonial, SG)和卵原细胞(Oogonia, OG)[14]。精原细胞包括A型精原细胞、中间型精原细胞和B型精原细胞[15], 而进行细胞移植的主要是A型精原干细胞, 即精原干细胞(Spermatogonial Stem Cells, SSCs)。与PGCs相比, SSCs不仅同样具有自我更新、多能性的干细胞特点和分化并发育为雌雄配子的潜力[16],而且还具有细胞量大, 分离方法简易等优点。Okutsu等[17]利用SSCs移植技术路线制备出了虹鳟YY“超雄鱼”并最终生产了全雄虹鳟苗种。星点东方鲀与红鳍东方鲀同属东方鲀属, 其性成熟时间短(10个月左右)、个体较小(10—15 cm)是红鳍东方鲀的理想受体。以红鳍东方鲀精原干细胞为供体,选择星点东方鲀雌鱼为受体, 利用精原细胞的性别可塑性, 可以获得携带Y染色体的卵子, 这将降低红鳍东方鲀亲鱼养殖成本, 而且也大大加速红鳍东方鲀的选择育种工作, 缩短实现全雄苗种规模化生产的周期。
本文进行的工作为红鳍东方鲀精原干细胞成功移植技术不可或缺的一步, 拟开展红鳍东方鲀精原干细胞鉴定、分离并比较不同发育期精原干细胞量以及精原干细胞纯化研究, 力求获得比例相对较高的供体精原细胞悬液, 旨在为红鳍东方鲀精原干细胞移植成功提供部分基础数据参考。
1 材料与方法
1.1 实验用鱼
实验用鱼采自河北省唐山市天河水产有限公司。2018年1月11日随机采集22月龄鱼3尾, 2018年6月21日随机采集14月龄4尾。实验鱼实验前养殖于中国水产科学研究院北戴河中心实验站。在实验时, 对红鳍东方鲀雄鱼样品进行体长、体重数据采集, 然后剪鳃放血。解剖取出性腺, 称重, 统计各月龄雄鱼生长情况(表 1)。

表 1 各月龄生长情况Tab. 1 The body weight and length at different age
1.2 精巢细胞悬液制备
对各月龄雄鱼统计生长情况后采集性腺样, 用4%多聚甲醛保存备用。每个月龄实验鱼做4个重复。各月龄雄鱼性腺样品分别称取300 mg左右精巢组织放入含有L-15培养基的凹面皿中, 剥离精巢薄膜、剪碎组织。参考Takeuchi等[18]酶消化法, 按照100 mg组织加入1 mL酶消化工作液, 每隔0.5h吹打1次。酶消化工作液包括: 0.25% 胰蛋白酶(Worthington公司, LS004454), 0.05% DNA酶Ⅰ(Sigma公司, 11284932001), 5% 胎牛血清(Gibco公司, 16000-044), 溶剂为L-15。在25℃下消化3h后, 依次过滤孔径100 μm、40 μm细胞筛网, 300×g离心5min, 清洗2次, 最终调整细胞浓度, 将细胞悬浮于含有5%胎牛血清L-15培养基中, 并用台盼蓝染色, 鉴定细胞活性, 计算活细胞数量。并将各月龄抽取1个重复的细胞悬液进行细胞涂片, 4%多聚甲醛固定备用。
1.3 Percoll密度梯度纯化
每个月龄实验鱼做3个重复。参考张晓丽等[19]对细胞悬液进行非连续Percoll密度梯度离心纯化精原干细胞。先按照1.5 mol/L NaCl∶Percoll=1∶9比例将Percoll原液配制成生理渗透压, 然后用生理盐水将已达到生理渗透压的Percoll液配制成10%、30%和50%浓度梯度(Percoll纯化参数已经过多次实验优化), 制备Percoll梯度液, 将待分离的细胞悬液置于梯度最上层, 800×g离心30min后, 将各细胞带小心移出, 清洗2次, 浓缩至不同的容积, 吹打均匀, 取10 μL台盼蓝染色, 计算活细胞量和A型精原细胞占比, 在荧光显微镜下拍照。将余下的细胞进行细胞涂片, 4%多聚甲醛固定备用。
1.4 组织学及免疫荧光分析
对性腺组织样进行常规石蜡连续切片, 切片厚度5 μm。部分切片进行苏木素-伊红(HE)染色, 中性树胶封片, Leica (BM 4000)光学显微镜镜检并拍照。部分切片进行免疫荧光分析。切片脱蜡复水,抗原修复, 3%过氧化氢溶液室温孵育25min阻断内源性过氧化物酶, BSA封闭, 加入一抗∶斑马鱼Vasa兔多克隆抗体(Abcam, ab209710, 1∶100) 4℃孵育过夜, 第2天洗涤甩干切片加入羊抗兔荧光二抗(谷歌生物, GB21303, 1∶300, 阳性红光), DAPI染液(谷歌生物, G1012, 1∶500)复染细胞核, 最后脱水封片, 全组织切片扫描观察。细胞涂片免疫荧光分析,需先加入100 μL破膜液(谷歌生物, G1204), 室温孵育10min进行细胞破膜, 然后按照上述切片免疫荧光步骤, 加一抗、二抗、DAPI复染细胞核、封片、扫描观察。同一样本做阴性对照。
1.5 统计分析
对14月龄和22月龄2组性腺提取精原干细胞量和占比进行统计, 采用SPSS 22.0软件进行独立样本T检验, 是否存在显著性差异。分别对纯化前后不同月龄的细胞存活率、精原干细胞量、精原干细胞占比进行单因素方差分析和LSD多重比较, 查看各细胞悬液中A型精原干细胞量、占比是否存在显著性差异。
2 结果
2.1 精原干细胞鉴定分析
通过各级生殖细胞形态标准很容易将精原细胞与精母细胞、精细胞分离开。而不同世代的精原细胞主要依靠细胞或者细胞核大小和精小囊内生殖细胞数目(斑马鱼Danio rerio、虹鳟Oncorhynchus mykiss)进行划分[20,21]。精原干细胞主要是指A型精原干细胞。A型精原干细胞是精巢中最大的生殖细胞, 细胞核膜呈不规则或者圆形, 显著大于周围的细胞; 细胞核直径约为8.5—9.7 μm, 有1—2个致密核仁, 核质比高于精巢中其他生殖细胞,且精小囊内生殖细胞数为1个。A型分化精原细胞比A型精原细胞小, 细胞核直径约为5.5—7 μm, 核仁靠近细胞边缘位置, 且精小囊内生殖细胞数成组出现(2、4和8); B型精原细胞远小于A型精原细胞,呈瘦长型或者圆形, 细胞直径约为4.8—6 μm, 细胞核直径约为4.5—5.5 μm, 有1—2个较小核仁, 且染色质较后期A型精原细胞增多(细胞核边缘斑点增多), 精小囊内细胞数为14—200个(图 1、图 2)。通过对14月龄和22月龄的红鳍东方鲀性腺组织学连续切片分析发现: 14月龄雄性精巢中的生殖细胞大部分为精原细胞, 以A型精原干细胞为主, B型精原细胞次之(图 1A)。而22月龄精巢处在Ⅲ期末、Ⅳ期初, 此时精巢中存在A型精原干细胞、B型精原细胞、精母细胞等各级生殖细胞(图 1D)。
随着基因组时代的到来, 有关调控鱼类生殖细胞的发育的基因研究也取得一定的进展。目前, 在鱼类中鉴定分析生殖细胞的标记基因日益增多, 包括oct4、vasa、nanos、dnd和dazl等。其中,vasa基因是DEAD-box家族成员之一, 其产物为DEAD盒RNA螺旋酶, 参与生殖质的聚合, PGC的形成及迁移以及核周质蛋白的形成等。Vasa蛋白在多数硬骨鱼的PGC、卵原细胞、卵母细胞、精原细胞表达量高。随着减数分裂的进行, 一些鱼类减数后期生殖细胞(如次级精母细胞、精细胞及成熟的卵)中表达不明显或未发现表达[22]。红鳍东方鲀雄性精巢组织免疫荧光分析发现:vasa基因在精原细胞表达, 在精母细胞中弱表达(图 1、图 2), 跟斑马鱼、半滑舌鳎(Cynoglossus semilaevis Gunther)等硬骨鱼类Vasa蛋白表达相似[20,23]。根据各级生殖细胞形态标准以及Vasa蛋白在精原细胞中呈现的荧光信号强于精母细胞, 将精原细胞与体细胞和精母细胞区分开, 最终根据A型精原干细胞形态大小、内部结构及精小囊内生殖细胞数目鉴别出精原干细胞。
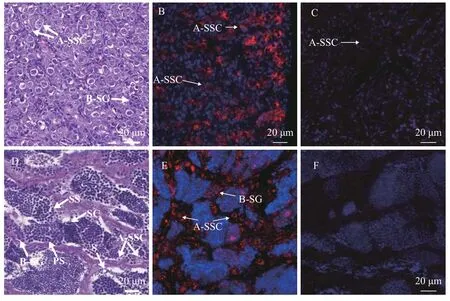
图 1 不同月龄雄鱼精巢组织切片及Vasa蛋白在精巢中的定位Fig. 1 Histological sections of gonad at different agesA.14月龄雄鱼精巢组织切片; B.14月龄雄鱼Vasa蛋白在精巢中的定位; C. 14月龄雄鱼组织免疫荧光阴性对照; D. 22月龄雄鱼精巢组织切片; E. 22月龄雄鱼Vasa蛋白在精巢中的定位; F. 22月龄雄鱼组织免疫荧光阴性对照; A-SSC. A型精原干细胞; B-SG. B型精原细胞; PS. 初级精母细胞; SS. 次级精母细胞; SC. 精细胞; S. 精子A. The testis histology of 14-month-old fish; B. Immunolocalization of Vasa protein in the testis of 14-month-old fish; C. Tissue immunofluorescence negative control of 14-month-old male fish; D. The testis histology of 22-month-old fish; E. Immunolocalization of Vasa protein in the testis of 22-month-old fish; F. Tissue immunofluorescence negative control of 22-month-old male fish; A-SSC. type A spermatogonial stem cell; B-SG. type B spermatogonia; PS. primary spermatocyte; SS. secondary spermatocyte; SC. sperm cell; S. sperm
2.2 精原干细胞分离结果分析
经过组合酶消化处理、过滤和清洗, 最终得到不同月龄的红鳍东方鲀精巢单细胞悬液。2个月龄的细胞存活率均高达90%以上, 且两者之间不存在显著性差异(P>0.05)。通过普通光学观察和Vasa蛋白在生殖细胞中的免疫荧光定位(图 3), 分析比较14月龄和22月龄精原干细胞发现(表 2): 红鳍东方鲀14月龄精原干细胞占比为(72.12±9.39)%, 显著高于22月龄(P<0.05); 然而22月龄平均每毫克精巢组织所含精原干细胞量为(10.89±3.29)×104, 显著性高于14月龄(P<0.05); 14月龄和22月龄的性腺指数之间存在显著性差异(P<0.05)。
2.3 精原干细胞纯化结果分析
通过Percoll密度梯度离心纯化后, 不同浓度的Percoll梯度液将精巢细胞悬液从上到下分为1、2、3三层, 将各细胞带小心吸出清洗2次, 进行普通光学观察和细胞免疫荧光分析(图 4)发现: 1细胞带主要为A型精原细胞和B型精原细胞(图 4A、4D)2细胞带主要为精母细胞和B型精原细胞及少量的A型精原细胞(图 4B、4E), 3细胞带为血细胞、精细胞及精子(图 4C、4F)。14月龄雄鱼精巢生殖细胞主要分布在1层, 而22月龄雄鱼精巢生殖细胞分布于1、2、3三层。由表 3可知, 14月龄和22月龄纯化后存活率较纯化前降低, 但与纯化前差异不显著(P>0.05)。14月龄1细胞带精原干细胞占比远高于其他组别(P<0.05)。2个月龄平均每毫克精巢组织获得的精原干细胞量均显著地低于纯化前同一月龄(P<0.05), 且纯化后22月龄显著高于纯化后14月龄(P<0.05)。
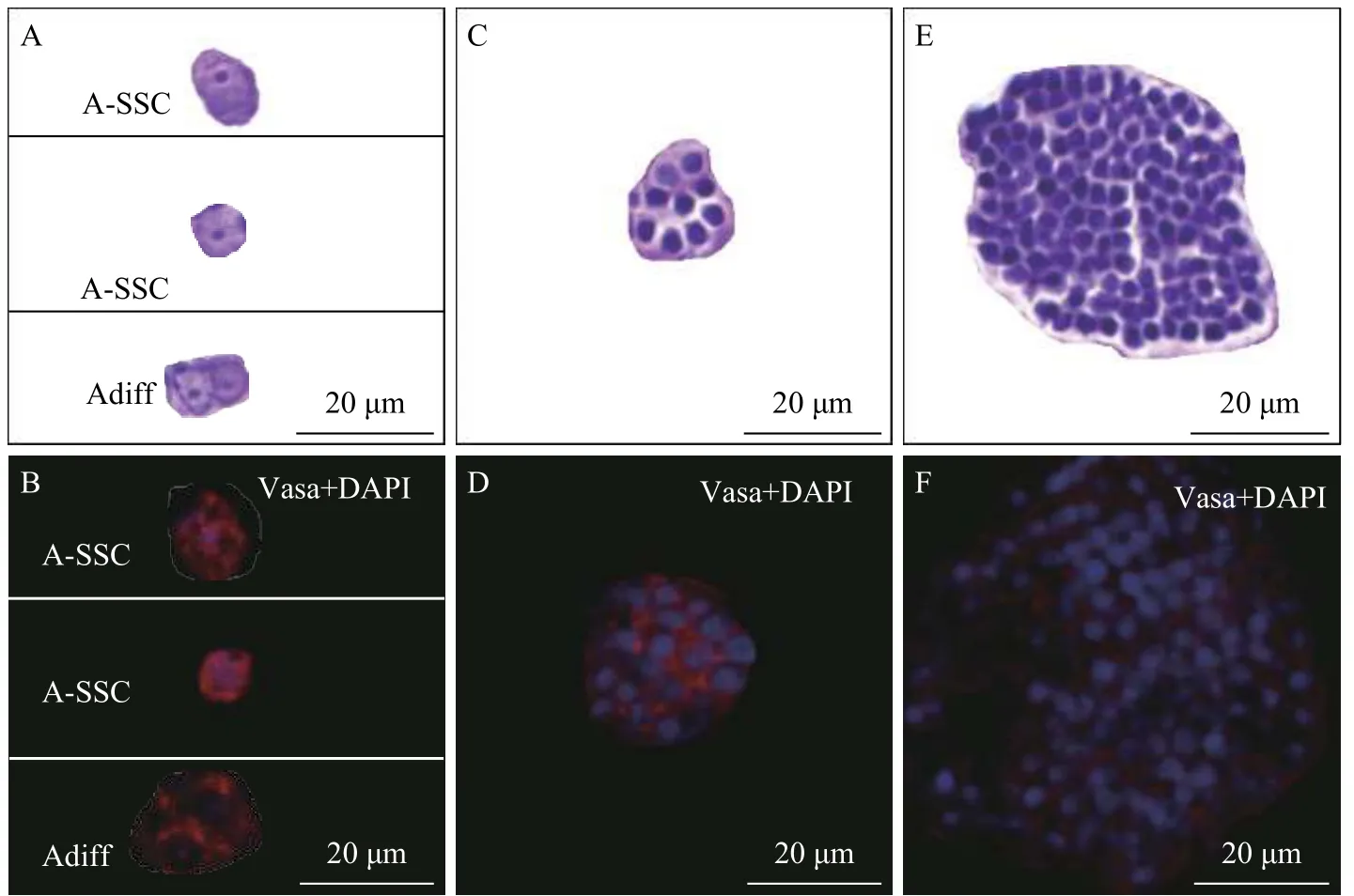
图 2 精小囊内不同级别生殖细胞特征观察Fig. 2 The characteristics of germ cells in cystsA、B. 精小囊内各种A型精原细胞特征观察; C、D. 精小囊内B型精原细胞特征观察; E、F. 精小囊内精母细胞特征观察; A-SSC. A型精原干细胞; Adiff. A型分化精原细胞A, B. The characteristics of A-type spermatogonia in cysts; C, D. The characteristics of B-type spermatogonia in cysts; E, F. The characteristics of spermatocyte in cysts; A-SSC. type A spermatogonial stem cell; Adiff. type A differentiated spermatogonia

图 3 细胞普通光学观察及Vasa蛋白在雄性生殖细胞中的免疫荧光定位Fig. 3 Histology and immunolocalization of Vasa protein in the germ cells of malesA. 细胞普通光学观察; B. Vasa蛋白在雄性生殖细胞中的免疫荧光定位; A-SSC. A型精原干细胞; B-SG. B型精原细胞; PS. 初级精母细胞; SS. 次级精母细胞; SC. 精细胞; S. 精子; BC. 血细胞A. The histology of cells; B. The immunolocalization of Vasa in the germ cells of males; A-SSC. type A spermatogonial stem cell; B-SG.type B spermatogonia; PS. primary spermatocyte; SS. secondary spermatocyte; SC. sperm cell; S. sperm; BC. Blood cells
3 讨论
鱼类精原干细胞(Spermatogonial stem cells,SSCs)起源于原始生殖细胞PGCs, PGCs在胚胎发育过程中迁移到性腺原基形成性原细胞, 性原细胞再发育成单个A型未分化精原细胞(type A undifferentiated spermatogonia, Aund)。随着性腺发育, Aund进行自我更新和分裂形成分化的A型精原细胞(type A differentiated spermatogonia, Adiff)。Adiff经过数次分裂逐步形成B型精原细胞, B型精原细胞经过有丝分裂和减数分裂最终形成精子[15,24,25]。普遍认为Aund才具有干细胞特性[15,20]。因此, 本文将A型未分化的精原细胞算作红鳍东方鲀的精原干细胞。
鱼类精原干细胞常采用的鉴定方法包括形态学鉴定和标记基因鉴定。红鳍东方鲀精原干细胞形态特征同其他硬骨鱼类相似, 细胞的直径为7.3—13.3 μm, 细胞核直径为6—9.7 μm, 有1—2个致密核仁, 是精巢中最大的细胞(图 1)。vasa基因属于ATP依赖的RNA解旋酶中DEAD-box家族, 是鱼类生殖细胞的第一个标记基因。斑马鱼vasa基因的分离鉴定为鱼类生殖细胞研究开创了新纪元, 即应用分子生物技术研究生殖细胞时代[26]。Vasa蛋白序列在物种进化中高度保守, 因此可以通过免疫组化的方法用同一个Vasa抗体来检测许多不同物种的Vasa蛋白的表达情况[27]。本文采用的斑马鱼抗体相对的抗原位点与红鳍东方鲀相应的抗原位点同源率为79%, 且通过对红鳍东方鲀性腺组织westernblot实验, 验证了斑马鱼Vasa抗体对红鳍东方鲀性腺Vasa抗原位点特异性。因此, 本文采用斑马鱼Vasa抗体检测红鳍东方鲀精巢生殖细胞的Vasa蛋白表达情况。通过对红鳍东方鲀精巢组织以及精巢组织分离后的细胞进行免疫荧光检测和比对细胞核的大小, 鉴别出精原干细胞。

表 2 14月龄和22月龄精原干细胞分离结果Tab. 2 Separation of SSCs at 14-months and 22-months old
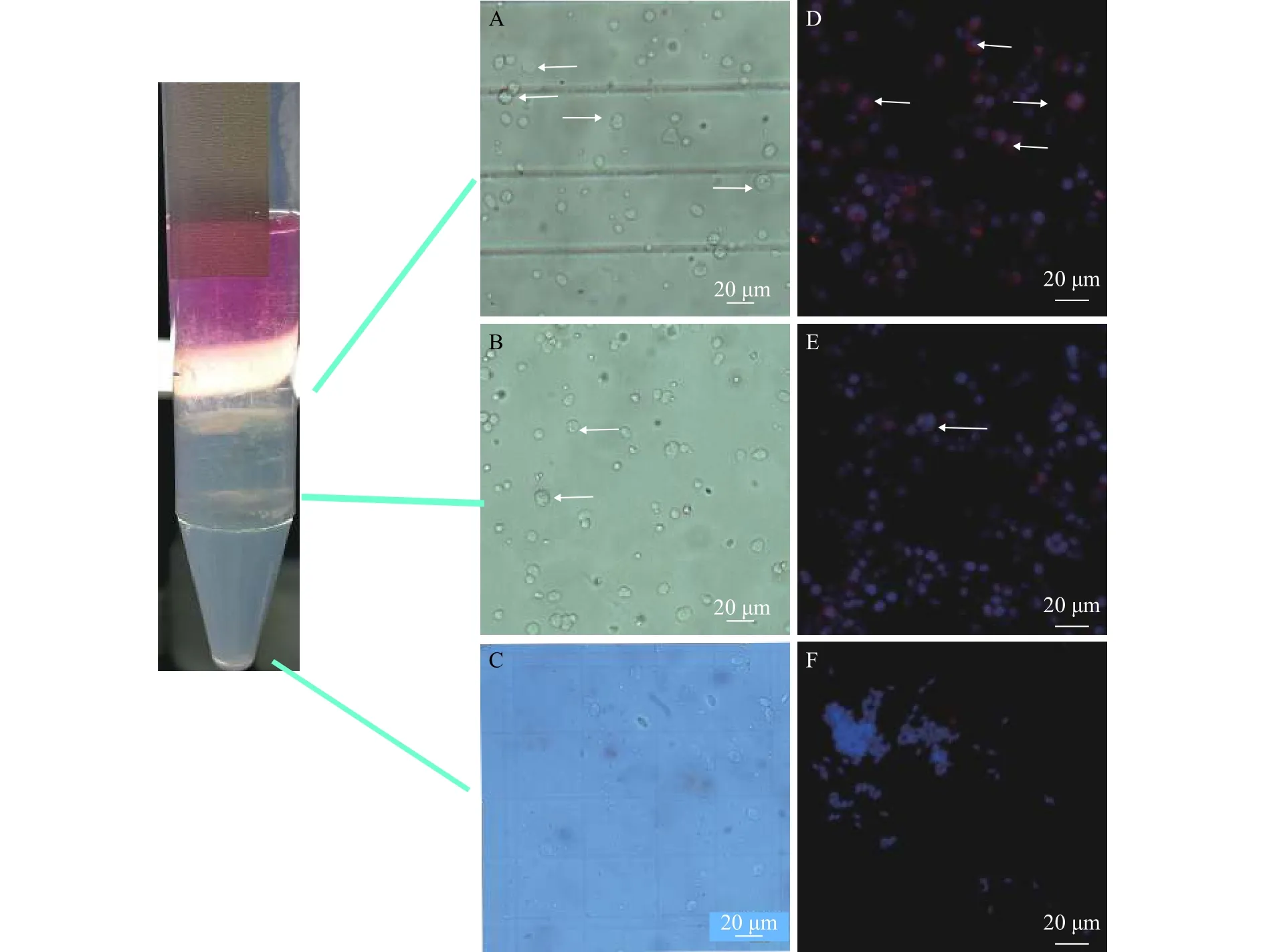
图 4 精原干细胞纯化结果Fig. 4 Enrichment of SSCsA-C. 纯化后各层细胞带普通光学观察; E-H. Vasa蛋白在生殖细胞中的免疫荧光定位; 白色箭头指向A型精原细胞A-C. Histological observation of each cell zone; E-F. Immunolocalization of Vasa protein in germ cells; The white arrow points to SSCs
如何获得高比例的精原干细胞, 有2个关键要素。其中一个关键因素是获得良好的单细胞悬液。分离出良好的单细胞悬液跟选择的红鳍东方鲀月龄和酶消化程序息息相关。随着性腺发育,SSCs逐步分化各级生殖细胞, SSCs的数量和所占比例都会越来越少, SSCs分离纯化变得比较困难[28]。本文通过对生殖季节前后雄性精巢组织切片观察发现: 14月龄雄鱼精巢处在Ⅱ期初, 以A型精原细胞为主; 22月龄精巢发育至Ⅳ初, 出现了少量的精子。理论上, 选择14月龄进行精原干细胞分离, 可获得比22月龄相对较高精原干细胞占比和较高的每毫克精巢组织获得的精原干细胞量。本课题组通过比较分析2个月龄成鱼精原干细胞量以及占比发现, 14月龄精原干细胞占比远高于22月龄精原干细胞占比, 与理论一致。而红鳍东方鲀14月龄精巢组织由于过小, 多余的结缔组织和外膜剥离不彻底,故导致14月龄平均每毫克精巢组织获得的精原干细胞量显著低于22月龄, 与理论不符。红鳍东方鲀精巢没有哺乳动物睾丸那么硬, 所以本实验采用比较缓和的胰蛋白酶进行消化, 使生殖细胞和支持细胞释放出来, 并用DNA酶Ⅰ将从剪碎的细胞游离出来的DNA分解, 防止细胞出现抱团现象。结果证明, 胰蛋白酶和DNA酶Ⅰ组合方法能够获得较为满意的单细胞悬液。
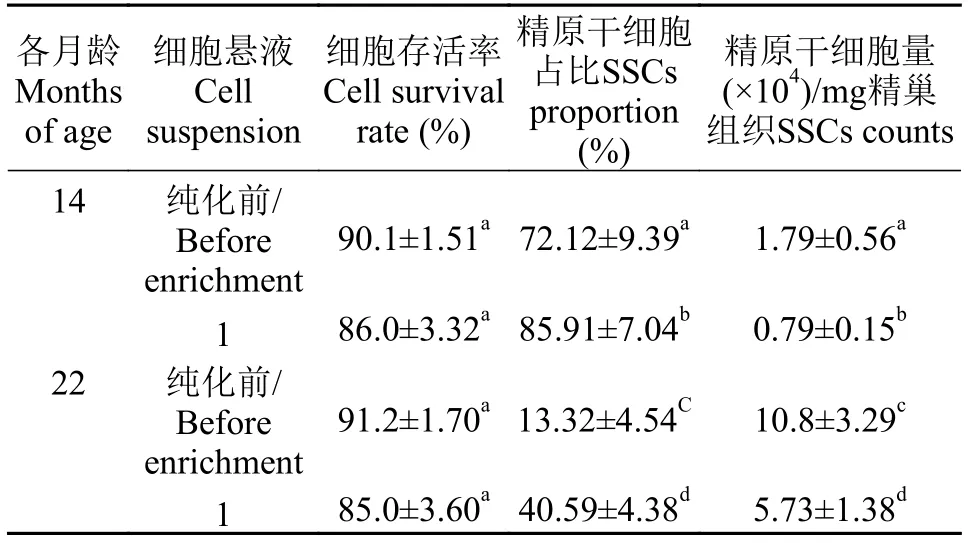
表 3 各月龄纯化前后细胞存活率、精原干细胞占比及精原干细胞量比较Tab. 3 Comparison of cell survival rates/ SSCs proportion/ SSCs counts before and after enrichment
获得高比例的精原干细胞的另一个关键因素是对分离的单细胞悬液进行SSCs纯化。SSCs纯化的方法比较常用的有差异贴壁法、不连续Percoll密度梯度离心法等[29,30]。本实验采用不连续Percoll密度梯度离心法进行SSCs纯化。在SSCs纯化实验前, 进行了多次的Percoll密度梯度离心实验,优化Percoll梯度参数。起初, 设置10%、30%、40%、50%和60%共计5个梯度, 纯化后发现: 精原干细胞主要集中在10%—30%梯度, 30%—40%、40%—50%的2个细胞带精原干细胞量非常少, 而50%—60%看不到细胞带, 底部为精细胞或者血细胞(图 5)。所以本实验将Percoll梯度调整为10%、30%和50%三个梯度, 经过重复实验获得了相对较高比例和较高数量精原干细胞。分离的14月龄精巢细胞悬液主要分布在10%—30%, 30%—50%检测不到生殖细胞, 50%以下为血细胞。推测如果将分离前实验鱼放血干净, 可以不用做Percoll密度梯度纯化, 依然可获得相对较高比例和较高数量的精原干细胞。虽然22月龄精巢分离纯化获得的每毫克精巢组织中精原干细胞量高于14月龄纯化前后,但精原干细胞占比显著低于14月龄纯化前后精原干细胞占比。综合分析, 用本文的分离纯化方法,14月龄更易获得所需的精原干细胞悬液。

图 5 精原干细胞纯化预实验结果Fig. 5 The pre-experimental results of enrichment of SSCs

