氮负荷升高对苦草(Vallisneria natans)和穗花狐尾藻(Myriophyllum spicatum)生长的影响
李启升,胡忠军,李永吉 ,何 虎,韩燕青 ,靳 辉,李宽意 ,6*
(1.上海海洋大学水产科学国家级实验教学示范中心,上海 201306;2.上海海洋大学农业部鱼类营养与环境生态研究中心,上海201306;3.上海海洋大学上海水产养殖工程技术研究中心,上海 201306;4.中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,南京 210008;5.岳阳市水产科学研究所,湖南 岳阳 414001;6.中国科学院大学中丹学院,北京 100049)
随着工农业生产的发展、化学肥料使用量的增加以及人类生活污水的直接排放,河流湖泊等地表水的氮(N)、磷(P)元素污染日益严重[1],过量N、P的输入也被认为是湖泊富营养化的主要原因[2-4]。控源截污是富营养湖泊能够实现生态修复的前提条件,大量研究表明削减外源P负荷是控源截污工作的重点[5-6]。然而,对于控N(削减外源N输入)的必要性一直存在争议。部分学者认为控N会促进固氮蓝藻的生长,其固氮作用会弥补外源N输入的不足,使湖泊保持富营养状态[7-9]。而其他学者则认为N限制同样广泛存在于湖泊生态系统中,藻类的固氮作用不足以抵消削减的外源N负荷,因此在控源截污工作中,N、P均需要控制[10-13]。目前,在我国的污水处理中,P仍是主要的削减指标,尾水中的N浓度较高。例如,《城镇污水处理厂污染物排放标准》(GB 18918—2002)的一级A标准中TP达标排放浓度为0.5 mg·L-1,而TN达到15 mg·L-1。高N负荷的尾水排放到湖泊后,可能会导致湖泊水体较高的N浓度以及N∶P的失衡。
作为浅水湖泊的主要初级生产者之一,沉水植物在生态系统中扮演着重要的角色,对于维持湖泊“清水态”具有重要的作用。例如沉水植物可以通过化感作用和营养竞争抑制浮游植物生长[14],能促进水体悬浮颗粒物沉降,同时抑制沉积物再悬浮[15]。近年来,越来越多的证据表明水体中较高的N浓度是导致浅水湖泊沉水植物衰退的原因之一[16-18]。其机理主要有两个方面:首先,高N浓度能够抑制某些沉水植物的生理活性[19-20]。例如,Su等[21]的模拟实验发现较高的氨氮浓度(>10 mg·L-1)使水薀草(Egeria densa)叶片的氧化应激和光合作用受到抑制,植物生长受阻;其次,N浓度升高还能够促进浮游植物或植物表面附着藻类的生长,从而降低沉水植物的光照可得性。例如,章宗涉[22]的研究发现,随着N等营养盐的持续输入,水体中浮游植物迅速增长,水体透明度下降,沉水植物的生长率明显降低。
苦草(Vallisneria natans)和穗花狐尾藻(Myriophyllum spicatum)是长江中下游流域常见的两种沉水植物,苦草为莲座型沉水植物(Rosette producer),叶基生,根系发达;而穗花狐尾藻为冠层型(Canopy pro⁃ducer),叶轮生[23]。在自然水体中,二者在营养盐和光照中存在着较强的竞争关系[24-26]。然而,在共存情况下,二者对水体N负荷升高的响应还未见报道。基于此,我们设计了一个室外模拟实验,通过同株数混栽两种沉水植物,探讨外源N负荷升高(输入N∶P从5∶1提高到100∶1)对两种沉水植物生长的影响。
1 材料与方法
1.1 实验设置
本实验于2017年8月21日至9月18日在中国科学院太湖湖泊生态系统研究站的实验平台上进行,实验周期为28 d。预先在太湖梅梁湾打捞足量沉积物,经10目筛网过滤掉螺贝类后放入500 L的聚乙烯桶中,充分混匀后再分装到每个实验桶中,每桶沉积物厚度为10 cm。实验桶为80 L蓝色聚乙烯桶(高57 cm、顶部直径45 cm、底部直径36 cm)。实验用水同样采集自太湖梅梁湾,经64 μm浮游生物网过滤掉浮游甲壳动物后,缓缓注入到每个实验桶中,保证每个实验桶内水面距桶顶部10 cm,因此,每个实验桶约含有57 L太湖水。实验用沉水植物提前半个月在太湖周边河道中采集,种植在有沉积物和湖水的塑料箱中培养。实验开始时,从塑料箱中挑选植株健康、长势良好、株高和生物量一致的苦草和穗花狐尾藻幼苗,采用同心圆的方式在每个聚乙烯桶内间隔种植,每个桶中两种植物各种植10株。苦草和穗花狐尾藻株高均是15 cm,每个桶中苦草初始的平均总湿质量为20.30 g,平均密度为184.55 g·m-2,穗花狐尾藻初始的平均总湿质量为17.47 g,平均密度为158.82 g·m-2。每个聚乙烯桶中初始沉水植物的总密度为343.37 g·m-2。静置5 d待水体澄清后开始实验,开始前测得桶内水体的初始总氮(TN)浓度为(3.41±0.38)mg·L-1,总磷(TP)浓度为(0.180±0.015)mg·L-1,叶绿素a(Chla)浓度为(169.6±30.2)μg·L-1,主要藻类为铜绿微囊藻(Microcystis aeruginosa)(中国科学院太湖湖泊生态系统研究站监测数据)。
本实验为单因素实验,N浓度为唯一变量,设两个水平,每个水平设4个重复,共8个实验桶。其中低N组的N负荷设置为25 μg·L-1·d-1,高N组的N负荷设置为500 μg·L-1·d-1,两个实验组的P负荷与太湖日均P负荷相同,均为5 μg·L-1·d-1[27]。因此低N组和高N组的N∶P负荷输入比分别为5∶1和100∶1,该比值在长江中下游湖泊的TN∶TP范围内(何虎等,未发表数据)。按照实验设计调配好营养盐后(氮源为KNO3,磷源为KH2PO4),每日早上8:00左右利用移液枪添加。实验期间不定期向桶内补充蒸馏水以保证水位恒定。
1.2 测定指标
实验期间,每7 d采集一次水样,采样时间为上午8:00—9:00。采样时,用柱状有机玻璃管(直径为10 cm,高度100 cm)采集混合水样,实验室内测定水体TN、TP、硝氮(NO-3-N)、氨氮(NH+4-N)、正磷酸盐(PO3-4-P)和Chl-a浓度,测量方法依据《湖泊富营养化调查规范》[28]。
实验结束时(第28 d),小心采集各桶内所有的苦草和穗花狐尾藻植株。在实验场地内清洗干净,立即带回实验室用滤纸吸干植物表面的水分,随后测定两种植物的株数和湿质量,并计算生物量(湿质量/面积)和相对生长率(Relative growth rate,RGR)。相对生长率计算公式为:

式中:Wi和Wf分别为植物实验前和实验后的湿质量,g;D为时间,d[29]。
此外,我们从每个桶中随机选取苦草和穗花狐尾藻各5株,测量苦草的叶片数、根长、匍匐茎长以及穗花狐尾藻的节间距、株高等一系列形态指标,最后以5株植物的平均值代表该实验桶内植物的形态数据。
营养盐数据用重复测量方差分析(rANOVA)进行比较,两种沉水植物的生长指标采用独立样本T检验进行比较。统计分析前利用Shapiro-Wilk检验各组数据是否服从正态分布,如果数据不满足正态分布,则对数据进行lgX转换,如果转换后仍不满足正态分布,则进行非参数的Mann-Whitney U检验。所有统计分析均使用SPSS 19.0完成。
2 结果与分析
2.1 营养盐指标
N负荷升高显著提高了水体TN和NO-3-N浓度(图1、表1)。实验结束时,高N组平均TN、NH+4-N、NO-3-N浓度分别是低N组的334%,102%和494%。
N负荷升高同样对水体TP浓度和TN∶TP具有显著的影响,表现为高N组TP和TN∶TP显著高于低N组(图1、表1)。实验结束时,高N组平均TP浓度和TN∶TP是低N组的261%和136%。N负荷升高对水体PO3-4-P浓度的影响不显著(图1、表1)。
N负荷升高显著提高了水体Chl-a浓度(图2、表1)。实验结束时,高N组的Chl-a浓度是低N组的619%。

表1 营养盐的重复测量方差分析Table 1 Repeated measurement analysis of variance of nutrients
2.2 苦草指标
N负荷升高显著影响了苦草的生物量、相对生长率、叶片数、根长、匍匐茎长和株数(图3、表2、表3)。低N组苦草的生物量、叶片数、根长和株数分别是高N组的2.35、2.07、1.62倍和2.55倍,低N组苦草的相对生长率(8.28 mg·g-1·d-1)显著高于高N组(-23.27 mg·g-1·d-1),低N组苦草的匍匐茎长(4.64 cm)同样显著高于高N组(无匍匐茎)(P<0.05)。

图1 低N组和高N组TN、NO-3-N、NH+4-N、TP、PO34--P浓度和TN∶TP的变化Figure 1 Difference of total nitrogen(TN),nitrate nitrogen(NO-3-N),ammonia nitrogen(NH+4-N),total phosphorus(TP),orthophosphate(PO34--P)content and the ratio of TN and TP between low nitrogen group and high nitrogen group
2.3 狐尾藻指标
N负荷升高对穗花狐尾藻的生物量、相对生长率、节间距、株高和株数的影响均不显著(图4、表2)。
2.4 总生物量
N负荷升高显著影响了两种沉水植物的总生物量(图5、表2)。低N组沉水植物的总生物量(321.98 g·m-2)是高N组(115.86 g·m-2)的2.78倍。
3 讨论
本研究通过室外模拟实验,探讨混栽条件下两种沉水植物(苦草和穗花狐尾藻)对N负荷升高的响应。结果表明在28 d的实验时间内,较高的N负荷对苦草生长产生了明显胁迫作用(图3),但是对穗花狐尾藻生长没有明显的影响(图4)。

图2 低N组和高N组水体Chl-a含量的变化Figure 2 Differences of Chl-a content in water between low nitrogen group and high nitrogen group

表2 低N组和高N组的两种沉水植物生长和形态指标的独立样本T检验分析结果Table 2 Independent sample T-test results of growth and morphological indicators of two submerged macrophytes in low-nitrogen group and high-nitrogen groups

图3 两个处理组苦草的生物量、相对生长率、根长、匍匐茎长、株数和叶片数的变化Figure 3 Differences of biomass,relative growth rate,root length,stolon length,number of plants and number of leaves of V.natans between both treatments
以往的研究表明,较高的N浓度能够从生理上直接抑制苦草的生长[30]。例如,Cao等[31]的围隔实验发现,苦草根状茎中游离氨基酸浓度随着水体NH+4-N浓度的增加而逐渐上升,同时可溶性糖浓度降低,导致繁殖能力下降。潘琦等[32]发现随着NO-3-N浓度在一定程度上增加,苦草的超氧化物歧化酶、丙二醛活性会升高,但是当NO-3-N浓度继续升高到40 mg·L-1时,苦草的抗氧化酶系统反而会受损,导致生长受阻。在本实验中,高N组的TN和NO-3-N浓度均远高于低N组,较高的N浓度可能对苦草产生了生理上的抑制作用。另外,N负荷升高也可能通过刺激浮游植物生长,从而间接抑制苦草的生长[33]。Yu等[34]的原位实验发现,随着水体TN浓度的上升,浮游植物Chl-a浓度也升高,同时水体光照下降,苦草的生物量、叶长和根长明显降低。Kang等[35]的模拟实验发现水体Chl-a浓度超过109 μg·L-1时,苦草的可溶性蛋白降低,丙二醛含量升高。黎慧娟等[33]发现浮游植物可以通过产生化感物质来抑制苦草叶绿素的合成或分解其叶绿素从而抑制其生长。在本实验中,水体Chl-a浓度随着N负荷升高而明显上升,实验结束时高N组平均Chl-a浓度达到了400 μg·L-1,浮游植物对苦草较强的遮光和化感效应也可能抑制了高N组苦草的生长。值得注意的是,本研究中高N组的TP浓度同样显著高于低N组(图1、表1),这可能是富营养水体中N负荷升高引发了生态系统的一个负反馈过程。即:高N负荷抑制了沉水植物的生长,沉水植物的衰退反之又促进沉积物中P的释放,水体P浓度增加又进一步促进浮游植物的生长以及沉积物P的释放。He等[36]的模拟实验同样发现高浓度N输入促进了沉积物的P释放,从而提高了水体TP浓度。

图4 两个处理组穗花狐尾藻的生物量、相对生长率、节间距、株高和株数的变化Figure 4 Differences of biomass,relative growth rate,internode length,plant height and number of plants of Myriophyllum spicatum between both treatments

图5 两个处理组沉水植物总生物量的变化Figure 5 Difference of total biomass of submerged macrophytes between both treatments
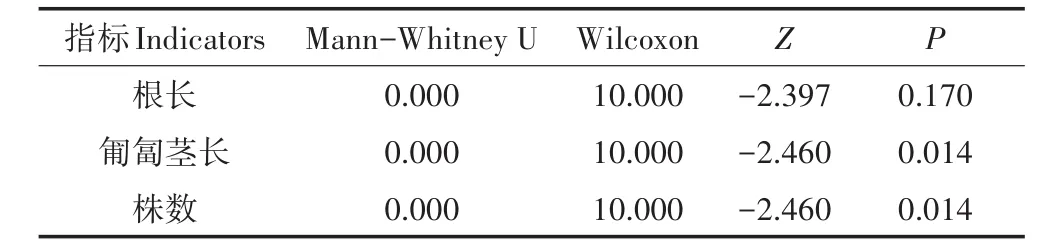
表3 低N组和高N组苦草根长、匍匐茎长和株数的Mann-Whitney U检验结果Table 3 Mann-Whitney U test results of root length,stem length and number of plants in low nitrogen group and high nitrogen groups
本研究中,高N组苦草的根长显著低于低N组,且未长出匍匐茎及分枝,同时苦草叶片数也明显少于低N组(图3)。这表明N浓度升高对苦草地上和地下部分的生长均具有不利的影响,同时限制了苦草的繁殖以及种群扩张能力,这和Yu等[34]的原位实验结果较为相似。类似地,张雪等[37]的模拟实验也发现随着水体N负荷升高(从0~160 mg·m-2·d-1),刺苦草(V.spinulosa)根长明显下降,无性系分株呈下降趋势。
本研究中,两个处理组穗花狐尾藻的各项生长和形态指标均无显著差异(表2),表明N负荷升高对穗花狐尾藻的影响不显著。以往的研究表明,穗花狐尾藻对N具有较高的耐受性。例如,王爱丽等[38]的研究发现当水体NH+4-N浓度超过3.5 mg·L-1时,NH+4-N对穗花狐尾藻具有明显的毒害作用,表现为体内Chl-a和可溶性蛋白含量下降,脯氨酸含量上升。本研究中,高N组的平均NH+4-N浓度为0.29 mg·L-1,该浓度可能不足以对穗花狐尾藻产生生理上的抑制。此外,低N组中苦草对穗花狐尾藻的竞争作用也可能抑制了穗花狐尾藻种群的发展,从而导致高N组和低N组之间穗花狐尾藻的差异不显著。类似地,闵奋力等[25]的模拟实验发现穗花狐尾藻与苦草共培养时,分枝数明显减少。从沉水植物总生物量看,由于苦草生物量的降低,高N组沉水植物的总生物量明显低于低N组(图5、表2),同时N浓度升高还明显促进了浮游植物生长(图2、表1),表明N负荷升高加速了生态系统的草-藻转换。
在湖泊的控源截污工作中,控P的必要性已经得到了广泛认可,但对于控N仍存在较大争议[5-13]。本研究结果表明N浓度升高会抑制沉水植物的生长,进而加快湖泊富营养化的进程。因此,从湖泊管理和生态修复工作角度,本研究支持N和P均需要控制的观点。
4 结论
(1)N负荷升高对沉水植物的影响具有种间差异,较高的N浓度对苦草生长产生了明显的胁迫作用,苦草的各项生长指标均显著降低。但是N负荷升高对穗花狐尾藻的生长影响不显著,表明穗花狐尾藻对于高N浓度具有较高的耐受能力。
(2)N负荷升高显著降低了沉水植物的总生物量,同时增加了水体Chl-a浓度,表明N负荷升高可能会有利于生态系统从草型清水态向藻型浊水态转化。从湖泊管理和生态修复的角度而言,本研究支持N和P均需要控制的观点。
——以武汉东湖为例
——以武汉紫阳湖为例

