球磨生物炭的性质及其对大肠杆菌和金黄色葡萄球菌的毒性效应研究
郭赛赛,刘小妹,陈宏坤,庄志成,王宜志,唐景春,4*
(1.南开大学环境科学与工程学院,天津 300071;2.石油石化污染物控制与处理国家重点实验室,中国石油集团安全环保技术研究院,北京 102206;3.天津天迈节能设备有限公司,天津 300112;4.天津市城市环境污染诊断与修复工程技术中心,天津300071)
由于生物炭(BC)优异的物理化学性质,包括巨大的表面积、大量的孔隙结构,其已被广泛用于环境修复中。针对BC对微生物毒性影响的研究还未见报道,但有研究表明BC施于土壤后,会引起微生物群落的变化[1-2]。施用BC可以增加土壤养分和稳定碳的含量[3-6],从而为微生物提供更多的底物,提高微生物的丰度;BC在土壤中的应用也为微生物提供了一个安全的栖息地[7]。所以在经过BC改良的土壤中,微生物的数量和活性会有所增加,这也导致土壤微生物群落和酶活性发生显著变化[8]。但是BC对某种具体微生物的影响尚不清楚。Chen等[9]在中国桐乡市进行了大田试验,研究了稻草BC对土壤养分和微生物特性的影响,研究发现施用20%BC与对照相比,土壤细菌数量增加了26.9%;施用10%以上的BC,放线菌数量显著增加80.6%~130%,但是真菌数量减少22.2%~30.2%,枯草杆菌数量减少42.4%~54.4%。另外Qiao等[10]在受砷污染的稻田土上进行实验,发现BC增加了砷和铁相关细菌的丰度,但对其他菌群的影响尚不清楚。
球磨生物炭(BM)是由高温裂解后的BC在球磨机中通过机械力作用,将BC粒径减小到纳米或者微米级别的新型生物炭材料[11]。这种新型材料由Peter⁃son等[11]在2012年提出。由于它比BM具有更好地吸附[12]和降解[13]性能,而经常被用于去除水体和土壤中的污染物。之前的研究证明了BM具有更大的比表面积[11]和更多的酸性官能团。近年来,关于BM的研究多集中在它的吸附降解性能[14],很少有研究关注它对微生物的毒性。但是,根据以往的研究[15],达到纳米级别的BC很有可能对微生物产生毒性效应。另外,之前的研究[16-17]证明了碳纳米材料都存在一定的毒性,如氧化石墨烯[18-20]、碳纳米管[21]、富勒烯[22-23]等。
已有研究表明,自由基的产生是纳米材料对微生物毒性作用的重要方式[24]。自由基或产生的活性氧可以与许多化学结构分子发生反应,包括生物大分子,如糖蛋白会导致细胞膜失稳和细胞死亡。在水相中,这些自由基可以触发活性氧自由基(ROS)的产生。研究发现,中、高浓度的ROS通过细胞氧化应激反应诱导细胞凋亡甚至导致其坏死[25-27],低浓度的ROS更广泛的生理意义在于其对转录因子的激活以及对细胞增殖、分化的促进[25]。Lieke等[28]对500℃水稻秸秆BC研究发现,存在于BC中的自由基对线虫神经毒性产生影响。此外,Liao等[29]和Farhangi-Abriz等[30]证明了BC颗粒中的自由基在水中可以促进活性氧的产生,并对植物的种子萌发以及根和茎伸长产生不利的影响。BM经球磨后,材料粒度大幅降低,部分可以达到纳米尺度,因此有理由认为BM有一定程度的纳米毒性效应。
到目前为止,关于BM对细菌的毒性影响尚未有人研究。基于此,本研究以小麦秸秆为原料,在500℃下制备得到BM,通过行星式球磨仪制备球磨生物炭材料。对其性质进行研究,同时选取两种模式细菌进行急性毒性实验,利用荧光法测定细菌的ROS和存活率等指标,并利用扫描电子显微镜(SEM)和激光共聚焦显微镜(LSCM)观察细菌的形态,对BM的微生物毒性和抗菌机理进行了初步研究。
1 材料与方法
1.1 实验原料
实验所用的生物炭原料为小麦秸秆,来源于天津周边农村。BC由小麦秸秆在马弗炉中500℃限氧裂解2.5 h制备而成[31],BM由生物炭按照Lyu等[14]的方法制备而成。大肠杆菌(Escherichia coli)ATCC 25922和金黄色葡萄球菌(Staphylococcus aureus)ATCC 25923为实验室保存菌种。大肠杆菌和金黄色葡萄球菌的培养均采用LB培养基(胰蛋白胨10 g·L-1,酵母提取物 5 g·L-1,氯化钠 10 g·L-1),在 30 ℃、180 r·min-1条件下,于摇床中培养12 h至对数生长期。
1.2 BC的表征
对制备的BC和BM进行清洗处理:将BC和BM置于蒸馏水中浸泡一周,并用磁力搅拌器(84-B,山东菏泽正虹科教仪器有限公司,中国)搅拌,每隔6 h倒掉漂浮在水面上的杂质,再加入等量的蒸馏水进行清洗。将清洗好的BC和BM进行抽滤,置于恒温干燥箱(DGG-9023A,上海优浦科学仪器公司,中国)中,于80℃下干燥24 h,装入塑封袋密封,备用。采用多站扩展式全自动快速比表面仪(ASAP 2460,麦克公司,美国)测定BC和BM的比表面积;采用扫描电子显微镜(JSM-7800F,日本电子,日本)观测BC和BM的表面形貌;采用傅里叶变换红外光谱仪(TEN⁃SOR 37,BRUKER,德国)分析BC和BM的官能团;采用pH计(PB-10,Sartorius,德国)测定pH值;采用电导率仪[FE30,梅特勒-托利多仪器(上海)有限公司,中国]测定电导率值。
1.3 急性毒性实验
将50 mL培养至对数生长期的E.coli和S.aureus转移至50 mL无菌离心管中,5000 r·min-1离心5 min,倒掉上清液,用无菌0.9%NaCl清洗3次以除去残留的LB培养基。将清洗完的菌种倒入50 mL分别加入了0、10、20、50、100、200 mg·L-1BC和BM的无菌LB培养基和0.9%NaCl中,置于摇床(HNY-2102C,欧诺公司,中国)里,30℃、180 r·min-1培养2.5 h后,分析其毒性影响。
1.4 细菌形貌观测
取50 mL染毒后的菌液,5000 r·min-1离心5 min后,去除上清液。将菌体放到2.5%的戊二醛(扫描电镜专用)中,4℃固定4 h(或固定过夜)。将固定液倒掉,0.1 mol·L-1PBS缓冲液(pH7.0)漂洗3次,每次15 min。利用浓度为30%、50%、70%、80%、90%的乙醇进行梯度脱水,每次15 min,随后用无水乙醇处理两次,每次20 min。真空干燥后在菌体表面喷金,置于SEM下观察细胞形态。
1.5 细菌存活率测定与LSCM观测
存活率采用细菌细胞活性测定试剂盒(Invitro⁃gen,美国)测定[24]。染料为PI和SYTO 9,PI只能穿过破损的细胞膜,与细胞核结合显红色荧光;SYTO 9可以穿过所有细胞膜,与细胞核结合显绿色荧光。当两种染料同时存在时,活细胞呈现绿色,死细胞呈现红色。取1 mL染毒后的菌液置于2 mL离心管中,10 000 r·min-1离心3 min,用无菌0.9%NaCl清洗3次,取100 μL PI和SYTO 9等量混匀后的染料与100 μL菌液混合,锡箔纸包好后置于摇床中,于30℃,180 r·min-1混合摇匀15 min,取100 μL样品于96微孔板中,用全功能酶标仪(Synergy H4,伯腾公司,美国,激发波长485 nm,发射波长521 nm)测定荧光值,计算存活率。另取50 μL样品用LSCM(LSM880 with Airyscan,Zeiss公司,德国)观测。
1.6 细菌ROS测定
用活性氧试剂盒(碧云天,中国)测定细菌细胞内的ROS含量[24],染料为2′,7′-二氯荧光素二乙酸酯(DCFH-DA)。DCFH-DA向细胞内扩散,脱去乙酰基成为不显荧光的DCFH,细胞内的ROS迅速将DCFH氧化成具有高强度荧光的DCF,其荧光强度和细胞内的ROS含量成正比。取1 mL染毒后的菌液置于2 mL离心管中,10 000 r·min-1离心3 min,用无菌0.9%NaCl清洗3次后,取100 μL活性氧染料与100 μL菌液混合,锡箔纸包好后置于摇床中,于30℃、180 r·min-1混合摇匀30 min,取100 μL样品于96微孔板中,用酶标仪(激发波长485 nm,发射波长521 nm)测定荧光值。相对ROS水平表示为样品组与空白对照组的荧光强度之比[26]。
消除ROS实验:将培养至对数期的菌体清洗干净后,倒入50 mL 0.9%NaCl中,并加入2 mmol·L-1N-乙酰半胱氨酸(NAC)[32]。以不加NAC的0.9%NaCl为对照,30℃条件下培养1 h后,向加入NAC的培养瓶中依次加入0、10、20、50、100、200 mg·L-1的BM,培养2.5 h后,测定各体系的致死率和ROS含量,并在LSCM和SEM下直观观察细胞的损伤情况。
1.7 数据分析
采用Origin 2018进行数据处理及作图,数据表示为平均值±标准差,ROS和存活率的测定均设置3次平行,采用SPSS对数据进行方差分析(One way ANO⁃VA)及Turkey′s Test分析,P<0.05表示有显著差异。
2 结果与分析
2.1 BM和BC的性质
BM和BC的基本性质见表1。分析表1可知,BM的比表面积远大于BC,是BC的3.15倍,而pH值低于BC。由表1中的元素分析结果可知,BM中C和O的含量高于BC,这与BM溶液比BC溶液的颜色黑这一实验现象相吻合。将BM和BC置于蒸馏水中,超声30 min后,BC在10 min内上浮或者沉淀,而BM在12 h内未发生沉淀,说明BM的稳定性和分散性优于BC。

表1 BM和BC的比表面积、pH和元素组成Table 1 Specific surface area,pH and elemental composition of BM and BC
用扫描电子显微镜对BM和BC的颗粒大小和形态进行比较的结果见图1。由图1a和图1b可知BC是多孔的,存在明显的孔状结构,粒度为毫米级别,孔径约为1 μm。由图1c和图1d可知,BM的粒径不规则,且大小不均匀,但都在1 μm以下,图中圈出的红色部分为小于100 nm的颗粒。总体来看,BM的粒度在60 nm~1 μm之间。BC经过球磨成BM后,颗粒粒径减小,颗粒数量大量增加,这导致了比表面积的增加,与比表面积的结果一致。
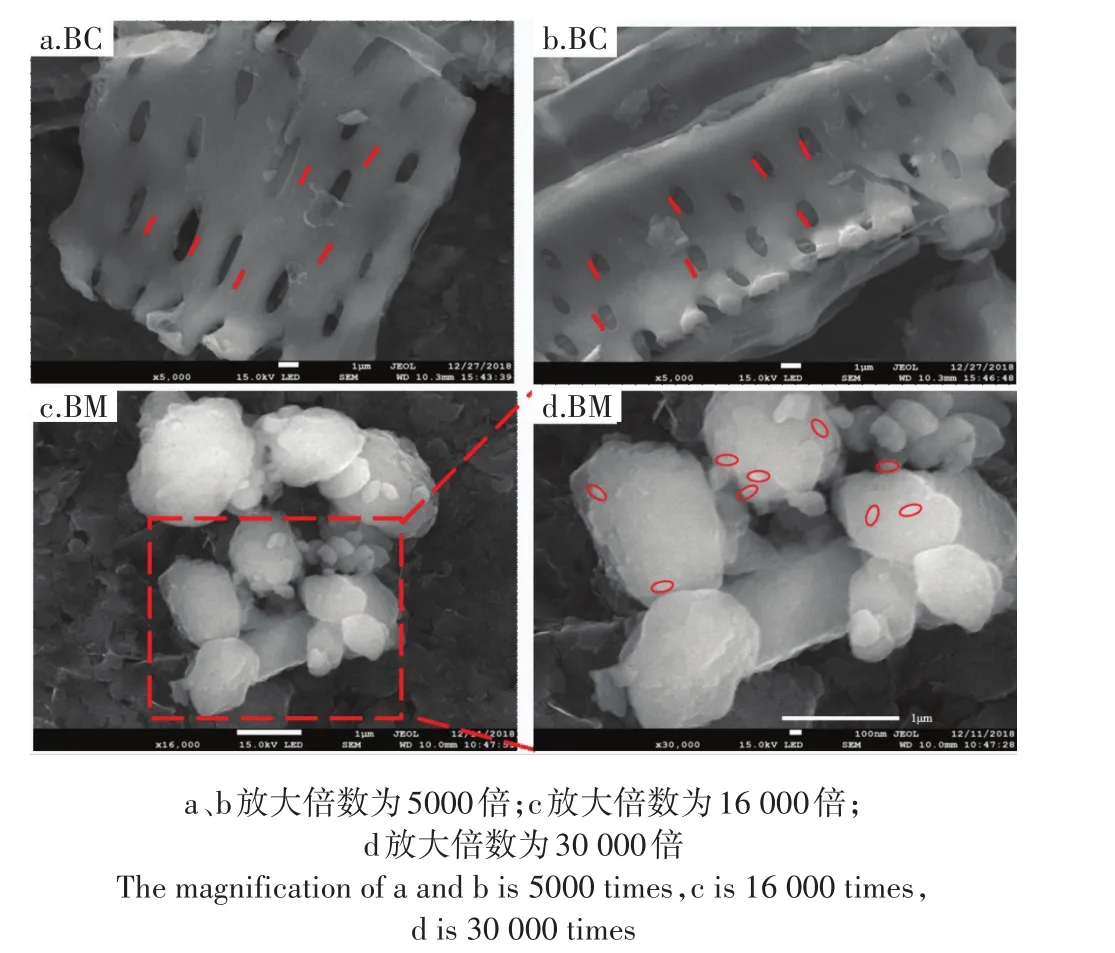
图1 BM和BC的扫描电镜图Figure 1 Scanning electron microscopy(SEM)of BM and BC
从BM和BC的红外图谱(图2)可以发现,BM在3356 cm-1和3048 cm-1处,O-H和N-H键显著拉伸,C=C、N=N、C=N和N=O双键在1586 cm-1处伸缩振动,C-H在873、810 cm-1和749 cm-1处弯曲振动。此外,在BM上观察到两个新的峰,分别为1380 cm-1和1092 cm-1处的酚醛C-X和C-O,表明球磨引入了一些酸性官能团,这与pH值的结果相一致。在测试条件下,BM表面酸性官能团的引入会增强电双层之间的排斥力,以防止亚微米球磨生物炭粒子的聚集,这与超声分散的结果一致。

图2 BM和BC的红外图谱Figure 2 Fourier transform infrared(FTIR)of BM and BC
2.2 添加BM和BC对E.coli和S.aureus存活率的影响
经过2.5 h的毒性暴露实验后,E.coli和S.aureus的存活率测定结果如图3所示。在0.9%NaCl中,仅添加10 mg·L-1的BM,S.aureus的存活率为90.1%,当浓度增大到200 mg·L-1时,存活率仅为23.5%;而添加10 mg·L-1的BC时,S.aureus的存活率为98.2%,当浓度增大到200 mg·L-1时,存活率仍为68.9%。这说明相比于BC,BM对S.aureus的毒性更显著。在LB培养基中,BM浓度为200 mg·L-1时,S.aureus存活率为60.9%,这说明在LB培养基中,BM对S.aureus的毒性减弱。无论是在0.9%NaCl还是LB培养基中,添加BM和BC后,E.coli的存活率一直维持在90%以上,且两者差别较小,这说明BM和BC对E.coli的存活率影响不显著。由SPSS分析,数据对照均具有显著性差异。
2.3 添加BM和BC对E.coli和S.aureus氧化损伤的影响
为了分析BM和BC对E.coli和S.aureus产生毒性的原因,测定了两种菌细胞内的ROS含量,结果如图4所示。细菌和培养介质相同的条件下,添加BM产生的ROS是BC的1.1~2.0倍。如图4a所示,在0.9%NaCl中,添加BM对E.coli最大的氧化损伤为空白的1.4倍,对S.aureus的氧化损伤最大为空白的6.4倍,且倍数随着BM浓度的增加而增加,说明BM对S.aureus造成的氧化损伤远大于E.coli。如图4b所示,在LB培养基中,添加BM对E.coli最大的氧化损伤为空白的1.2倍,对S.aureus的氧化损伤为空白的4倍。对比图4a和图4b可以发现,在LB培养基中,添加BM和BC后,细菌细胞内的ROS均有所减少。

图3 0.9%NaCl和LB培养基中细菌的存活率Figure 3 Livability of bacteria in 0.9%NaCl and LB medium

图4 0.9%NaCl和LB培养基中细菌产生的ROSFigure 4 ROS produced by bacteria in 0.9%NaCl and LB medium
2.4 BM对S.aureus产生毒性的机理探究
2.4.1 NAC对S.aureus产生ROS与存活率的影响
由于BM对E.coli的毒性效果不明显,因此以S.aureus为模式菌株探究BM毒性与氧化损伤的关系。
如图5所示,加入NAC后,各处理组ROS的含量降低至与空白相接近,说明各组中ROS的作用已基本消除。与暴露于BM的各组相比,加入的NAC使得S.aureus存活率升高,但是与对照相比仍有一定差距。说明BM对S.aureus产生毒性主要是由于氧化损伤导致的,但是其他因素,例如BM的机械碰撞作用也有可能是造成毒性的一个原因,因此虽然消除了ROS,但其存活率与对照相比仍有一定差距。
2.4.2 E.coli和S.aureus的LSCM图像
为进一步证实上述推测,采用荧光活/死染色法观察细菌膜完整性,区分活菌(绿色)和死菌(红色),以探讨BM和BC对E.coli和S.aureus的抗菌能力。选取在0.9%NaCl中,添加BM后的E.coli和S.aureus的LSCM图像进行分析。如图6所示,在0.9%NaCl中,不添加BM时,E.coli和S.aureus几乎全为绿色,添加BM后,E.coli和S.aureus中均有红色出现,且红色部分所占比率和BM的浓度呈正相关。同一浓度下,S.aureus中红色部分远大于E.coli,说明BM对S.aureus的毒性远大于E.coli。在0.9%NaCl中添加200 mg·L-1BM,消除ROS后S.aureus的LSCM图像(图6d)与未消除ROS的图像(图6c)相比,红色部分大量减少,说明加入NAC后,S.aureus的存活率上升。
2.4.3 E.coli和S.aureus的SEM图像
为了进一步确定实验结论,采用SEM观察了E.coli和S.aureus的表面形态。选取在0.9%NaCl中,添加BM后E.coli和S.aureus的SEM图像进行分析,如图7所示:不添加BM的S.aureus表面光滑,无褶皱存在。添加BM后,S.aureus的表面存在褶皱,且随着BM浓度的增加,褶皱更加明显。可能是由于BM造成S.aureus细胞膜和细胞壁损伤,细胞质泄漏所致;不添加BM的E.coli表面光滑无破损,添加BM后,细胞表面存在微量的褶皱,但是随着浓度增加,细胞体积不变。说明在0.9%NaCl中,BM对S.aureus的毒性远大于E.coli。在LB培养基中也有相似情况,但没有在0.9%NaCl中明显。在0.9%NaCl中添加200 mg·L-1BM,消除ROS后S.aureus的SEM图像(图7d)与未消除ROS的图像(7c)相比,褶皱大量减少,细胞膜基本无褶皱。这与ROS、存活率和LSCM的结果吻合。

图5 0.9%NaCl中S.aureus产生的ROS与S.aureus的存活率Figure5 ROS produced by S.aureus and livability of S.aureus in 0.9%NaCl

图6 在0.9%NaCl中添加BM后细菌的LSCM图像(×40倍)Figure 6 LSCM image of bacteria in 0.9%NaCl after adding BM(×40 times)
加入NAC消除ROS的实验说明氧化损伤是造成细胞死亡的重要原因,但是其他因素,例如纳米颗粒对细胞的机械碰撞等也有可能是造成BM毒性的原因。
3 讨论
本次研究的实验结果表明,相比于BC,BM具有更低的pH值,更多的酸性官能团,更大的比表面积,这与Lyu等[14]和Wang等[33]的研究结果一致。球磨能够将毫米尺度的颗粒减小到纳米级别,由于颗粒减小,BM在蒸馏水中分散得更好。同时,也由于颗粒减小使大量亚微米颗粒增加,从而导致了BM比表面积的增加。FTIR结果表明,BM具有更多的酸性官能团,从而导致pH值的降低。
对比BC和BM,相同条件下,BM的毒性更明显。BM由BC经过球磨得到,通过球磨,可能会增加持久性自由基的数量[34-35]。本次研究中,相比于LB培养基,BM在0.9%NaCl中对S.aureus的毒性更明显,可能是由于LB培养基中的营养物质起到了缓冲与保护作用,这与Liu等[24]的研究结果一致。在两种介质中,BM的毒性都大于BC。这除了与自由基有关,可能还与颗粒尺寸有关。由图1可知,BM的粒度在60 nm~1 μm之间,远小于BC[36],而S.aureus的直径在0.8 μm左右,小于100 nm的颗粒极有可能穿过细胞的细胞膜,进入细胞,造成高浓度的ROS,从而导致S.aureus的死亡。100 nm~1 μm之间的颗粒,由于培养过程中的振荡作用,会对S.aureus产生撞击,从而造成一定的机械损伤。由于粒度减小,导致BM具有更大的比表面积[33,37],与 E.coli和 S.aureus的接触更充分,使其产生更高浓度的ROS,所以损伤更大。此外,BM对E.coli和S.aureus的毒性效应不同,可能还与E.coli产生的胞外聚合物(EPS)有关。由于革兰氏阳性菌与阴性菌的细胞壁构造不同,在其表面产生的EPS也不同[38]。EPS不仅可以起到屏障作用,防止生物炭所造成的物理损伤,而且还可以作为ROS的汇,保护细菌免受生物炭的毒害[39]。

图7 在0.9%NaCl中添加BM后细菌的SEM图像(×40 000倍)Figure 7 SEM image of bacteria in 0.9%NaCl after adding BM(×40 000 times)
4 结论
(1)球磨生物炭具有更多的酸性官能团和更大的比表面积。
(2)球磨生物炭对E.coli和S.aureus的毒性影响远大于生物炭。
(3)球磨生物炭对S.aureus的毒性高于E.coli,且毒性与浓度呈正相关。

