红松子油中皮诺敛酸的纯化及降脂活性评价
张 晶 寇 萍 秦启萍 于 良 赵雪莲 王希清* 杨雨春 付玉杰
(1.东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040; 2.吉林省林业科学院,长春 130033)
红松(PinuskoraiensisSieb.)是松科(Pinaceae)松属(Pinus)裸子植物,常绿乔木,主要分布在中国东北部、朝鲜、日本等地区,资源非常丰富[1]。其种子含有脂肪酸、蛋白质、维生素等多种营养成分,所得红松子油可作为直接的食用油来源,其脂肪酸含量达到60%~70%,主要包括:亚麻酸、亚油酸、皮诺敛酸、棕榈酸、二十碳五烯酸、二十二碳六烯酸等,具有降血脂、提高免疫力、降低体重的作用[2]。其中,皮诺敛酸(Pinolenic acid;PLA)是松子油中特有的十八碳三烯酸,其分子式为C18H30O2[3]。皮诺敛酸与其他十八碳三烯酸相比,生物活性更突出,应用前景更广阔。文献报道皮诺敛酸能够通过改变apo基因,从而达到降脂作用[4]。此外,皮诺敛酸具有抑制食欲的作用,通过在胃肠道里触发近端小肠中缩胆囊素的释放及远端小肠中的胰高血糖素样肽-1的释放,从而降低人的食欲[5]。
目前对脂肪酸的纯化方法主要有:超临界流体萃取法、专一性酶法、分子蒸馏法、银离子络合法、尿素包合法等,其中尿素包合法,因其操作简单,溶剂和尿素都可回收再利用,环境友好等优点,具有较强的实用性[6~7]。现有利用尿素包合法纯化不饱和脂肪酸的研究对象主要集中在鱼油类和EPA/DHA等脂肪酸,而对皮诺敛酸纯化的研究则相对较少[8~9]。通常情况下,尿素是一个四面体的结晶,当它与游离脂肪酸化合物生成包合物后,包合物呈六面体结晶[10]。尿素包合法则主要是根据尿素与不同饱和程度脂肪酸的差异性结合来实现分离,饱和脂肪酸易与尿素分子形成稳定的包合物,而多不饱和脂肪酸由于双键较多,空间结构复杂,很难被尿素包合[11~12]。因此尿素包合法可以将不同类型的脂肪酸分开,应用于高纯度皮诺敛酸的纯化制备,在植物油料的纯化利用方面具有重要的经济价值及现实意义[13]。
随着社会的发展,人们饮食结构的改变,加剧了脂肪代谢紊乱相关疾病的发生,如非酒精性脂肪肝、糖尿病、高血脂症等[14~15]。非酒精性脂肪肝以肝细胞脂肪沉积为特征,与肥胖、胰岛素抵抗等代谢疾病联系密切[16~17]。因此,采用油酸(Oleic acid;OA)孵育HepG2细胞模拟体外非酒精性脂肪肝[18~20],研究纯化后的皮诺敛酸对脂质积累的影响,为皮诺敛酸作为减肥降脂的食品提供一定理论基础,为东北红松子油的发开及利用提供科学数据。
1 材料与方法
1.1 主要材料
红松子油本实验自行提取;硫酸(98%)、尿素、90%乙醇、氢氧化钾、色谱级正己烷,天津市科密欧化学试剂有限公司;人肝癌细胞系(HepG2),购自哈尔滨医科大学;DMEM高糖培养基,美国Hyclone公司;胎牛血清,杭州四季青生物工程材料有限公司;甘油三脂(TG)试剂盒、总胆固醇(TC)试剂盒购自南京建成生物工程研究所。
1.2 主要仪器
YP2002型分析天平;MAS-Ⅱ型微波辅助提取仪;Varian 450-GC/240-MS气相色谱/质谱仪;SIM细胞培养箱;TS-100尼康倒置用显微镜;DL-CJ-2N生物洁净工作台;Sigma 1-15K高速冷冻离心机。
1.3 实验方法
1.3.1 游离脂肪酸的制备
称取一定量的红松子油置于三口瓶中,加入6倍体积80%乙醇溶液,再加入乙醇溶液质量分数10%的氢氧化钾,在65℃、500 W的微波条件下冷凝回流反应2 h后,减压回收乙醇至原体积的1/5,加入蒸馏水至原体积的2倍,加入石油醚萃取3次,除去不皂化物;取下层水层,用盐酸调pH至2~3;再用正己烷萃取3次,合并正己烷层,转移至分液漏斗中,水洗至中性,分离正己烷层,加入无水硫酸钠干燥,抽滤,减压回收正己烷,制得皂化后的游离脂肪酸。
1.3.2 脂肪酸甲酯化的制备
称取脂肪酸20 mg,加入3%硫酸—甲醇溶液1 mL,于65℃下加热回流1 h,反应结束后,在混合物中加入2 mL正己烷,并转移至分液漏斗中,加入适量的水分层,上层为脂肪酸甲酯,取上层液体并加入少量无水硫酸钠除水,最后将得到的甲酯化产物在12 000 r·min-1的条件下离心10 min,取甲酯化产物以1∶2 000溶于色谱级正己烷,进行GC-MS分析。
1.3.3 气相色谱分析条件
气相条件:Agilent VF-5ms型石英毛细管柱(30 m×0.25 mm i.d×0.25 μm);载气为高纯度氦气(99.99%),柱内载气流量为2 mL·min-1;进样量为1.0 μL;从150℃开始以5℃·min-1升至180℃并保留2 min,再以0.5℃·min-1升到192℃并保留1 min,再以10℃·min-1升到220℃并保留1 min;进样口温度250℃;检测器温度280℃。
1.3.4 尿素包合法纯化皮诺敛酸
称取一定量尿素和90%乙醇放入三口瓶中,加热下不断搅拌使尿素充分溶解,制得尿素乙醇溶液;然后将1.3.1制备的游离脂肪酸与尿素乙醇溶液混合,加热回流50 min,冷却至室温,将其放置在一定温度下冷冻结晶数小时;将尿素包合物进行减压抽滤,收集滤液,将乙醇旋干,再用正己烷萃取3次,合并有机相并转移至分液漏斗,水洗至中性,加入无水硫酸钠干燥,抽滤,减压回收正己烷后,得皮诺敛酸。为了得到更高纯度的皮诺敛酸,将皮诺敛酸第二次包合,最后按照1.3.2和1.3.3进行皮诺敛酸的甲酯化及含量检测。
皮诺敛酸的回收率(%)=尿素包合后皮诺敛酸含量(mg)/尿素包合前皮诺敛酸含量(mg)
1.3.5 细胞的培养
将HepG2细胞置于37℃,5% CO2的培养箱中,并用含10%血清和1%双抗的DMEM高糖培养液培养。当细胞状态良好且密度达到80%以上时,用胰酶消化,按1∶3比例传代,用于后续实验。
1.3.6 细胞存活率的测定
当细胞密度达到80%以上时,用胰酶将细胞消化为细胞悬液,接种于96孔板中,置于培养箱培养过夜。分别用0、10、20、40、80、160 μmol·L-1的皮诺敛酸培养HepG2细胞12 h,培养完全后,每个孔中加入20 μL MTT(5 mg·mL-1),于培养箱中孵育4 h,4 h后弃培养液,然后加入100 μL DMSO,震荡混匀后490 nm波长下测定各孔光吸收值,记录结果,分析皮诺敛酸对HepG2细胞的毒性。
1.3.7 甘油三酯及总胆固醇的测定
当细胞密度达到80%以上时,用胰酶将细胞消化为细胞悬液,接种于6孔板中,置于培养箱培养过夜。将贴壁细胞分为以下五组:空白对照组、油酸组、皮诺敛酸组(20、30、40 μmol·L-1)。空白对照组及油酸组用2%培养液培养12 h,而皮诺敛酸组分别用20、30、40 μmol·L-1皮诺敛酸培养12 h,12 h后,空白对照组用2%培养基培养24 h,其他组用0.5 mmol·L-1油酸培养24 h,最后根据说明书检测细胞内甘油三酯及总胆固醇的水平。
2 结果与分析
2.1 红松子油中脂肪酸成分的含量分析
通过GC-MS检测,质谱分析的结果与NIST05标准谱库进行检索比对,确定出每个吸收峰代表的化合物,并根据峰面积计算出每个成分的相对含量。由图1可知,松子油中含有大量的游离脂肪酸,其中包括:棕榈酸、皮诺敛酸、亚油酸、硬脂酸、顺式-9-十八碳烯酸等。通过表1可知,棕榈酸的含量为8.06%,皮诺敛酸的含量为13.41%,亚油酸的含量为38.16%。
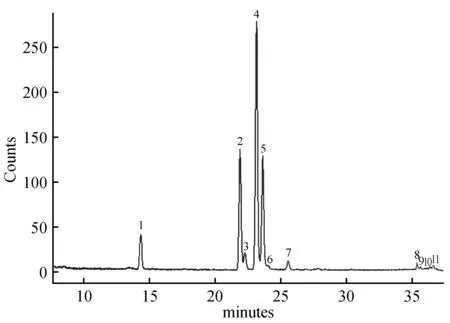
图1 红松子油脂肪酸组成GC-MS 1.棕榈酸;2.皮诺敛酸;3. 5,9-十八碳二烯酸;4.亚油酸;5.顺式-9-十八碳烯酸;6. 13-十八碳烯酸;7.硬脂酸;8. 5,11,14-二十碳三烯酸;9. 7,11,14-二十碳三烯酸;10. 11,14-二十碳二烯酸;11. 11-二十碳烯酸Fig.1 Gas chromatogram of fatty acid composition in koreanpine nut oil 1.Hexadecanoic acid; 2.Pinolenic acid; 3. 5,9-octadecadienoic acid; 4.Linoleic acid; 5.cis-9-octadecenoic acid; 6. 13-octadecenoic acid; 7.Octadecanoic acid; 8. 5,11,14-eicosatrienoicacid; 9. 7,11,14-eicosatrienoic acid; 10. 11,14-eicosadienoic acid; 11. 11-eicosenoic acid
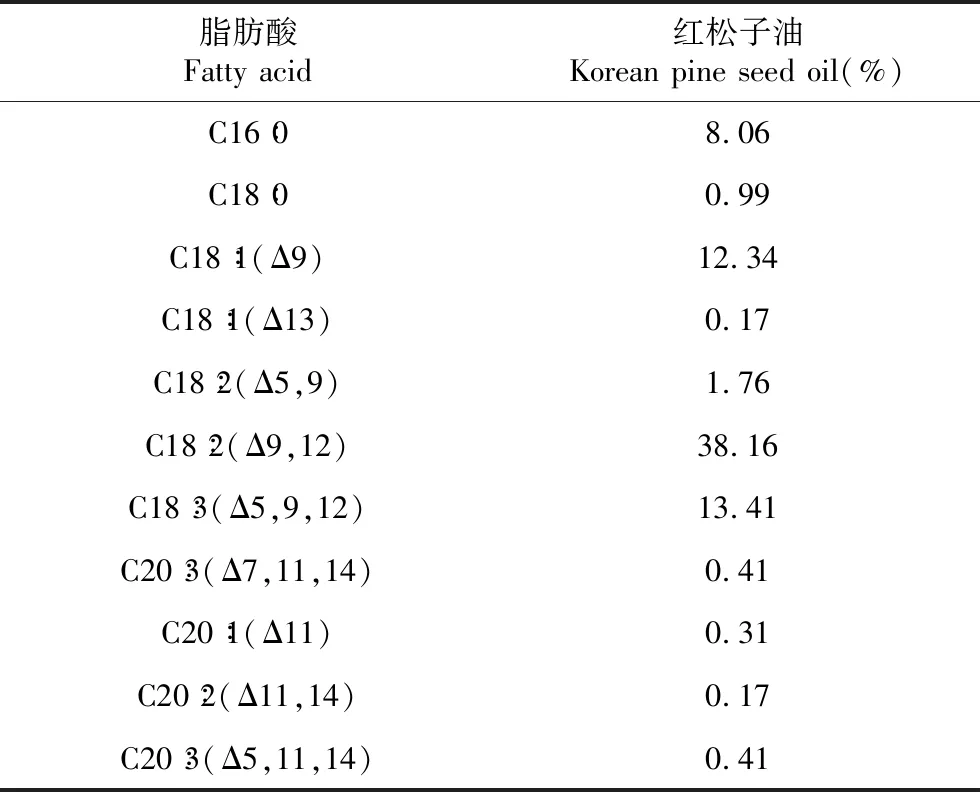
脂肪酸Fatty acid红松子油Korean pine seed oil(%)C16∶08.06 C18∶00.99 C18∶1(Δ9)12.34 C18∶1(Δ13)0.17 C18∶2(Δ5,9) 1.76C18∶2(Δ9,12) 38.16C18∶3(Δ5,9,12) 13.41C20∶3(Δ7,11,14)0.41C20∶1(Δ11) 0.31C20∶2(Δ11,14) 0.17C20∶3(Δ5,11,14) 0.41
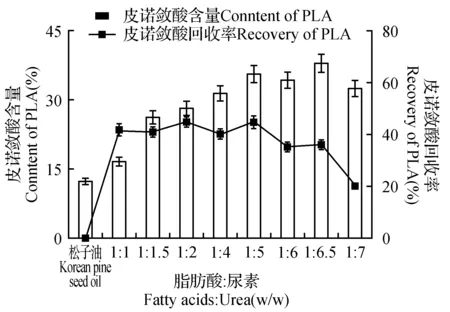
图2 脂肪酸与尿素比例对皮诺敛酸纯化的影响Fig.2 Effect of ratio of fatty acid to urea on the purification of pinolenic acid
2.2 尿素包合法纯化参数的优化
2.2.1 脂肪酸与尿素的比例对皮诺敛酸纯化的影响
在尿素和90%乙醇比例为1∶6,包合温度为4℃,包合时间为24 h时,在这些条件下,考虑脂肪酸与尿素的比例(1∶1、1∶1.5、1∶2、1∶4、1∶5、1∶6、1∶6.5、1∶7)对皮诺敛酸纯化的影响。由图2可知随着脂肪酸与尿素比例的增加,皮诺敛酸的含量先增加后降低,原因可能是随着尿素的增加,包合效果更显著,皮诺敛酸含量增加,而尿素过量时,会阻碍包合晶体生长,导致皮诺敛酸收率降低。因此,综合考虑皮诺敛酸含量为37.96%时,回收率为36%,确定脂肪酸:尿素的最佳比例为1∶6.5。
2.2.2 尿素与乙醇的比例对皮诺敛酸纯化的影响
在脂肪酸与尿素之比为1∶6.5,包合温度为4℃,包合时间为24 h时,在这些条件下,考虑尿素与90%乙醇比例(1∶4、1∶6、1∶8、1∶10)对皮诺敛酸纯化效果的影响。乙醇含量的增加,导致尿素溶解量升高,具有促进包合的作用;而过量的乙醇则导致部分脂肪酸溶于乙醇中,使皮诺敛酸含量降低。由图3可知,随着乙醇的增加,皮诺敛酸收率呈波动性变化。因此,综合皮诺敛酸含量为45.3%时,回收率为42%,确定尿素:乙醇的最佳比例为1∶4。
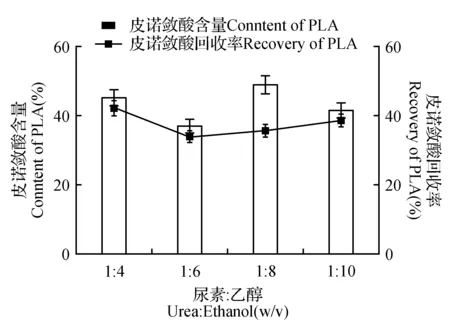
图3 尿素与乙醇比例对皮诺敛酸纯化的影响Fig.3 Effect of ratio of urea to ethanol on the purification of pinolenic acid
2.2.3 包合温度对皮诺敛酸纯化的影响

图4 尿素包合温度对皮诺敛酸纯化的影响Fig.4 Effect of urea inclusion temperature on the purification of pinocyanoic acid
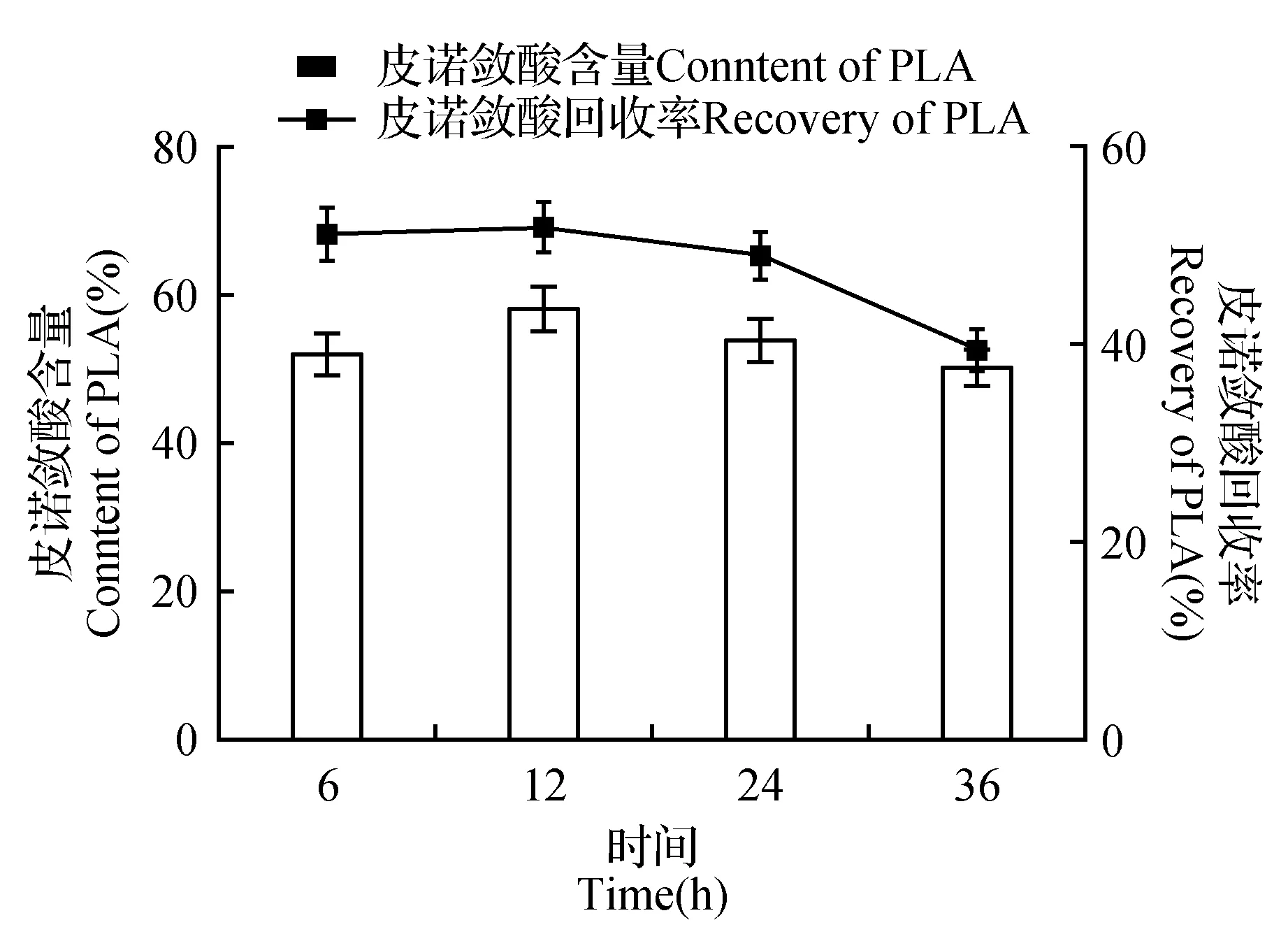
图5 尿素包合时间对皮诺敛酸纯化的影响Fig.5 The effect of urea inclusion time on the purification of pinocyanoic acid
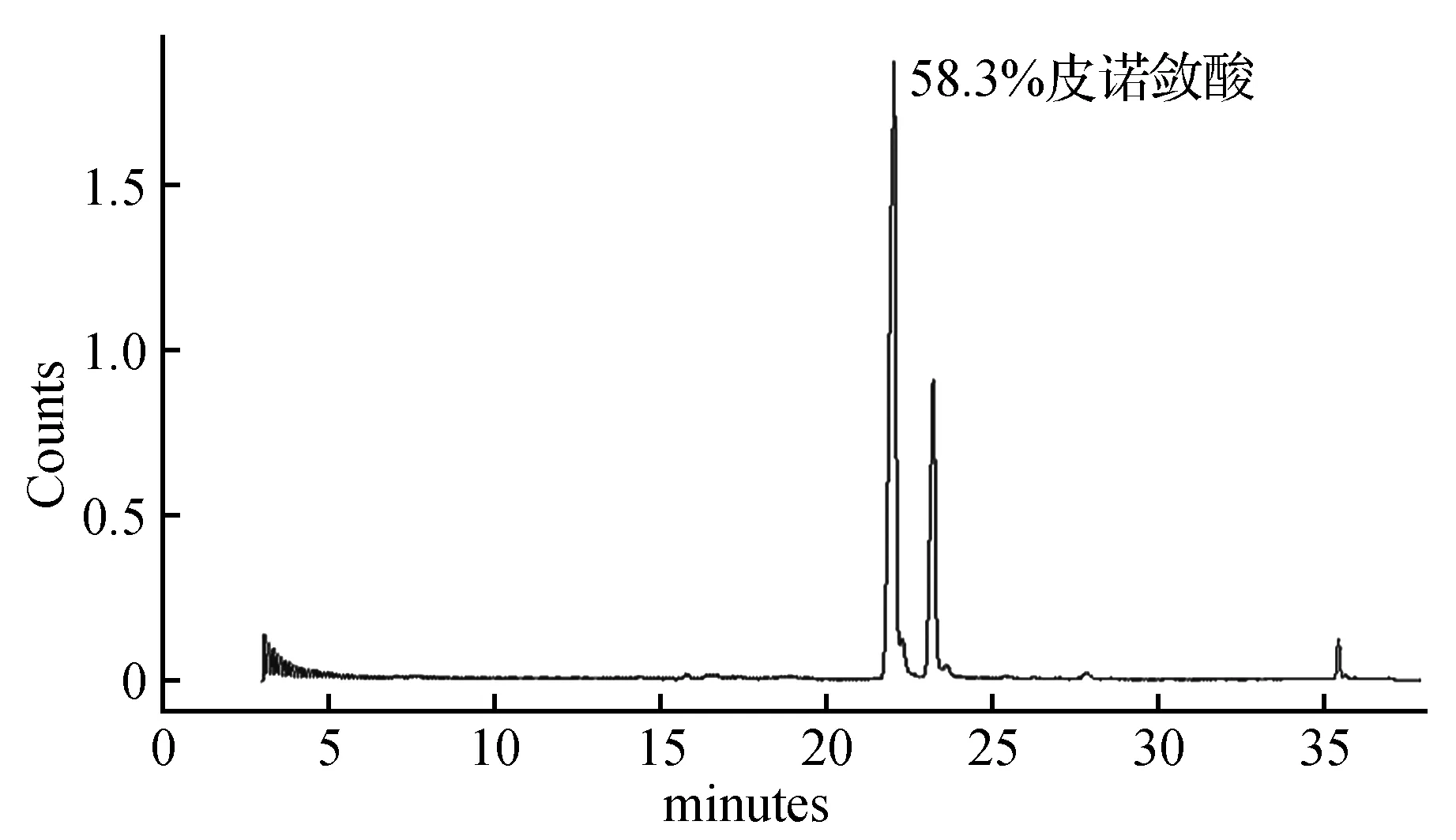
图6 一次尿素包合后皮诺敛酸GC-MS图Fig.6 Meteorological chromatogram of pinolenic acid after a urea inclusion
在脂肪酸与尿素之比为1∶6.5,尿素与乙醇为1∶4,包合时间为24 h时,在这些条件下,考虑包合温度(4、0、-10、-20℃)对皮诺敛酸提纯化效果的影响。包合温度较低时,形成的包合结晶物较快,但脂肪酸包合不牢固,从而使皮诺敛酸含量降低。而温度升高时,溶剂与包合物易同时凝固,导致抽滤难度增大,降低皮诺敛酸的收率。因此,综合皮诺敛酸含量为54%时,回收率为48.8%,确定最佳的包合温度为-10℃(图4)。
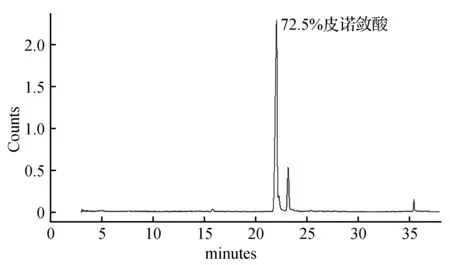
图7 二次尿素包合后皮诺敛酸GC-MS图Fig.7 Meteorological chromatogram of pinolenic acid after secondary urea inclusion
2.2.4 包合时间对皮诺敛酸纯化的影响
在脂肪酸与尿素之比为1∶6.5,尿素与乙醇为1∶4,包合温度为-10℃时,在这些条件下,考虑包合时间(6、12、24、36 h)对皮诺敛酸纯化效果的影响。随着包合时间的延长,包合结晶物会增加,包合效果显著。但随着包合时间继续延长,包合晶体逐渐增多,对皮诺敛酸的携带和吸附也增多,导致了皮诺敛酸含量的降低。因此,综合考虑皮诺敛酸含量为58.3%时,回收率为51.8%,确定最佳的包合时间为12 h(图5)。
2.2.5 纯化产物皮诺敛酸的GC-MS图
采用脂肪酸与尿素之比为1∶6.5,尿素与乙醇之比为1∶4,包合温度为-10℃,包合时间为12 h时,获得如图6所示的GC-MS图,质谱分析的结果与NIST05标准谱库进行检索比对,皮诺敛酸的含量达到58.3%,回收率为51.8%。为了获得更高纯度的皮诺敛酸,进行二次尿素包合,经GC-MS检测皮诺敛酸纯度为72.5%,回收率为64.7%(图7)。
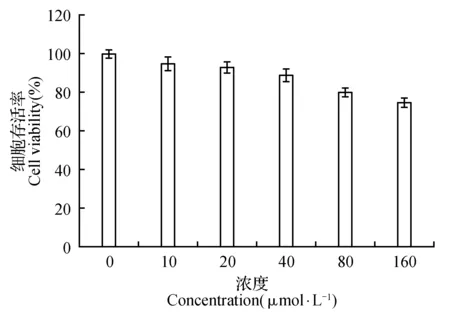
图8 皮诺敛酸对细胞生存率的影响Fig.8 Effects of pinolenic acid on cell viability
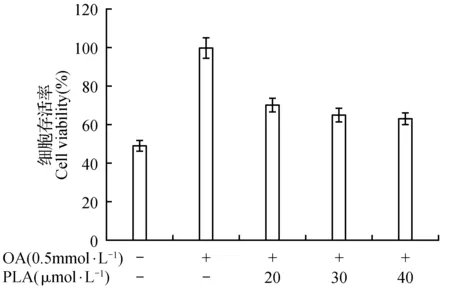
图9 皮诺敛酸对甘油三酯水平的影响Fig.9 The effect of pinolenic acid on triglyceride level
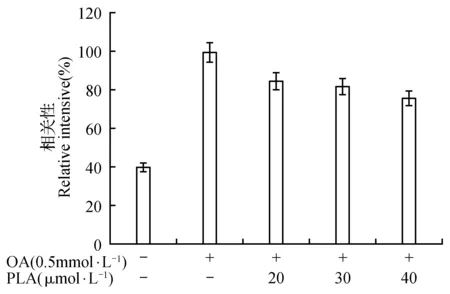
图10 皮诺敛酸对总胆固醇水平的影响Fig.10 The effect of pinolenic acid on total cholesterol level
2.3 皮诺敛酸对细胞活力的影响
由图8可知,随皮诺敛酸浓度的升高,细胞的活力逐渐降低,并且当皮诺敛酸浓度高于80 μM时,细胞的存活率仅80%左右,而当皮诺敛酸浓度低于40 μmol·L-1时,细胞的生存率均在90%左右,因此选择40 μmol·L-1浓度以下的皮诺敛酸用于接下来的实验。
2.4 皮诺敛酸对甘油三酯及总胆固醇水平的影响
由图9可知,油酸组中甘油三酯的含量是空白对照组的二倍,说明油酸成功的诱导细胞成脂。然而随着皮诺敛酸浓度的升高,细胞内甘油三酯的水平逐渐的降低,并在皮诺敛酸浓度为40 μmol·L-1时,其降脂效果最佳,降低了模型中1/3的甘油三酯。由图10可知,油酸组中总胆固醇的水平是空白对照组的二倍多,而加入皮诺敛酸后,细胞中总胆固醇水平呈剂量依赖性的降低,并在40 μmol·L-1时达到最佳的效果。
3 讨论
皮诺敛酸是松子油中独有的十八碳三烯酸,表现出多种对人体有益的生物活性,如降低体重、降血脂、抗氧化等,因此,采用一种高效环保的富集方法用于纯化皮诺敛酸是非常有必要的。本研究以红松子油为原料,优化了尿素包合法中脂肪酸与尿素的比例、尿素与90%乙醇的比例、包合温度、包合时间等参数。研究表明,随着脂肪酸与尿素比例的增加,包合效果更加显著,然而随着尿素含量量的过度增加,使得晶体在包合其他脂肪酸的同时,对皮诺敛酸的携带和吸附也有所增加,导致皮诺敛酸收率降低[6]。因此,综合考虑皮诺敛酸含量及收率,脂肪酸与尿素的最佳比例为1∶6.5(w/w);随着乙醇含量增加,尿素的溶解量逐渐增加,包合向正反应方向进行,而过量的乙醇会导致尿素比例减少,部分脂肪酸溶于乙醇中,使皮诺敛酸含量降低,而且随着乙醇含量的增加,皮诺敛酸收率率呈波动性变化[8]。因此,综合皮诺敛酸含量和收率的考虑,尿素与90%乙醇的最佳比例为1∶4(w/v);包合温度较低时,包合效果向正方向进行,而温度升高时,溶剂与包合物粘连很难分开,导致收率降低[10]。因此,综合考虑皮诺敛酸含量及收率,确定最佳的包合温度为-10℃;随着包合时间的延长,包合效果向正方向进行,而当包合时间为12 h时,反应达到平衡,随着包合时间继续延长,会导致皮诺敛酸的携带增加,含量降低,回收率降低[12]。因此,综合考虑皮诺敛酸含量及收率,确定最佳的包合时间为12 h。在上述条件下,经GC-MS检测获得了纯度为58.3%的皮诺敛酸,回收率为51.8%,经二次尿素包合纯化后可获得纯度为72.5%的皮诺敛酸,回收率为64.7%。
此外,运用油酸诱导HepG2细胞成脂,进一步评估所制备皮诺敛酸的降脂活性。虽然许多国内外研究学者采用动物模型进行实验研究,然而动物模型周期长,个体差异大,影响因素较多等缺点,因此本文采用细胞模型,同样能较好的模拟脂质积累的重要特征[17]。实验结果表明,40 μmol·L-1的皮诺敛酸降低细胞内甘油三酯及总胆固醇水平最佳,说明皮诺敛酸具有一定的降脂作用。
综上所述,利用尿素包合法纯化皮诺敛酸,具有操作简单,成本低,溶剂和尿素都可回收,环境污染小等优点。此外,体外细胞实验进一步确定了40 μmol·L-1皮诺敛酸具有显著的降脂活性。因此,本研究为东北地区红松子油产品的深加工及高附加值开发利用提供了一定数据基础,为皮诺敛酸作为降脂减肥食品提供了新思路。

