耕作制度对胡麻土壤酶活性的影响
陈 军,王立光,叶春雷,李进京,欧巧明,罗俊杰
(甘肃省农业科学院生物技术研究所,甘肃 兰州 730070)
耕作制度是根据作物的生态适应性与生产条件采用的种植方式,是农业土壤用养地结合的一种有效手段,包括单种、复种、休闲、间种、套种、混种、轮作、连作等[1]。甘肃省耕地资源稀缺,因地制宜采用科学的耕作制度,可有效地利用土地资源,保持良好的农业生态环境,并获得较高的经济效益。
土壤养分和土壤酶作为研究土壤环境特征的重要评价指标逐渐成为热点议题[2-3]。近年来,有关土壤酶活性方面的研究主要集中在农田、森林以及沙漠化生态系统,酶活性、土壤养分及碳氮磷循环、土壤微生物区系、环境因子方面的基础研究[4-5]。大量研究表明,土壤酶活性在作物生长发育及产量方面均产生重要的影响[6]。张英英等[7]研究了不同耕作措施下的旱作农田土壤参与碳循环的酶类与有机碳组分间关系,指出蔗糖酶活性增加对有机碳积累作用最显著,过氧化物酶有利于总有机碳的积累。黄召存等[8]从保护性耕作方式角度对蚕豆土壤酶活性做了一定的研究。但涉及到胡麻栽培及耕作制度轮转带来的微生态方面的效应特征、作用机制方面的报道较少。因此,探究不同耕作制度条件下土壤的生物化学过程将有助于对土壤养分循环进行科学调控[8]。
陈军等[2]前期研究发现不同耕作制度下土壤水浸提液对胡麻种子萌发有不同程度的抑制作用,且抑制效应由大到小依次是胡麻连作>小麦‖胡麻>撂荒休闲>小麦连作。土地“轮作、连作、间作、休闲”制度后发生了哪些变化值得人们去思考。本文设“轮作、休闲、连作、间作、休闲1年-种植”5种耕作模式,探究不同耕作制度对胡麻土壤酶活性变化特征的影响,结合多元线性回归,分析不同耕作制度对土壤的应答机制,寻找制约土壤酶及养分的相关影响因子,并结合当下农业发展的实际情况,为国家提出的休耕制度试点应用提供一些参考依据。
1 材料与方法
1.1 研究区概况
研究区位于甘肃省榆中县陈家庄良种农场(35°50′36.06″N, 104°06′35.27″E),属黄土高原丘陵沟壑半干旱高寒区,土壤为黄绵土,海拔1 600 m,年均降雨量450 mm,蒸发量1 400~1 450 mm,年平均气温6.6℃,≥10℃有效积温2 625℃,无霜期138 d。
1.2 试验材料及来源
供试胡麻品种为陇亚10号,由甘肃省农科院作物所提供。
1.3 试验设计
本试验建立在2014年胡麻残茬地的基础上,于2015-2016年进行试验。设置5种耕作模式,分别为T1:小麦-胡麻轮作;T2:胡麻连作;T3:小麦‖胡麻;T4:休闲;T5:休闲1年-胡麻。试验采用随机区组排列,3次重复。小区长6 m,宽4.5 m,每个小区面积为27 m2,各小区间以宽60 cm、高50 cm的土埂分隔,防止小区间土壤干扰。试验地基础土壤状况见表1,其他管理与当地大田一致。
1.4 测定方法
胡麻播种时间为2016年4月1日,于胡麻枞形期(5月20日)、盛花期(7月12日)、硕果期(8月10日)分别采样,分表土层(0~20 cm)和亚土层(20~40 cm)2个土层梯度,参考“S”取样法,采集植株垂直下方根际土壤,每个小区取5个采样点,土样混合均匀后收集1 000 g,过 0.2 mm筛后保存于 4℃冰箱,用于土壤酶活性的测定。

土壤理化性质由甘肃省农科院质量与标准研究所测定;试验所用酶标仪为DNM-9602G型酶标分析仪。
1.5 统计方法
数据统计分析和作图分别采用SPSS 20.0和Excel 2010软件。
2 结果与分析
2.1 胡麻关键生育期土壤酶活性变化特征
2.1.1 胡麻枞形期各处理的土壤酶活性 从图1可以看出,胡麻枞形期表土层不同处理4种土壤酶活性均在处理间无显著差异,说明不同耕作制度在胡麻生长前期对土壤的影响不明显。土壤蔗糖酶活性介于23.63~31.93 mg·g-1·d-1之间,脲酶活性介于4.02~6.19 mg·g-1·d-1之间,过氧化氢酶活性介于1.30~1.92 mL·g-1·h-1之间,碱性磷酸酶活性介于6.22~10.29 mg·g-1·d-1之间。从图2可以看出,亚土层土壤过氧化氢酶活性T5为2.52 mL·g-1·h-1,显著高于T3;碱性磷酸酶活性T3为7.96 mg·g-1·d-1,显著高于T5,2种酶之间的差异可能与间作小麦有关,其他处理间无显著差异。蔗糖酶活性介于20.20~30.67 mg·g-1·d-1之间,脲酶活性介于2.28~3.07 mg·g-1·d-1之间。
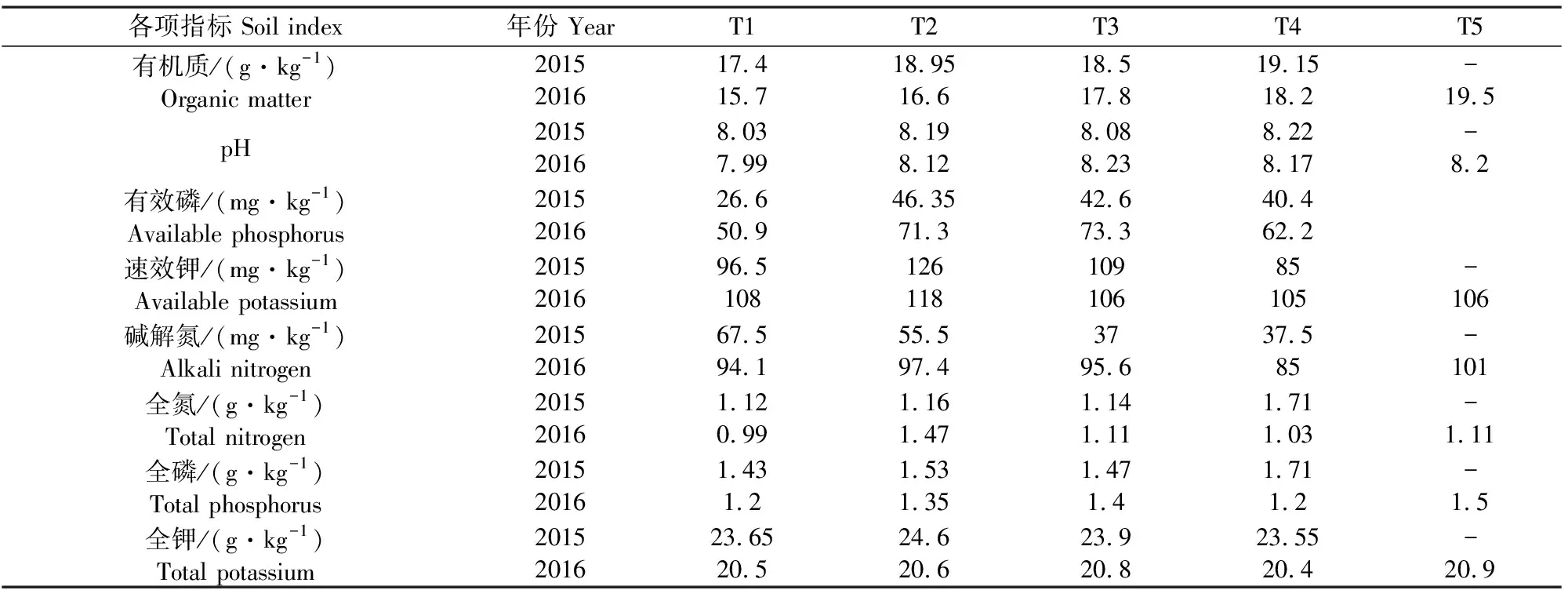
表1 试验地土壤基本理化性质
注: “-”表示无数据,原因是2015年T5为休闲处理,与T4是相同处理,为休闲(第1年)。
Note: “-” means no data, because the T5 was a fallow treatment in 2015, and the same treatment as T4 was fallow (the first year).

注:T1:小麦-胡麻轮作;T2:胡麻连作;T3:小麦‖胡麻;T4:休闲;T5:休闲1年-胡麻。不同小写字母表示处理间差异显著(P<0.05),下同。Note: T1:Wheat-flax rotation; T2: Flax continuous cropping; T3: Wheat-flax intercropping; T4: Fallow; T5: Fallow-flax rotation. Different lowercase letters in the same column indicate significant difference at P<0.05 level, the same below.图1 胡麻枞形期各处理的土壤酶活性(0~20 cm土层)Fig.1 Soil enzyme activities of different treatments in flax shapping period (0~20 cm soil layer)
2.1.2 胡麻盛花期各处理的土壤酶活性 从图3可以看出,胡麻盛花期表土层不同处理间土壤过氧化氢酶活性无显著差异,介于0.26~0.49 mL·g-1·h-1之间;蔗糖酶活性T5为29.83 mg·g-1·d-1,显著低于其他处理,T1、T2、T3和T4分别较T5提高44.6%、53.3%、61.9%和34.9%;脲酶活性T4为0.86 mg·g-1·d-1,T5、T1和T2分别较T4提高266.0%、157.0%和140.0%,说明脲酶活性与作物自身的生殖生长关系密切;碱性磷酸酶活性T3为11.35 mg·g-1·d-1,显著高于T2。从图4可以看出,亚土层土壤不同处理间蔗糖酶活性无显著差异,介于13.43~40.83 mg·g-1·d-1之间;脲酶活性T2为1.74 mg·g-1·d-1,T5为1.69 mg·g-1·d-1,显著高于T1、T3和T4;过氧化氢酶活性T1为1.56 mL·g-1·h-1,较T5提高212.0%;碱性磷酸酶活性T5为8.56 mg·g-1·d-1,较T4提高了21.6%。

图2 胡麻枞形期各处理的土壤酶活性(20~40 cm土层)Fig.2 Soil enzyme activities of different treatments in flax shapping period (20~40 cm soil layer)

图3 胡麻盛花期各处理的土壤酶活性(0~20 cm土层)Fig.3 Soil enzyme activities of different treatments at the flowering stage of flax (0~20 cm soil layer)
2.1.3 胡麻硕果期各处理的土壤酶活性 从图5可以看出,胡麻硕果期,表土层不同处理间土壤蔗糖酶、脲酶、碱性磷酸酶活性均无明显差异,蔗糖酶活性介于62.42~76.93 mg·g-1·d-1之间,脲酶活性介于4.81~6.03 mg·g-1·d-1之间,碱性磷酸酶活性介于5.67~9.39 mg·g-1·d-1之间;过氧化氢酶活性T2和T3分别为1.41 mL·g-1·h-1和1.51 mL·g-1·h-1,显著高于T1、T4和T5,后者分别为0.75、0.67 mL·g-1·h-1和0.59 mL·g-1·h-1。从图6可以看出,亚土层不同处理间土壤蔗糖酶、脲酶活性无显著差异,蔗糖酶活性介于34.73~55.45 mg·g-1·d-1之间,脲酶活性介于1.95~3.82 mg·g-1·d-1之间;过氧化氢酶活性T5为0.82 mL·g-1·h-1,显著低于T2,后者为1.69 mL·g-1·h-1;碱性磷酸酶活性T3为3.78 mg·g-1·d-1,显著低于T5,较T5降低2.26倍。
2.2 土壤酶活性间相关性分析
由表2可以看出,蔗糖酶与碱性磷酸酶间显著负相关,与脲酶和过氧化氢酶间正相关,其余酶间为负相关,说明4种酶活性的表达是相互影响的,这与杨宁等[12]研究的结果相吻合。

图4 胡麻盛花期各处理的土壤酶活性(20~40 cm土层)Fig.4 Soil enzyme activities of different treatments at the flowering stage of flax (20~40 cm soil layer)

图5 胡麻硕果期各处理的土壤酶活性(0~20 cm土层)Fig.5 Soil enzyme activities of different treatments at the fruit stage of flax (0~20 cm soil layer)

图6 胡麻硕果期各处理的土壤酶活性(20~40 cm土层)Fig.6 Soil enzyme activities of different treatments at the fruit stage of flax (20~40 cm soil layer)

表2 土壤酶活性间相关系数
注:相关分析所用数据为表土层与亚土层数值的平均值,“*”表示P<0.05水平下显著相关。
Note: The data used in the correlation analysis is the average of the values of the topsoil and the subsoil, “*” indicates a significant correlation atP<0.05 level.
2.3 土壤养分与土壤酶活性的直接和间接作用
通径分析是进行相关系数分解的一种统计方法,其意义为在多个自变量X1,X2,…,Xm,Y的相关分析中,得到Xi对Y的直接影响力和间接影响力,而且还可以在X1,X2,…,Xm,Y间的复杂相关关系中,从某个自变量与其他自变量的“协调”关系中得到对Y的最佳影响路径信息,即从复杂的自变量相关网中,得到某个自变量决定Y的最佳路径,具有决策意义[13]。与典型相关分析相比,通径分析提供更多信息,可揭示土壤酶活性与各理化性质的密切程度,且能指出这种关系中哪种作用处于主导地位[14-15]。将土壤理化性质和土壤酶活性进行逐步回归分析,设土壤养分因子为自变量Xi={X1,X2,X3,X4,X5,X6,X7,X8}={有机质,pH,有效磷,速效钾,碱解氮,全氮,全磷,全钾},土壤酶活性为因变量Yi={Y1,Y2,Y3,Y4}={脲酶,蔗糖酶,碱性磷酸酶,过氧化氢酶}。
通过通径系数、间接通径系数及其与Y的相关系数总效应(表3)可以看出,表土层中Y1受土壤中X1、X6、X7影响较大,Y2受土壤中X1、X2、X3、X7、X8影响较大,Y3受土壤中X1、X2、X6、X7影响较大,Y4受土壤中X1、X2、X3、X6、X7、X8影响较大,其他因子因彼此间接作用导致对土壤酶活性的影响变小。
决策系数是通径分析中的决策指标,用它可把自变量对响应变量的综合作用进行排序,确定主要决策变量和限制变量。其计算公式:R2(i)=2Pi×riy-Pi2,式中:R2(i)为自变量i的决策系数;Pi为自变量的直接通径系数;riy为自变量i与响应变量Y的相关系数。R2(i)>0,表明自变量对响应变量起增进作用,R2(i)<0,表明自变量对响应变量起抑制作用。
进一步通过决策系数总效应(表5)可以看出,表土层中X5、X8为Y1主要抑制因子,X3、X4、X8为Y2主要抑制因子,X2、X7为Y2主要促进因子,X5、X6、X8为Y3主要抑制因子,X1、X2为Y3主要促进因子,X3、X4、X5、X6、X8为Y4主要抑制因子,X2、X7为Y4主要促进因子。
通过通径系数、间接通径系数及其与Y的相关系数总效应(表4)可以看出,亚土层中Y1受土壤中X1、X3、X4、X8影响较大,Y2受土壤中X1、X2、X3、X6、X7、X8影响较大,Y3受土壤中X1、X3、X6、X7、X8影响较大,Y4受土壤中X1、X2、X7影响较大,其他因子作用不明显。
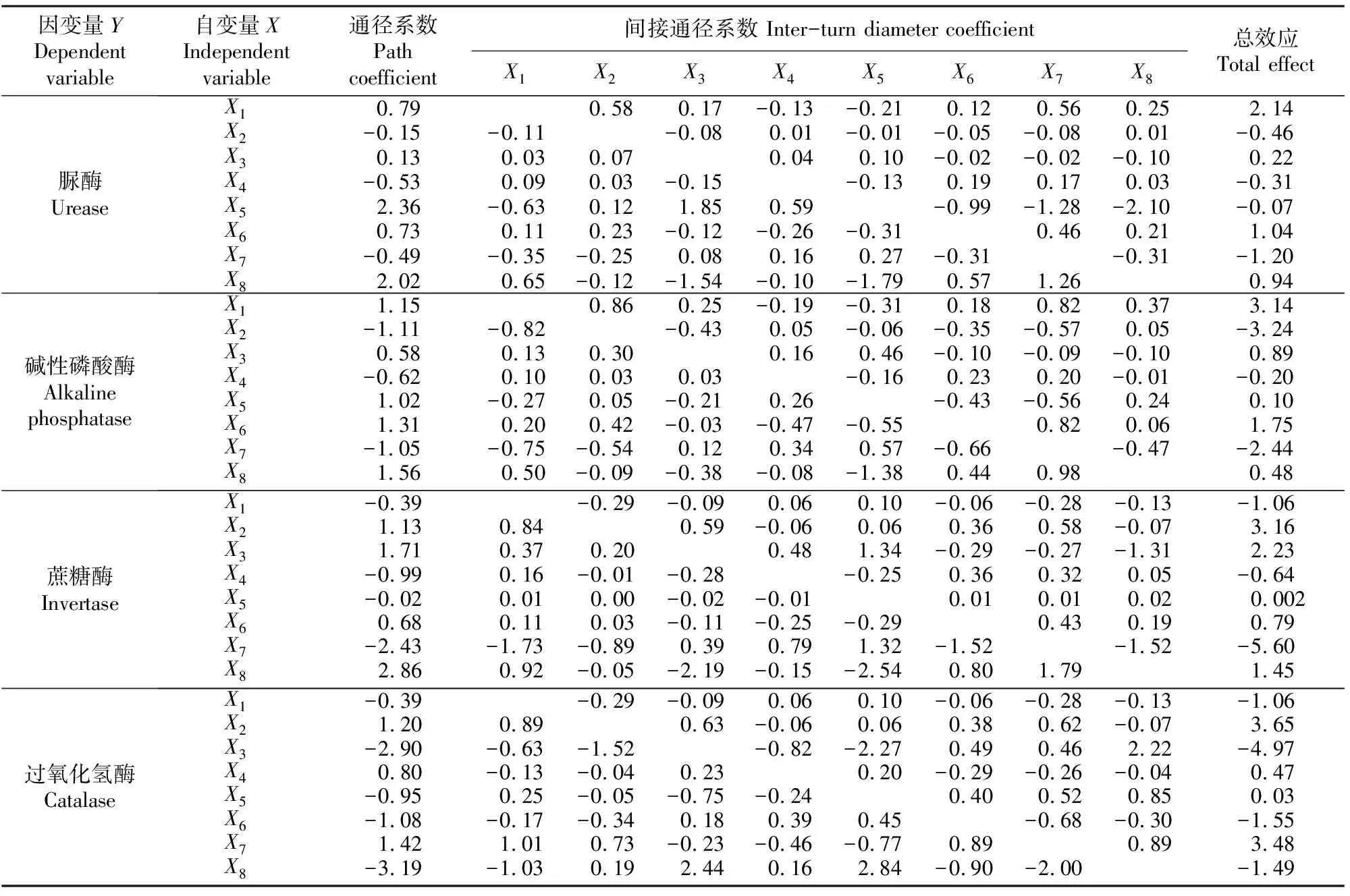
表3 表土层土壤有机质、pH及土壤养分与土壤酶活性间的通径分析
注:自变量Xi={X1,X2,X3,X4,X5,X6,X7,X8}={有机质,pH,有效磷,速效钾,碱解氮,全氮,全磷,全钾},下同。
Note: The independent variablesXi={X1,X2,X3,X4,X5,X6,X7,X8}={organic matter, pH, available phophorus, available potassium, alkali nitrogen, total nitrogen, total phosphorus, total potassium}, the same below.

表4 亚土层土壤有机质、pH及土壤养分与土壤酶活性间的通径分析
通过决策系数总效应(表6)可以看出,亚土层中,X8为Y1主要促进因子,X1、X7、X6、X4、X2、X5为Y1主要抑制因子,X3、X8、X5、X4、X6、X1、X7为Y2主要抑制因子,X7为Y3主要促进因子,X3、X8、X5、X6、X2、X4为Y3主要抑制因子,X2为Y4主要促进因子,X1、X7、X3、X5、X6、X2、X8为Y4主要抑制因子,且抑制作用依次减弱。
表5表土层土壤有机质、pH值及土壤养分与
土壤酶活性(Y)的决策系数总效应
Table5Totaleffectofdecisioncoefficientsofsoilenzyme
activity(Y)withsoilorganicmatter,
pHvalue,andsoilnutrientintopsoil

变量VariableX1X2X3X4X5X6X7X8Y10.7400.024-0.005-0.443-12.383-0.7240.165-4.005Y20.1831.106-3.103-1.556-0.001-0.5813.830-8.295Y31.5871.161-0.276-0.843-3.629-2.8070.388-3.451Y40.1811.527-2.724-1.027-2.023-1.5811.374-10.039
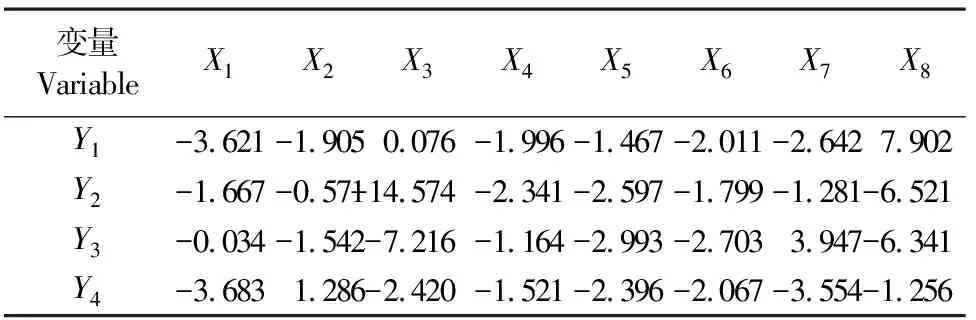
表6 亚土层土壤有机质、pH值及土壤养分与土壤酶活性(Y)的决策系数总效应
3 讨论及结论
有关土壤酶活性的相关报道很多,王灿等[16]、李秀玲等[17]分别从不同施肥情况研究了土壤酶及养分变化规律;王文锋等[18]提到“较低-较适-较高”温度变化能够引起土壤酶活性的动态变化。剡斌[19]认为胡麻与小麦轮作能提高 0~10 cm 土层土壤脲酶和过氧化氢酶活性,与轮作前、休闲和胡麻连作相比,胡麻轮作 0~10 cm 土层土壤脲酶活性分别提高 437.65%、682.86%和 34.27%。Gurpreet等[20]认为脲酶和磷酸酶是土壤有机质降解和氮磷等养分转化相关的重要酶类。伏星舟[21]认为不同耕作方式可以通过改变土壤理化性质、激发酶活性从而使玉米田CO2的释放发生不同程度的改变。
土壤蔗糖酶参与植物糖分的运输贮藏、碳水化合物的代谢过程,是植物生长和发育所需碳源、能源相关的关键酶。研究表明,随着胡麻生育期变化,不同土层不同处理蔗糖酶活性变化稳定,只在盛花期T5处理显著低于其他处理,其他处理间无显著差异,说明耕作制度的更替对蔗糖酶活性的影响不明显。土壤脲酶活性常用于表征土壤的氮素情况,并能间接反映出土壤的生产力。不同土层不同处理间脲酶活性在胡麻枞形期、硕果期均无显著差异,在盛花期存在差异,可能与胡麻进行生殖生长与土壤微环境争夺氮素营养相关。
土壤碱性磷酸酶主要参与土壤含磷化合物的合成及土壤磷素循环,其活性的高低会直接影响土壤中有机磷的分解转化和生物有效性。表土层不同处理间碱性磷酸酶活性在胡麻枞形期、硕果期均无显著差异,在盛花期2个土层梯度均存在差异,主要表现在胡麻连作与小麦‖胡麻间的显著差异,以及亚土层区休闲处理与休闲1年-胡麻间的显著差异,原因可能是胡麻连作降低了碱性磷酸酶活性,也可能是耕作制度更替打破了单一作物生长的微环境,促进物质与能量相互交流,进而影响酶活性。土壤过氧化氢酶在生物氧化过程中起分解过氧化氢的作用,其酶活性用于表征土壤生物氧化过程的强弱。胡麻硕果期,表土层过氧化氢酶活性小麦-胡麻轮作、休闲、休闲1年-胡麻3种处理显著低于小麦‖胡麻和胡麻连作处理;亚土层过氧化氢酶活性在胡麻生长不同时期均有差异,原因可能是胡麻根系小,对亚土层的影响要远小于土壤微生物的活动,微生物活动改变菌群数量与种类,影响微生物区系环境的同时影响酶活性。
由于轮休制度下土壤环境对胡麻生长的影响各不相同,且各种生态因子间相互作用,因而应采用多元线性逐步回归分析法寻找影响土壤酶活性的主要土壤因子[22-23]。冉启洋等[24]认为土壤养分是影响土壤酶活性的主要因子,王文锋等[18]也提出了氮磷钾配施可有效提高土壤酶活性的论据。本研究表明:耕层不同土壤酶活性受土壤养分因子影响的多重效应不同,pH、全磷含量能够促进蔗糖酶、过氧化氢酶活性;有机质、pH含量促进碱性磷酸酶活性;亚土层不同土壤酶活性受土壤因子影响的多重效应增加,且主要为限制因子。

