番茄红素的特性和应用研究进展
安建勇 白鹏勋 崔茂盛 乔家运 王文杰
(天津市畜牧兽医研究所,天津市 300384)
番茄红素是目前发现的600种类胡萝卜素(carotenoid)之一,在1910年通过实验方法被成功提取[1]。类胡萝卜素可以分为碳氢结构类胡萝卜素,包括番茄红素、β胡萝卜素或叶黄素。Schunck在发现番茄中这种特殊的色素与胡萝卜中的类胡萝卜素具有不同的吸收光谱后,将其命名为番茄红素。番茄红素是众多番茄产品的主要色素,并且是番茄中起主要功能的化学成分。研究表明,摄入的番茄制品越多,罹患若干种癌症和心血管疾病的风险就越低。这主要得益于番茄红素的抗氧化性能,它可以保护细胞对抗氧化损伤从而降低慢性疾病的发生风险。此外,番茄红素还具有介导细胞通讯和调节内分泌系统和免疫系统的作用[2]。动物和人体不能合成类胡萝卜素,食物是唯一获取来源。至少85%的番茄红素是来自番茄或番茄制品,这些制品中番茄红素的含量从42mg/kg到365mg/kg不等[3],番茄加工副产物中亦含有丰富的番茄红素。
1 结构特性
Willstatter和Escher计算出番茄红素的分子结构式为C40H56,他们同时证明番茄红素是胡萝卜素的异构体。Karrer等发表了番茄红素的分子结构式,如图1所示。此后Kuhn和Grundmann通过对番茄红素进行铬酸氧化并分析其降解产物,对该分子结构式进行了验证[1]。番茄红素的分子量为536.85道尔顿,为含11个共轭双键的脂肪烃,具有红色和脂溶性的特性。番茄红素的吸收光谱在可见光范围,溶解在石油醚中最大吸收波长为472nm[1]。由于番茄红素具有11个C-C双键,理论上具有211个异构体[4]。在自然界中番茄红素主要以全反式构型存在,因为这种构型具有最稳定的热力学结构[5]。但是,现在发现植物体内合成的全反式构型与热力学稳定性无关。在人体血浆中,番茄红素以各种异构体混合的形式存在,至少60%的番茄红素以顺式结构存在[4,6]。 全反式、5-顺式、9-顺式、13-顺式和15-顺式是最常见的异构体形式。他们的稳定性顺序为5-顺式>全反式>9-顺式>13-顺式>15-顺式>7-顺式>11-顺式[4,6]。所以从热力学稳定性上讲5-顺式比全反式的结构更稳定。而基于Zechmeister[5]的研究发现生物合成异构体几乎全部为全反式。只有番茄红素上少数烯醇基团由于空间位阻的作用能够产生顺式异构体。实际上,只有72种顺式番茄红素异构体在各种实验中被检测到[1]。
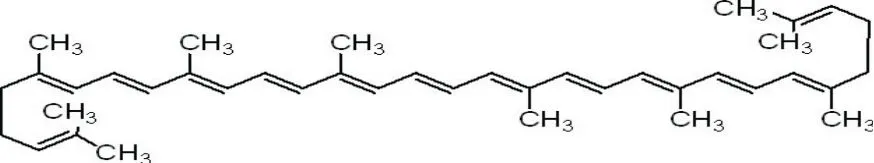
图1 番茄红素分子结构式
Lee和Chen等研究发现[7],在50℃下,12h内全反式结构无显著性变化;在100~150℃下,9h内主要进行异构体变化,之后则开始降解。番茄红素主要在小肠中进行吸收。在小肠组织中的检测发现,顺式结构比全反式结构的含量显著要高[8]。这可能是由于顺式结构的番茄红素更容易吸收。在摄入加工后的番茄汁后,人体血清中番茄红素的水平显著上升,但是食用未加工的番茄,上升不明显[8]。相似的,Gartner等[9]发现番茄膏调味的食品可使血清中番茄红素提高2.5倍,但以鲜番茄提供的相同剂量的番茄红素不能够提高血清中的番茄红素。加工后番茄制品的生物利用率提升可能是由于加工过程使番茄红素从植物组织中释放出来,同时加热过程破坏了番茄红素-蛋白质复合体,同时使全反式结构转变为更易吸收的顺式结构[10]。
2 生物活性
番茄红素对机体的保护作用包括:抗氧化作用;增加细胞与细胞的通讯;减少突变的发生;抑制癌细胞增殖;提高抗肿瘤免疫反应[11]。
众多研究推测番茄红素对健康有裨益都是基于番茄红素具有对抗氧化损伤的作用[1]。Velmurugan等[12]发现番茄红素可以通过上调谷胱甘肽依赖型肝脏排毒系统来阻断胃癌的发生,也因此可以保护致癌物诱发的氧化损伤。他们发现番茄红素在癌症发生过程中能够提高谷胱甘肽(GSH)浓度,刺激肝脏排毒系统中的谷胱甘肽过氧化物酶(GSH-Px)、谷胱甘肽转移酶(GST)和谷胱甘肽还原酶(GR)通过清除亲电子部分来对抗化学致癌物的危害,因此也可改变肿瘤在肝脏其他部位的发展。
另有研究认为低浓度的番茄红素衍生物可能具有类激素活性,这些衍生物可以作为细胞核受体的基团,作用方式类似于类胡萝卜素产生的维甲酸。在人类乳腺癌细胞中的研究显示,番茄红素可以刺激AP-1(Activating Protein-1),而类胰岛素因子1对AP-1具有抑制作用[13]。
细胞间隙连接(GJC)是细胞与细胞的通道,这种连接可以使细胞间交换低分子量物质如营养物质和信号分子。Austa等[6]通过WB-F344细胞实验证明番茄红素的其他氧化产物可以影响细胞通讯。非肿瘤细胞的通讯都是通过GJC来完成,然而大多数的肿瘤细胞都具有同质或异质的GJC功能失调[14]。目前的研究显示番茄红素降解产物通过细胞间隙连接可以增强细胞与细胞的通讯。细胞培养的证据表明β胡萝卜素中间裂解产生的维甲酸和类胡萝卜素产生的4氧代维甲酸是触发GJC的最终激活成分[15]这从侧面支持了番茄红素的作用。
3 动物中的应用效果
Yang等[1]总结了番茄红素在实验动物中的作用效果。将C-6神经胶质瘤细胞移植到小鼠中,番茄红素能够抑制细胞的增殖,在移植前投喂抑制作用更强。长期服用番茄红素(0.5mg/kg)能够显著延迟SHN处女鼠乳腺瘤细胞的启动和生长。这种作用是由于番茄红素可以降低乳腺中胸苷酸的合成并减少血清中自由脂肪酸和催乳素水平。番茄红素能够增加T细胞来增强身体的免疫反应。番茄红素和叶黄素在低剂量时可以减少Sprague-Dawley鼠N甲基亚硝脲诱导的异常腺窝病(ACF)。Levy等研究发现番茄红素可以有效抑制人类子宫内膜、乳腺(MCF-7)和肺(NCI-H226)细胞增殖,同时可以抑制类胰岛素生长因子刺激的细胞生长。
Olson等[16]以白来航蛋鸡为实验材料,鸡群随机分为4组分别饲喂0mg/kg,65mg/kg,257mg/kg和650mg/kg的番茄红素,第15d开始采集鸡蛋对蛋品质和血液指标进行测定,结果发现:番茄红素饲喂组蛋黄颜色显著加深(P<0.01)。饲喂0mg/kg,65mg/kg,257mg/kg和650mg/kg番茄红素实验组蛋黄颜色的罗氏比色扇(RYCF)评分分别为8.5,11.5,12.0,12.0.高效液相色谱对饲喂组蛋黄中的番茄红素进行测定显示257mg和650mg组蛋黄中番茄红素富集量为4mg/kg,显著高于空白组和65mg组(P<0.05)。
Sun等[17]应用720只杏花鸡进行实验,鸡群随机分为4组,各组纯番茄红素的添加量分别为0.06mg/kg,10.45mg/kg,26.56mg/kg和35.96mg/kg,分别于 0d、7d、14d、21d、28d、35d 收集鸡蛋并进行测定,结果显示7~35d鸡蛋的RYCF评分与空白组相比均显著增高(P<0.05),同时番茄红素高饲喂组显著高于低饲喂组(P<0.05)。血液抗氧化指标显示番茄红素可以显著增加21d血清和35d肝脏中SOD和T-AOC的水平(P<0.05)。番茄红素可以显著增加 21d、28d和 35d血清中 GSH水平(P<0.05),但是对CAT和MDA的影响不显著。
Akademir等[18]应用90只白来航蛋鸡进行研究,鸡群随机分为3组,分别饲喂基础日粮、5g/kg和10g/kg的番茄粉,番茄粉含番茄红素6%。饲喂番茄粉组的采食量、产蛋率、蛋重、蛋黄重和蛋黄颜色均显著高于对照组(P<0.05)。同时,随着番茄粉添加量的升高,采食量(P<0.01)、产蛋率(P<0.01)、蛋重(P<0.01)、蛋黄重(P<0.01)和蛋黄颜色(P<0.01)均有显著提高。同时,饲喂组血清和蛋黄中MDA含量比对照组均显著降低(P<0.01)。
Sahin等[19]应用90只日本鹌鹑进行研究,群体随机分为3组,日粮中分别添加0,100mg/kg和200mg/kg的番茄红素,并将含有番茄红素的鹌鹑蛋给15名30~40岁的志愿者服用。结果显示番茄红素可以显著增加鹌鹑的采食量(P<0.01)并增加产蛋量(P<0.01)。蛋黄颜色加深(P<0.01),且蛋黄中MDA降低(P<0.01)。志愿者血清中番茄红素与蛋中的番茄红素成显著性回归关系(P<0.01),其血清中MDA浓度与鹌鹑蛋中的MDA浓度呈显著性回归关系(P<0.01)。
番茄红素最佳的添加量目前还不清楚,上述实验中的添加量可以作为参考。番茄红素尚未发现毒性,其添加量似乎可以不设上限。一种叫NTOE的专利产品源自番茄自然提取物,含有6%的番茄红素。Matulka等对NTOE的毒性进行了测试,他应用Sprague-Dawley大鼠进行实验。口服50%致死剂量(LD50)大于5000mg/kg体重摄入。应用80只公鼠和80只母鼠进行13周实验,结果无可见损害剂量(NOAEL)为4500mg/kg/d[20]。
综上所述,番茄红素具有显著的抗氧化作用,能够保护机体免受氧化损伤,同时可以增加细胞通讯和提高肿瘤免疫反应的作用。家禽饲喂实验也证明番茄红素能够提高一定的生产性能,并且可以提高蛋品品质尤其是可以提高蛋黄颜色。这表明番茄红素是一种潜在的功能性饲料添加剂。同时,大剂量的动物毒性实验未发现可见不良反应。值得注意的是,植物中的番茄红素主要是全反式结构,加热或辐射方式可以使全反式结构转化为顺式结构从而增加肠道吸收,提高番茄红素的使用效果。目前在家禽中的添加剂量从几十毫克到几百毫克每公斤不等,且实验群体较小,在大群体中的最优添加剂量还需要进一步研究。

