小麦霉菌侵染程度电子鼻快速检测方法的初步研究
赵天霞 沈 飞 周曰春 刘 潇 方 勇 李 彭 裴 斐 邢常瑞
(南京财经大学食品科学与工程学院;江苏省现代粮食流通与安全协同创新中心1,南京 210023)(南京灵山粮食储备库有限公司2, 南京 211599)
小麦是我国的主要粮食品种之一,但也是最易被霉菌污染的食品原料之一。小麦中富含的营养物质是微生物生长的良好培养基,当环境条件适宜时,微生物就会繁殖,造成小麦霉烂变质[1]。霉菌滋生不仅消耗谷物中的营养物质,使谷物品质降低,还会产生真菌毒素,对人畜健康造成了严重威胁[2]。因此,小麦霉变状况的检测分析具有重要意义[3]。从目前来看,常用的小麦霉变检测方法包括平板计数法[4]、酶联免疫法[5]、荧光染色法[6]等,虽然这些方法的检测精度普遍较高,但均存在过程繁琐、时效性差等不足,不能满足现场实时检测的需求,存在很大局限性[7]。因此,急需发展一种快捷方便的检测技术来解决小麦霉变的检测难题。
近年来,基于气敏传感器阵列和模式识别的电子鼻技术已在环境检测[8]、食品[9-10]、化工[11]、医药[12]等领域得到了广泛应用。电子鼻由非特定的化学检测器组成,它们与不同的挥发性分子相互作用并提供电子信号,可以有效地用作与产品相关的挥发性分子的指示,并通过模式识别系统识别和量化气味,在谷物霉变快速检测中具有巨大的应用潜力[13]。崔丽静等[14]采用电子鼻技术对40个正常玉米样品和41个霉变样品建立了识别模型,并通过优化10个传感器组合,提高了样品的霉变判别率。Eifler等[15]利用电子鼻差异检测小麦籽粒中的镰刀菌,结果显示,电子鼻能较好地区分感染镰刀菌和未感染的小麦谷粒,且准确度高于80%。Campagnoli等[16]通过研究验证了电子鼻可以区分已被黄曲霉毒素污染的样品和未被污染的样品,且电子鼻能够通过直接检测毒素和基于检测与黄曲霉毒素相关的挥发性真菌代谢物的间接识别来检测污染。沈飞[17]等对谷物中常见霉菌的特征挥发性气味物质进行了检测分析。结果显示,线性判别分析(LDA)和偏最小二乘判别分析(PLS-DA)模型对谷物中黄曲霉类、寄生曲霉类和青霉类样品的整体判别正确率分别达到100%和97.4%。
目前,小麦有害霉菌侵染及霉变程度的快速检测仍是一大难点。前人利用电子鼻等技术进行霉变小麦定性判别已证明其可行性,但研究仍有待深入,未实现霉变程度的定性定量同步分析。因此,本研究拟以受不同有害霉菌侵染的小麦籽粒为对象,获取不同储藏阶段(0、1、3、5和7 d)小麦挥发性气味的电子鼻响应信号,结合多元统计分析方法建立小麦霉菌侵染程度的定性与定量同步分析方法,为利用电子鼻技术实现谷物品质快速分析提供技术参考。
1 材料与方法
1.1 试验材料
小麦样品(徐麦33,水分含量16.0%)。除杂并筛选籽粒饱满、无异味的样品,经Co-60辐照(剂量:12 kGy)灭菌后装入无菌塑料密封袋,4 ℃冷藏,备用。
1.2 试验方法
1.2.1 霉菌培养与接种
5种小麦等谷物中常见有害霉菌标准菌株:串珠镰刀菌(F.moniliforme)83227、层出镰刀菌(F. proliferatum)195647、雪腐镰刀菌(F.nivale)3.503、寄生曲霉(A.parasiticus)3.3950和赭曲霉(A.ochraceus)3.3486。
在马铃薯葡萄糖琼脂(potato dextrose agar, PDA)培养基上分别接种5种不同的霉菌菌株,放置于28 ℃和相对湿度85%的培养箱内进行活化培养。待霉菌生长到第15天后产生大量孢子,用无菌水冲洗培养基表面产生的菌丝,并将孢子悬浮液收集于50 mL锥形瓶中,依据国标GB/T 4789.2—2016平板计数法分别统计5种霉菌孢子悬浮液的浓度,并用去离子水调至约1×105CFU/mL,4 ℃冷藏,备用。
将小麦样品分为150份,每份150 g,随机分成5组,每组30份样品。分别接种1 mL孢子悬浮液和4 mL无菌水于小麦样品表面,每种悬浮液接种30份,随后分别放于150个上方有开孔的的灭菌塑料盒(规格:115 mm×115 mm×65 mm)中。随后转移至28 ℃、85% RH的人工气候箱中储藏7 d。
样品从接种霉菌起,选取时间节点0、1、3、5、7 d,随机选取受5 种不同霉菌感染的小麦样品各6 份,样品放入密封袋中于4 ℃冷藏备用。在检测前将冷藏的样品取出,在室温下放置约2 h直至样品温度趋于室温,随后称取5 g小麦样品置于20 mL 顶空瓶中,待顶空瓶中空气抽出即可进行电子鼻检测。
1.3 仪器设备
Fox 3000型电子鼻(法国Alpha MOS公司)由顶空全自动进样器、12 个金属氧化物传感器和AlphaSoft 软件操作系统组成。检测参数如下:样品采集时间60 s,采样频率1 次/s,载气流速150 mL/min,保温室温度60 ℃,采样速度1 mL/s,震荡速度500 r/min,保温时间120 s。样品进行4次重复测定,取平均值进行分析。测定时,采用金属氧化物传感器矩阵作为检测系统,该传感器由对气体敏感的半导体材料构成,当挥发性物质接触到传感器时,电阻值会发生相应的变化,记录下电阻值的变化,并依据气味标识和计量学软件对不同气味进行识别[18]。
1.4 数据分析
运用MATLAB v8.4软件对获取的小麦电子鼻响应信号进行处理和模型建立。为消除噪音及信号漂移等不良影响,采用标准化(Autoscale)、标准正态变换(standard normal variate,SNV)等方法对传感器响应信号进行预处理。随后,运用主成分分析(principal component analysis,PCA)、线性判别分析(liner discriminant analysis,LDA)对不同霉变程度的小麦样品进行区分和判别;运用偏最小二乘回归分析(partial least squares regression,PLSR)对小麦样品菌落总数水平进行定量预测,其评估指标包括模型决定系数(correlation coefficient of determination,R2)、建模和预测均方根误差(root mean squared error of calibration and prediction, RMSEC/RMSEP)、交互验证均方根误差(root mean squared error of cross validation, RMSECV)以及相对分析偏差(residual predictive deviation, RPD)等。
2 结果与分析
2.1 样品菌落总数分析
图1为储藏期间小麦样品菌落总数的变化趋势图。根据相关文献,依据菌落总数可将小麦样品分为未霉变[<2.7 log(CFU/g)]、开始霉变[2.7~4 log(CFU/g)]和严重霉变[>4 log(CFU/g)]3个阶段。由图1可知,除层出镰刀菌组外,其余四组染菌样品在0~1 d时菌落总数均低于2.5 log(CFU/g),处于未霉变状态,原因是在初期,样品刚感染霉菌,霉菌均覆盖于样品表面,未引起样品内部结构的变化,因此将0~1 d判为未霉变阶段。当储存至3 d时,所有样品的菌落数均在2.7~4 log(CFU/g)间,此时,霉菌已开始进入样品内部并引起内部结构的改变,将此阶段划分为开始霉变阶段。随着储藏时间达5~7 d,霉菌快速增长,霉变程度也不断加深,样品基本已达到严重霉变状态。其中,层出镰刀菌组可能由于活性较强,繁殖能力最大,因此菌落总数最多。从整体变化趋势来看,尽管不同霉菌的繁殖能力有差异,但菌落总数呈现显著的上升趋势,表明随着时间的延长,霉菌在样品中不断繁殖,同时产生大量代谢产物,导致小麦挥发性成分不断变化。
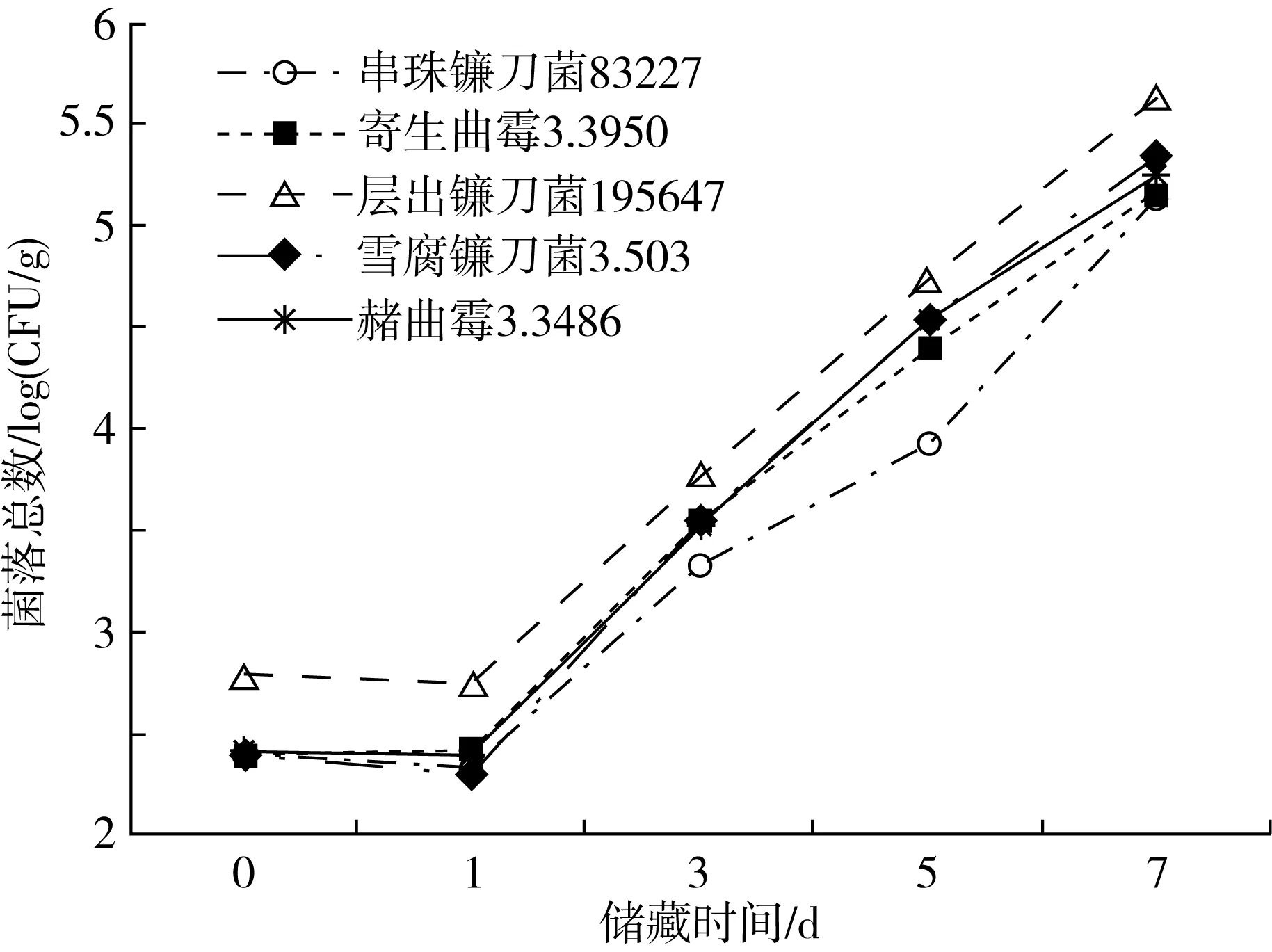
图1 不同储藏阶段小麦菌落总数变化趋势图
2.2 小麦样品电子鼻信号响应分析
图2为受不同霉菌侵染的小麦样品及受层出镰刀菌195647侵染的样品在不同储藏阶段的电子鼻信号雷达图。由图2a可知,除了传感器LY2/LG、LY2/gCT以及PA/2响应信号较低外,剩余传感器对于小麦产生的挥发性物质更为敏感。从雷达图的变化趋势和形状来看,受不同霉菌侵染的小麦样品的变化趋势大体相似,说明不同霉菌产生的挥发性物质有相似之处,但也存在一定差异。小麦霉变后会产生较多的胺类化合物、碳氢化合物以及芳香族化合物等,使得部分传感器响应值发生显著变化,而烷烃类、硫化氢和氮氧化合物等成分较少,导致其响应值变化不大[19]。结果表明,受不同霉菌侵染的小麦产生的挥发性物质之间存在差异,电子鼻的12 个传感器对不同的气味的敏感度不同,因此,可应用电子鼻对受不同霉菌侵染的小麦进行区分。
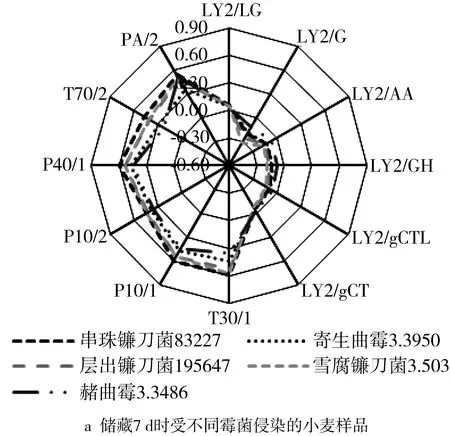
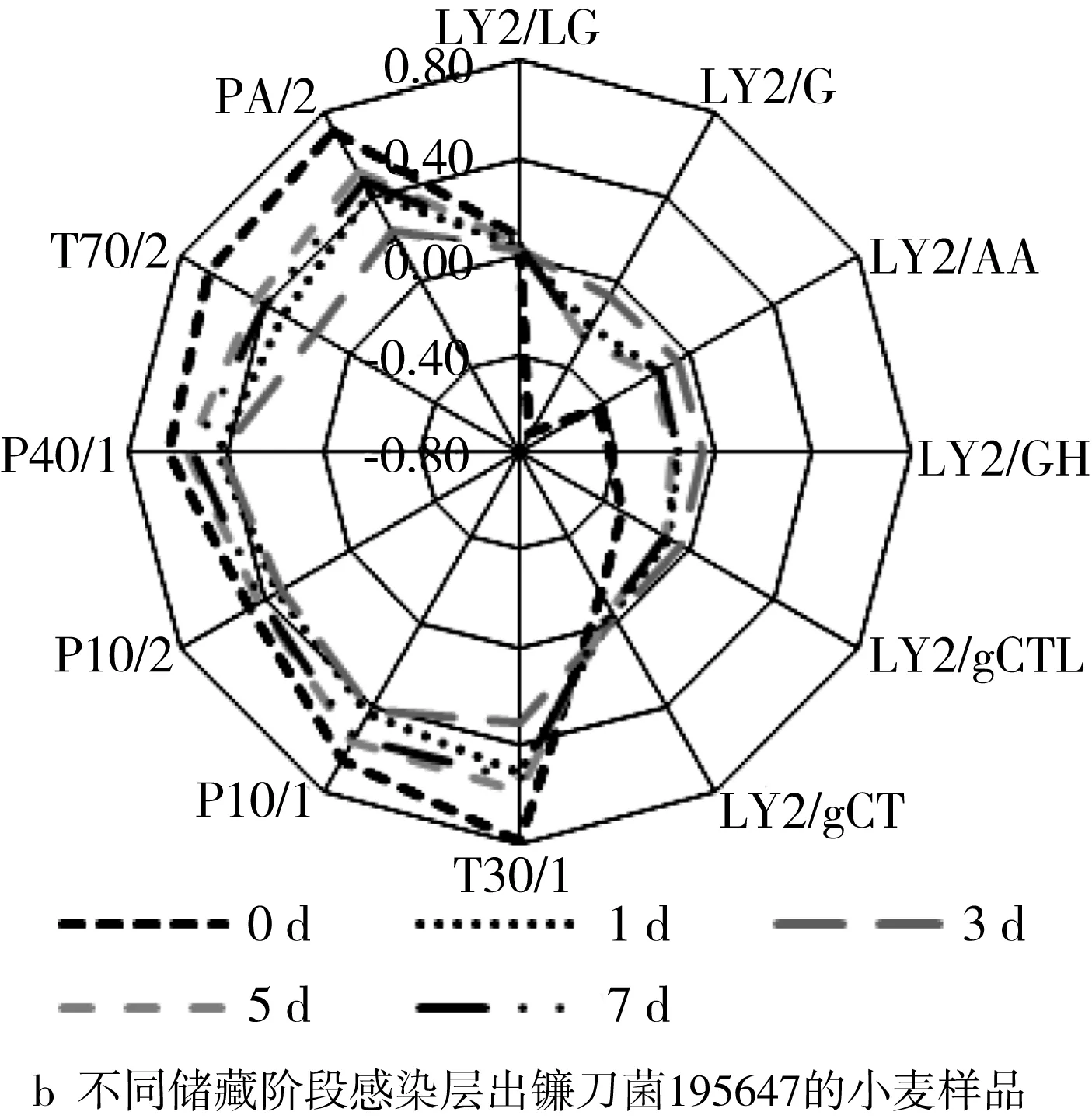
图2 小麦样品电子鼻响应信号雷达图
由图2b可知,随着储藏时间的增加,不同传感器也呈现出不一致的变化趋势。然而,由于挥发性物质的组成十分复杂,而电子鼻传感器的非特异性属性,因此,不同传感器随储藏时间的变化规律并不十分显著。随着小麦霉变程度的加深,PA/2、T30/1等代表碳水化合物、芳香族化合物、氮化合物类的物质响应信号存在减弱趋势,而代表醇、酮类物质的LY2/G、LY2/AA的响应信号逐渐增强。结果表明有害霉菌在生长代谢过程中会消耗小麦中的碳水化合物、蛋白质和酯类等有机物,生成醇酮等次级产物。这些物质在霉菌的代谢过程中产生,使得电子鼻响应值发生不断变化[20]。
2.3 PCA结果分析
依据菌落总数,将所有样品划分为未霉变、开始霉变和严重霉变三类。主成分分析结果如图3所示,其中第一主成分的贡献率为92.07%,第三主成分的贡献率为1.99%,全部贡献率达94.06%,代表了原始变量的大部分信息。由图可知,不同程度的霉变样品存在一定的聚类趋势。未霉变样品点分布与霉变样品分布存在较大差异,原因可能在于小麦在霉变过程中产生了特殊的挥发性物质,导致其电子鼻的响应信号出现系统差异。然而,由于不同霉菌侵染样品产生的气味影响可能互相混淆,开始霉变和严重霉变的小麦样品存在部分重叠,但仍有一定的分离趋势,表明随着霉变程度的加深,样品内部的营养物质被快速分解并产生大量挥发性物质,造成其电子鼻信号发生相应改变。结果表明,不同霉变程度的小麦样品的电子鼻信号存在差异,为进一步的判别分析奠定了基础。
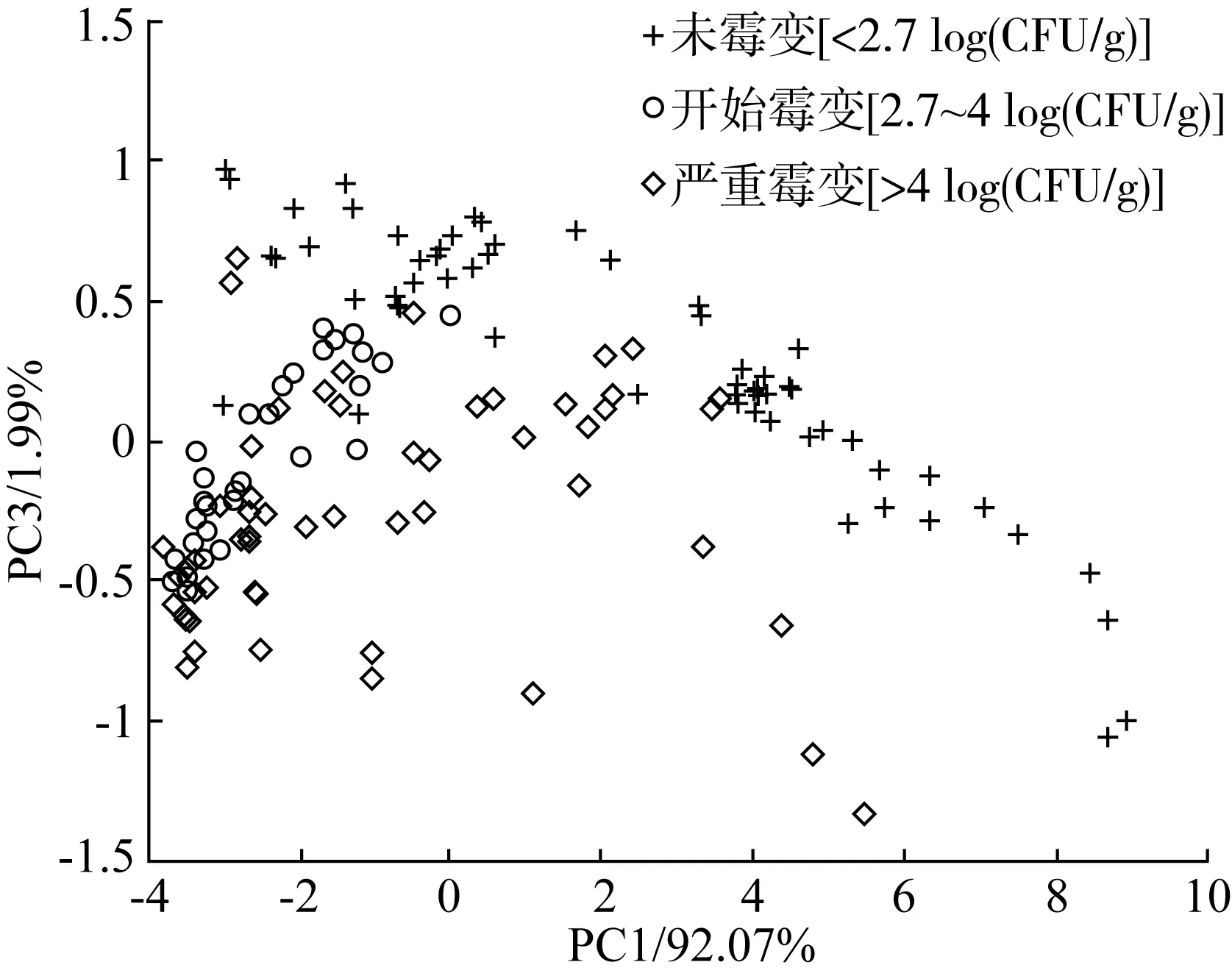
图3 受不同霉菌侵染的小麦样品电子鼻主成分分析图
2.4 LDA结果分析
利用用LDA法将所有样品依据其菌落总数分为未霉变、开始霉变和严重霉变三类。表1为LDA模型判别结果。由表1可知,LDA 模型可较好区分受单一优势霉菌侵染的样品,建模集准确率均为 100%,验证集中仅串珠镰刀菌83227和层出镰刀菌3.507组中分别有1个样品被误判,剩余组样品均能被成功区分。当将受不同霉菌侵染的样品综合在一起建立模型时,其判别正确率有所降低,验证集为84.0%。另外,从假阴性和假阳性指标可知,未被区分的样品基本都是被错判的样品,即霉变样品多数错判为未霉变样品。可能原因在于不同霉菌产生的挥发性成分十分复杂,可能存在相互干扰;另一方面,处于阈值附近的小麦样品也容易发生误判,导致正确率降低。为进一步提高模型精度,可在下一步研究中,延长储藏时间并调整霉菌浓度与霉菌侵染时间,补充自然霉变的样品,以不断提高模型的实用性和稳健性。
总体可知,虽然LDA模型的判别精度有待进一步提升,但不同霉变程度的小麦样品仍能得到较好的区分,表明储藏时间的增加,小麦的霉变程度也在增加,样品中的脂肪、蛋白质等营养物质被快速分解,产生大量的毒素和挥发性物质, 导致电子鼻响应信号与储藏前期产生了较大的差异,为电子鼻气体传感器提供了判别基础。
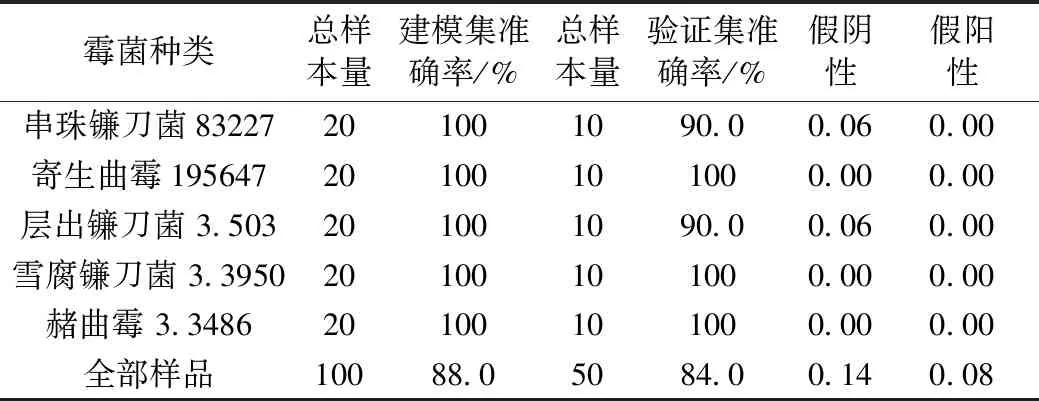
表1 受霉菌侵染的样品不同霉变程度下的LDA模型判别结果
2.5 PLSR结果分析
小麦样品中的菌落总数的PLSR建模结果如表2所示。由表可知,对于感染单一霉菌的样品,建模集的决定系数Rc2均在 0.85以上,建模均方根误差(RMSEC)低于 0.40 log CFU/g。其中雪腐镰刀菌 3.3950 组的模型结果最优,Rc2值达到 0.984, RMSEP和RPD 值分别为 0.223 log CFU/g和5.51。验证集中,对单一霉菌进行预测时,Rp2值都超过0.80,RMSEP值在0.500 log CFU/g左右。除层出镰刀菌3.503组外,其余4 组模型的RPD值均在2.50以上,说明模型相关性较好,稳健性较高。而层出镰刀菌3.503组的RPD值也达到2.21,说明该模型具有定量分析潜力。将全部样品进行综合建模时,精度略有降低,Rp2值和RMSEP值分别为 0.852和0.504 log CFU/g,RMSEP值偏大,导致RPD值降低,介于2~2.5之间,低于单一霉菌侵染组模型。但结果显示所有模型的 RPD 值均高于2.0,有用于定量分析的可能。图4为小麦菌落总数与电子鼻响应值相关关系图,样品均分布于中心线两侧,表明两者具有较高相关性。结果表明,通过电子鼻技术在预测小麦中的菌落总数含量,判断小麦是否发生霉变方面具有可行性。但由于样品数量、电子鼻传感器性能及数量等的影响,模型的整体预测精度仍有待提升。
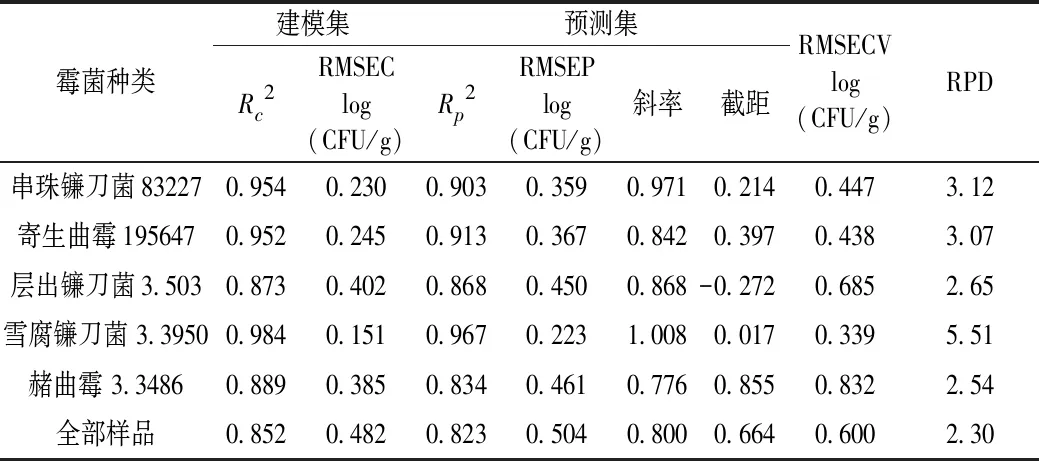
表2 受不同霉菌侵染的小麦菌落总数预测模型分析结果
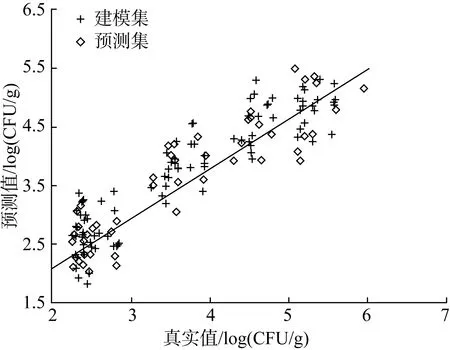
图4 小麦样品中菌落总数与电子鼻响应值相关关系
3 结论
本研究通过电子鼻对受不同霉菌侵染的小麦样品在不同储藏阶段的挥发性气体成分的检测以及多元统计分析技术,建立了电子鼻响应信号与霉菌侵染程度的定性定量分析模型。PCA结果显示,样品在不同霉变程度下的气味信息变化存在一定的规律,不同霉变状态的样品可得到较好区分;运用LDA方法对受单一霉菌侵染的小麦样品的判别率均在90%以上,对全部样品的判别率超过80%;运用PLSR建立样品菌落总数的回归模型,全部样品的Rp2值和RMSEP值分别为 0.852和0.504log (CFU/g),RPD值为2.30,表明建立的模型可用于定量分析且模型精度较高。综上可知,作为一种快速、便捷的气味检测手段,电子鼻传感技术在小麦样品霉变状态的区分及霉变程度的快速识别方法具有一定可行性,为粮食霉变早期检测及质量评估提供了技术参考。

