射血分数保留心力衰竭患者预后的影响因素分析
王佳玉 魏欣 徐晓薇

[摘 要] 目的 探讨射血分数保留的心力衰竭(heart failure with preserved ejection fraction,HFPEF)患者心血管死亡以及心源性再住院的影响因素。方法 本研究为前瞻性队列研究,以2015年9月至2017年8月于本院因心力衰竭住院、左心室射血分数(left ventricular ejection fraction,LVEF)≥50%的心力衰竭患者建立动态队列,收集患者首次住院时的一般临床资料、实验室检查和超声心动图指标作为基线资料,每6个月对患者进行1次电话随访。主要终点事件为心血管死亡和心源性再住院。结果 平均随访(15.09±4.81)个月,在发生终点事件的患者中,女性多(58.44% vs.45.45%,P<0.05)。结论 贫血和hs-cTnI升高使HFPEF患者心血管死亡及因心源性再住院风险分别增加4.86倍和8.91倍。
[关键词] 心力衰竭;射血分数;超敏肌钙蛋白I;心血管死亡率
中图分类号:R541.6
文献标识码:A
文章编号:1009-816X(2019)03-0242-03
doi:10.3969/j.issn.1009-816x.2019.03.014
在2013年美国心脏病学院基金会(ACCF)和美国心脏协会(AHA)联合发布的心力衰竭治疗指南中[1],将左心室射血分数(LVEF)≥50%的心力衰竭定义为射血分数保留的心力衰竭(HFPEF)即舒张期心力衰竭。关于影响心力衰竭患者预后的危险因素既往研究多着眼于收缩期心力衰竭,对HFPEF关注较少。因此,本研究就HFPEF患者心血管死亡以及心源性再住院的影响因素进行分析。
1 资料和方法
1.1 一般资料:本研究为前瞻性研究,选取2015年9月至2017年8月于本院心血管内科因心力衰竭住院患者264例,入选标准为年龄≥18周岁、符合HFPEF的诊断标准。HFPEF的诊断标准[1]主要包括:(1)伴有典型的临床症状(呼吸困难、踝部肿胀和疲乏);(2)心力衰竭的体征(颈静脉充盈或怒张、肺部湿音和心尖搏动移位);(3)LVEF≥50%;(4)超声心动图舒张早期二尖瓣血流速度(E)与舒张晚期二尖瓣血流速度(A)(E/A)的比值<1和脑钠肽(BNP)>100pg/mL。排除标准:(1)首次住院期间患者死亡;(2)基线资料不完整;(3)患者及家属拒绝进行随访;(4)患者存在认知功能障碍;(5)同时患有影响预后的严重疾病,如恶性肿瘤等。
1.2 资料采集:收集患者首次住院时的一般临床资料:性别、年龄、病程、住院天数以及既往高血压病、糖尿病病史、实验室检查:红细胞计数(RBC)、血红蛋白(Hb)、红细胞压积(HCT)、红细胞平均体积(MCV)、平均血红蛋白含量(MCH)、平均血红蛋白浓度(MCHC)、血肌酐(Scr)、估计肾小球滤过率(estimated glomerular filtration rate,eGFR)、超敏肌钙蛋白I(hs-cTnI)以及BNP水平和超声心动图指标:测量左心室舒张末期内径(left ventricular end diastolic diameter,LVEDD)、左心室收缩末期内径(left ventricular end systolic diameter,LVESD)、E/A比值以及LVEF作为基线资料。每6个月对患者进行1次电话随访,根据患者是否发生主要终点事件即心血管死亡和心源性再入院进行分组,探讨影响HFPEF患者发生主要终点事件的影响因素。
主要终点事件为(1)心血管死亡:因心力衰竭加重、心肌梗死、致命性心律失常等因素導致死亡;(2)心源性再住院:包括心力衰竭加重、不稳定性心绞痛、心肌梗死、心源性栓塞以及室性心律失常导致患者再入院。
1.3 统计学处理:数据录入采用EpiData软件,进行两次录入并进行数据核查。采用SPSS18.0版软件包进行统计学分析。符合正态分布的计量资料以(x -±s)表示,两组间比较采用t检验,不符合正态分布的计量资料采用中位数(下四分位数,上四分位数)[M(P25,P75)]表示,两组间比较采用秩和检验。计数资料采用百分构成比或率表示,两组间比较采用χ2检验。采用多因素Logistic回归分析影响因素。P<0.05为差异有统计学意义。
2 结果
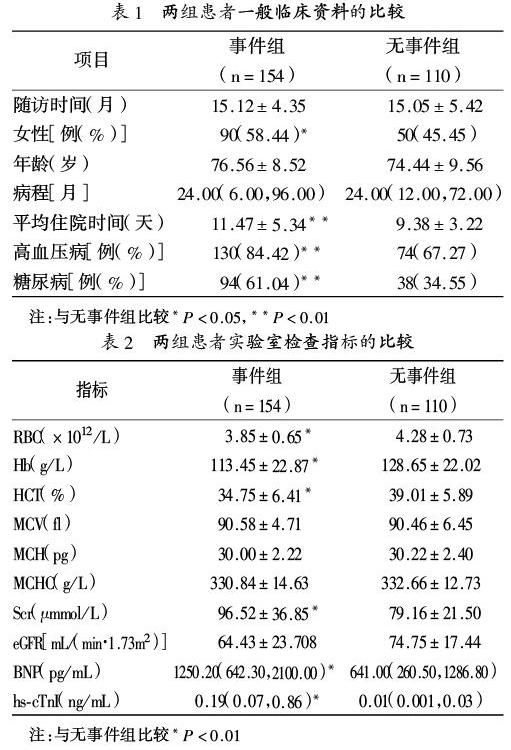
2.1 一般临床资料:本研究共纳入HFPEF患者264例,女性140例(占53.03%),平均随访(15.09±4.81)个月,154例患者发生终点事件,其中心血管死亡16例(6.06%),心源性再住院138例(52.27%);无事件患者110例。事件组女性患者多,住院时间长,多伴有高血压病和糖尿病,两组比较差异具有统计学意义(P0.05),见表1。
2.2 实验室检查指标比较:事件组患者Hb低,Scr高,eGFR低,BNP和hs-cTnI水平高,两组比较差异具有统计学意义(P<0.01),见表2。
2.3 超声心动图指标比较:两组患者超声心动图指标差异无统计学意义(P>0.05),见表3。
2.4 HFPEF患者主要终点事件的Logistic回归分析:以患者主要终点事件作为因变量,将女性、高血压病、糖尿病、贫血(男性Hb<120g/L以及女性Hb<110g/L)、hs-cTnI升高(男性>0.034ng/mL,女性>0.016ng/mL)、BNP水平(每100pg/mL递增作为分类变量)以及eGFR水平[≥90mL/min·1.73m2,60~90mL/min·1.73m2,30~60mL/min·1.73m2,15~30mL/min·1.73m2和<15mL/min·1.73m2为分类变量]作为自变量进行Logistic回归分析,女性、贫血、hs-cTnI升高以及eGFR水平是HFPEF患者心血管死亡以及心源性再住院的危险因素(OR=2.56~8.91,P<0.05),见表4。
3 讨论
心力衰竭治疗的目的包括改善患者临床症状、提高患者生活质量、改善心肌重构,延缓疾病进展以及心功能恶化,以降低住院率以及病死率[2,3]。本研究中,贫血及hs-cTnI升高使HFPEF患者心血管死亡以及心源性再住院风险分别增加4.86倍和8.91倍。
既往国外研究表明,心力衰竭患者30天内死亡率和再住院率分别为10.8%和24.5%[4]。在本研究中,死亡患者16例,再住院患者138例,心血管死亡率和心源性再住院率分别为6.06%和52.27%,这与上述研究结果存在一定差异,这可能与本研究入选人群为HFPEF患者以及就诊患者人群分布有关。
HFPEF约占心力衰竭患者的一半,同LVEF下降的患者相比,年龄较大,多见于女性。在纳入19710例患者的研究中,HFPEF占35%,其中女性占79%[5]。在本研究中,纳入女性患者140例,占全部患者53.03%,这也符合HFPEF的流行病学特点。
贫血是慢性心力衰竭患者的常见并发症,在心力衰竭患者中发生率约10%~49%。贫血对患者心功能产生不利影响,是影响心力衰竭患者预后的危险因素,贫血患者死亡率要显著高于非贫血患者[6],但在临床工作中贫血对心力衰竭患者的预后尚未引起临床医生的足够重视。尽管在2016年欧洲心力衰竭指南中[7],对于合并铁缺乏的射血分数减低的患者进行铁剂补充,以改善患者症状、提高运动耐量和生活质量(IIa,A),但是大量研究表明,贫血与心功能恶化以及不良预后相关,纠正贫血后对心功能改善治疗效果有限。
各种病因导致的慢性心力衰竭均可导致肌钙蛋白升高,特别多见于老年、男性、合并慢性肾脏病等因素的患者,这与本研究结果相一致。在慢性心力衰竭中,当发生急性失代偿性心力衰竭时,肌钙蛋白检测阳性率高于慢性期[8]。而无论肌钙蛋白何种亚型升高,心力衰竭患者1年死亡率明显增高。hs-cTnI升高水平能提示心力衰竭时心肌损伤的严重程度,对于心力衰竭患者的预后评估优于BNP[9]。研究发现,急性失代偿性心力衰竭患者hs-cTnI平均为0.35ng/mL,在单因素分析中hs-cTnI与死亡相关,动态监测hs-cTnI基线水平、峰值以及变化差值发现,hs-cTnI与心因性死亡和其他心血管不良事件密切相关[10]。在本研究中发现,hs-cTnI升高使HFPEF患者心血管死亡以及心源性再住院风险增加8.9倍,这与心力衰竭患者存在慢性心肌损伤相关,相关患者并无明确新发心肌缺血证据,但hs-cTnI升高在何种临床界值条件下会影响心力衰竭患者预后尚需进一步研究确认。
有研究表明,BNP水平升高与心力衰竭患者的预后呈正相关[11],但是在本研究中,BNP升高并非心血管性死亡和再住院的独立危险因素,可能的原因为:(1)采用界值点不同:BNP显著升高多发生于急性心力衰竭患者,慢性心力衰竭患者BNP水平可能相对较低。在2016年ESC心力衰竭指南中推荐急性心力衰竭是BNP界值点为100pg/mL,在慢性心力衰竭患者中BNP界值点为35pg/mL,这与本研究中采用的界值点并不相同;(2)检测时间不同:部分患者并未在出现心力衰竭症状时第一时间就诊,所测量BNP峰值可能并未反映患者真实情况。BNP半衰期为22分钟,相对较短,而NT-proBNP同BNP相比,半衰期更长、更稳定,其水平更能反映患者心功能状态;(3)年龄、性别、肾脏功能、肥胖、药物、感染等因素影响BNP的检测水平;(4)约30%HFPEF的患者BNP水平可能<100pg/mL。BNP水平是心力衰竭患者不良预后的独立危险因素,但评估预后界值尚未完全确定。对于慢性心力衰竭患者动态监测BNP水平意义更大,检测值长期稳定表明心功能恶化风险低,检测值升高或下降预示着心功能恶化或改善[12,13]。
本文提示女性、贫血、hs-cTnI升高以及eGFR水平是HFPEF患者心血管死亡以及心源性再住院的危險因素。
参考文献
[1]Yancy CW, Jessup M, Bozkurt B, et al. 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines[J]. J Am Coll Cardiol,2013,62(16): e147-239.
[2]Brouwers FP, De Boer RA, Van Der Harst P, et al. Incidence and epidemiology of new onset heart failure with preserved vs. reduced ejection fraction in a community-based cohort: 11-year follow-up of PREVEND [J]. Eur Heart J,2013,34(19):1424-1431.
[3]Bui AL, Horwich TB, Fonarow GC. Epidemiology and risk profile of heart failure[J]. Nat Rev Cardiol,2011,8(1):30-41.
[4]Gheorghiade M, Braunwald E. Hospitalizations for heart failure in the United States--a sign of hope [J]. JAMA,2011,306(15):1705-1706.
[5]Masoudi FA, Havranek EP, Smith G, et al. Gender, age, and heart failure with preserved left ventricular systolic function[J]. J Am Coll Cardiol,2003,41(2):217-223.
[6]Kajimoto K, Minami Y, Sato N, et al. Gender Differences in Anemia and Survival in Patients Hospitalized for Acute Decompensated Heart Failure With Preserved or Reduced Ejection Fraction[J]. Am J Cardiol,2017,120(3):435-442.
[7]Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the Diagnosis and Treatment of Acute and Chronic Heart Failure[J]. Rev Esp Cardiol (Engl Ed),2016,69(12):1167.
[8]Guisado Espartero ME, Salamanca-Bautista P, Aramburu-Bodas O, et al. Troponin T in acute heart failure: clinical implications and prognosis in the Spanish National Registry on Heart Failure[J]. Eur J Intern Med,2014,25(8):739-744.
[9]Pascual-Figal DA, Manzano-Fernandez S, Boronat M, et al. Soluble ST2, high-sensitivity troponin T-and N-terminal pro-B-type natriuretic peptide: complementary role for risk stratification in acutely decompensated heart failure[J]. Eur J Heart Fail,2011,13(7):718-725.
[10]Latini R, Masson S. Significance of measurable cardiac troponin by high-sensitivity assays in patients with chronic stable heart failure[J]. Coron Artery Dis,2013,24(8):716-719.
[11]Clavel MA, Malouf J, Michelena HI, et al. B-type natriuretic peptide clinical activation in aortic stenosis: impact on long-term survival[J]. J Am Coll Cardiol,2014,63(19):2016-2025.
[12]Farnsworth CW, Bailey AL, Jaffe AS, et al. Diagnostic concordance between NT-proBNP and BNP for suspected heart failure[J]. Clin Biochem,2018,59:50-55.
[13]Mcdonald K, Troughton R, Dahlstrom U, et al. Daily home BNP monitoring in heart failure for prediction of impending clinical deterioration: results from the HOME HF study[J]. Eur J Heart Fail,2018,20(3):474-480.
(收稿日期:2018-12-12)

