果糖诱导肝脂肪变性细胞模型建立及评价
贺雯茜 杨金玉 徐艳娇 兰露露 张程亮 刘东
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是全球广泛流行的慢性疾病,严重危害人类的生命健康,其发病过程包括单纯性脂肪肝、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)、肝纤维化和肝硬化[1]。目前,常用油酸、软脂酸或其不同比例的混合物诱导体外肝细胞脂肪变性模型[2, 3]。亦有研究使用高浓度胎牛血清、医用脂肪乳或胰岛素培养细胞,以诱导肝细胞内三酰甘油(TG)沉积[4]。但以上干预方式皆为模拟油脂类饮食过量摄入而引发的NAFLD。而现实生活中,随着高脂饮食危害意识的普及和高果糖玉米糖浆作为甜味剂在食品工业中的广泛使用,人们的饮食模式逐渐由多油多脂转变为少油多糖,特别是多果糖。已有研究表明,软饮料消费量的逐年增长与城市人口NAFLD发病率增加密切相关[5]。研究发现,果糖水饲养C57BL/6小鼠8周即出现明显的肝脏脂质沉积,说明生活中NAFLD的发生不仅是由油脂导致,果糖也是主要诱因之一[6]。而高脂诱导肝细胞脂肪变性的细胞模型已不能契合新饮食模式导致的NAFLD研究需要。因此,本研究采用果糖诱导L02人正常肝细胞系建立新型脂肪变性细胞模型,评价该模型与传统游离脂肪酸(FFA)诱导的NAFLD细胞模型对脂质合成的影响,以期为NAFLD体外研究提供新的策略与途径。
资料与方法
一、细胞系
人正常肝细胞系 L02为华中科技大学同济医学院附属同济医院肝病研究所馈赠。
二、主要试剂
果糖(F3510)、油酸(OA,01383)和软脂酸(PA,P5585)购自美国Sigma公司;Cell Counting Kit-8试剂盒(HY-K0301-500T, MedChem Express);油红O干粉(13071275422,科瑞生物);DMEM高糖培养基(C11995500BT,Gibco);胎牛血清(S601P-500,Sera Pro);胰酶(25200-056,Gibco);兔抗人多克隆抗体:碳水化合物反应元件结合蛋白(ChREBP,85570S,CST)、固醇调节元件结合蛋白-1c(SREBP-1c,abs111730,absin)、乙酰辅酶A羧化酶1(ACC1,4190S,CST)和硬脂酰辅酶A去饱和酶1(SCD1,2794S,CST);BCA 蛋白浓度测定试剂盒(P0012S,碧云天);ALT测试盒(C009-2)、AST测试盒(C0010-2)和TG测试盒(A110-1)均购自中国南京建成生物工程研究所。
三、溶液配制
果糖溶液配制:取11.53 g果糖溶解于10 mL DMEM高糖培养液,配成6.4 mol/L母液。根据实验需要稀释使用。FFA溶液配制: 取38.08 μL OA和0.0308 g PA分别溶于12 mL 10%无脂牛血清白蛋白溶液中,配成10 mmol/L OA母液和10 mmol/L PA母液。按照OA∶PA = 2∶1的比例配成1 mmol/L FFA溶液现配现用。
四、细胞活性检测
将L02肝细胞接种于96 孔板中(每孔1.3×104个细胞),待细胞贴壁后,将培养液换成总体积为200 μL的含果糖完全培养基,其中果糖浓度依次为0、0.5、1、2、4、8、16、32 mmol/L。培养24 h后向每孔加入20 μL的CCK-8溶液,培养箱内37 ℃孵育2 h,用酶标仪检测450 nm处吸光度值。
五、转氨酶的检测
将L02肝细胞接种于24孔板内(每孔7×104个细胞),细胞贴壁后换含不同浓度果糖的培养液干预24 h。收集培养液,400×g离心5 min,取上清,按照检测试剂盒说明书检测ALT和AST。
六、细胞内TG含量测定
将L02肝细胞接种于6孔板内(每孔3.8×105个细胞),细胞贴壁后分别换含不同浓度果糖(0、1、2、4、8、6、32 mmol/L)和FFA(1 mmol/L)的完全培养液干预24 h。PBS 清洗3次后收集细胞,加入2% TritonX-100冰上裂解细胞40 min,12 000×g离心20 min,取上清,按TG试剂盒说明检测孔样本TG含量,按BCA 蛋白定量试剂盒说明检测各孔样本蛋白含量,计算每克蛋白所对应的TG含量(mmol/gprot)。
七、细胞油红O染色
24孔板中放入细胞爬片,用明胶37 ℃包被30 min,种入L02肝细胞。细胞贴壁后加入含不同浓度果糖和FFA的完全培养基,培养24 h,弃培养液,PBS漂洗3次,4%多聚甲醛固定30 min,后用60%异丙醇润洗,3 g/L油红O溶液染色15 min,60%异丙醇洗去浮色。苏木精染色1 min以内,双蒸水冲洗4~5次至染核清晰背景干净。于显微镜下观察并采集图像。
八、蛋白质印迹
果糖和FFA处理L02肝细胞24 h后弃去上清,PBS缓冲液漂洗细胞3次。加入RIPA裂解液,冰上裂解30 min。收集裂解液于12 000×g,4℃离心10 min,取上清加入5×蛋白上样缓冲液,95℃下变性10 min。分别取 10 μL 样本于100 V电压下行SDS-PAGE电泳约2 h,于200 mA电流下行电转2.5 h。5%牛奶室温封闭1 h,一抗4℃摇床孵育过夜,二抗室温孵育1 h。条带使用ECL液显影,于暗室中曝光,Image J软件分析吸光度值。
九、统计学分析
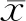
结 果
一、果糖对L02肝细胞活性无显著影响
随着培养液中果糖浓度的升高,L02肝细胞活性无显著差异(表1)。说明该范围浓度内的果糖(32 mmol/L及以内)对L02肝细胞活性无显著影响。
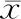
表1 果糖对L02肝细胞增殖活性的影响(±s, n= 6)
二、细胞培养上清液中ALT及AST含量变化
与未加果糖的对照组相比,果糖浓度在 0.5、1、2、4、8、16、32 mmol/L时,细胞培养液中ALT和AST含量均无显著性差异(表2)。说明该范围浓度内的果糖(32 mmol/L及以内)未导致显著的L02肝细胞损伤。
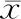
表2 不同浓度果糖培养基上清中ALT、 AST含量变化(±s, n= 6)
三、果糖诱导L02肝细胞脂肪变性/果糖促进L02肝细胞脂肪沉积
不同果糖浓度(0、1、2、4、8、16、32 mmol/L)和FFA处理24 h后,L02肝细胞内TG含量分别为无具体数据。油红O染色观察结果和细胞内TG含量测定结果一致(图1)。随着果糖浓度升高,细胞内红色脂滴增多,且主要分布在细胞质靠近细胞膜部位。尤其4 mmol/L果糖组,红色变深,范围变大。然而FFA组脂滴大量聚集,且连成片状。说明4 mmol/L果糖即可导致脂肪在细胞内大量累积,但其脂质累积效应弱于FFA。
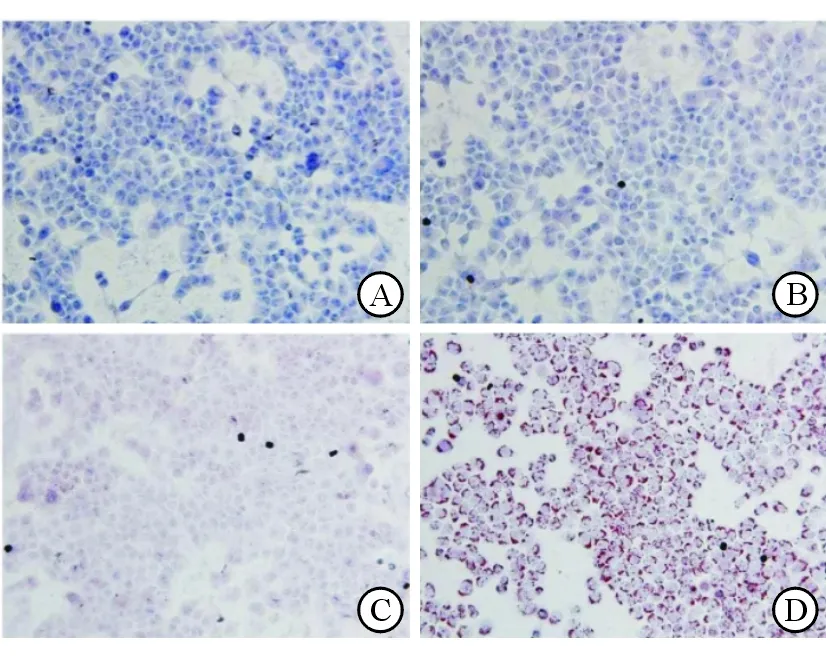
图1果糖和游离脂肪酸对L02肝细胞内TG含量的影响(油红O染色,×200) A.果糖浓度为0 B.果糖浓度为1 mmol/L C.果糖浓度为4 mmol/L D.FFA组
四、果糖诱导L02肝细胞脂质合成相关蛋白表达量增加
使用浓度梯度的果糖干预L02肝细胞后,结果4 mmol/L果糖时,在L02细胞中ChREBP、SREBP-1c和ACC1的表达量显著升高(P<0.05)。而果糖浓度达到8 mmol/L时,SCD1蛋白才显著升高(P<0.05),但当果糖浓度升高至32 mmol/L时,SCD1蛋白表达又回到正常水平。说明果糖可能通过上调细胞中脂质合成蛋白表达从而导致肝细胞内脂质沉积,但当果糖浓度超过一定范围时,其促脂质合成效果可能会有所减弱(图2)。
五、果糖和FFA对L02肝细胞脂质合成蛋白表达影响
为比较果糖和FFA导致L02细胞脂质沉积不同,选用4 mmol/L果糖处理L02肝细胞,结果L02肝细胞中SCD1蛋白表达量比无果糖处理组(对照组)显著升高(P<0.05),ACC1蛋白表达量相对于对照组有增加趋势(图3)。
SCD1在FFA组蛋白表达量相对于对照组无显著性差异。而经FFA处理后,L02肝细胞中ACC1蛋白表达量相对于对照组有下降的趋势。除此之外,果糖相对于FFA更显著提高了L02细胞内ACC1的表达(P<0.05)。这些结果说明果糖相对于FFA,对肝细胞内脂质合成源头的影响更显著。
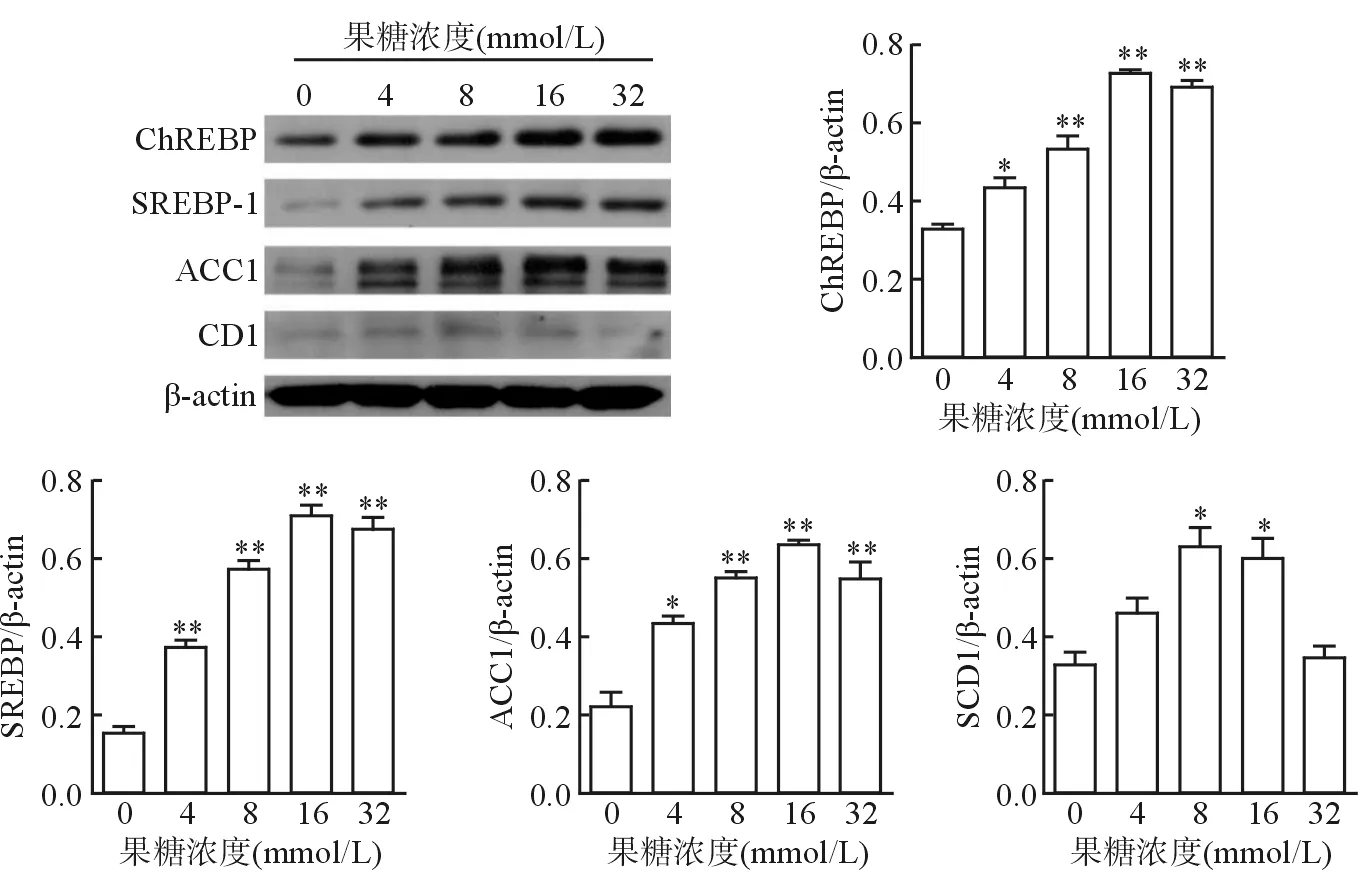
注:与对照组比较,*P<0.05,**P<0.01
图2果糖对L02肝细胞中ChREBP、SREBP-1c、ACC1和SCD1蛋白表达的影响
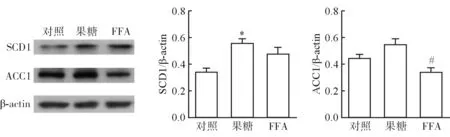
注:与对照组比较,*P<0.05;与果糖组比较,#P<0.05
图3果糖和游离脂肪酸对L02肝细胞中ACC1和SCD1蛋白表达的影响
讨 论
NAFLD是与胰岛素抵抗(insulin resistance,IR)和遗传易感性密切相关的代谢应激性肝损伤,以肝细胞脂质沉积为主要特征。常用的饮食干预诱导NAFLD的动物模型造模周期较长,转基因动物模型成本昂贵。体外细胞模型能为动物模型提供补充,为探讨发病机制和药物治疗提供有效补充手段。
目前,NAFLD细胞模型广泛使用原代肝细胞和永生化肝细胞系,通过培养液中添加高浓度营养物质诱导肝细胞脂质沉积,这些物质包括饱和脂肪酸、不饱和脂肪酸、葡萄糖、血清和医用脂肪乳等。其中人体肝脏样本数量有限,原代细胞培养极其复杂,同时碍于伦理问题常限制其使用[7]。啮齿动物的原代肝细胞能部分模仿人类的疾病状况,但培养较长时间时,细胞会丢失其组织特异性功能。永生化肝细胞系是原代细胞培养的优良替代物,其表型稳定,培养便捷,更容易标准化[2]。为了更好模拟人体NAFLD疾病状态,获得可重复性稳定实验结果,本研究选择人正常肝细胞系L02作为NAFLD体外模型的生物材料。
同样,诱导肝细胞脂质性变的方法也有很多。将肝细胞暴露于高脂培养基是最直接且常用的方法。根据NAFLD的疾病特点添加的多为FFA,依据不同类型肝细胞FFA浓度也有所不同[8, 9]。部分研究在建造NAFLD细胞模型时未使用含有脂肪酸的高脂培养基,如在培养基中添加高浓度胎牛血清,但此方法费用高[10]。Iwasaki等[11]尝试使用高葡萄糖诱导HuH7细胞发现,高葡萄糖对NF-κB介导的转录具有促进作用,促进细胞凋亡。随着人们生活习惯变化,果糖成为NAFLD的新诱因。果糖可诱导肥胖、高脂血症、IR和高血压等代谢综合征的表现已在动物及人群研究中得到广泛证实[12]。而目前果糖诱导的NAFLD细胞模型有待进一步开发。
本研究采用梯度浓度的果糖进行实验,结果发现,以4 mmol/L 果糖诱导L02肝细胞24 h后,即可显著增加细胞内TG含量。同时,该浓度果糖对细胞活性无显著性影响,细胞未出现显著性损伤。ChREBP、SREBP-1c、ACC1和SCD1是脂质合成中的关键蛋白,在NAFLD形成中其发挥关键性作用。研究发现,高糖饲喂肝脏特异性ChREBP敲除小鼠肝脏脂质沉积相对于野生型小鼠显著减少,而肝脏特异性ChREBP敲除不能减少高脂饲诱导的肝脏脂质累积[13]。SREBP-1c和ChREBP 在激活脂肪生成中发挥协同作用[14]。此外,ChREBP通过调节SREBP2蛋白稳定性,调节肝脏胆固醇生物合成的新作用,这种机制似乎对肝细胞保护免受果糖诱导的细胞凋亡至关重要[15]。FAS、ACC1和SCD1是转录因子SREBP-1c和ChREBP的下游靶基因,这三个脂质合成关键酶的上调会显著促进肝脏脂质从头合成[16-17]。果糖在4~32 mmol/L时即可显著上调ChREBP、SREBP-1c和ACC1蛋白表达。果糖浓度达到8~16 mmol/L时SCD1蛋白表达也显著上调。这些结果说明4 mmol/L 果糖作用于L02细胞24 h后,即可上调肝细胞脂肪合成基因,从而诱导肝细胞脂肪变性。
果糖诱导模型和经典的FFA诱导模型结果显示,与FFA处理组相比,尽管果糖诱导的肝细胞脂质沉积不如其显著,但果糖可以显著增加L02细胞内ACC1和SCD1蛋白的表达,其中对SCD1蛋白的增加更为显著。说明果糖可能主要影响脂质合成源头从而导致肝细胞内脂质沉积。果糖通过诱导脂质从头合成而促使TG累积效率较PA和OA作为原料直接促进胞内TG沉积更低,这也可能是果糖诱导的肝细胞脂质沉积弱于FFA的原因。
综上所述,4 mmol/L 果糖作用于L02细胞24 h后,即可上调肝细胞脂肪合成基因,从而诱导肝细胞脂肪变,构建NAFLD细胞模型。此方法不仅造模周期短、费用低,且方法稳定性、重现性好,能较好地模拟高果糖饮食诱发的NAFLD,为高果糖饮食诱导肝脏脂肪变性进展的分子机制研究提供一种有效可行的新工具。

