应用直接抗病毒药物治疗丙型肝炎的现状与展望
杜凌遥 唐红
丙型肝炎病毒(HCV)全球感染人数超过7 000万。HCV感染慢性化明显增加了肝硬化、肝衰竭、肝癌等终末期肝病的发生。HCV有8个基因型和数十种亚型,基因1型病毒株流行最广,其次为3型、2型、4型及其他。各基因(亚)型病毒株在地域分布和感染后诱发的自然病程上存在差异,如3型多在印度、巴基斯坦分布且更容易导致肝癌的发生[1]。
HCV感染后如无治疗禁忌应立即进行抗病毒治疗,抗病毒治疗的目的在于清除病毒从而避免严重并发症。近几年出现的直接抗病毒药物(DAAs)因疗效好、安全性佳,成为治疗HCV感染的一线药物。DAAs药物的发展从针对基因1型HCV的第一代药物Telaprevir和Boceprevir开始,到2014年NS5B聚合酶抑制剂Sofosbuvir(SOF)出现,才真正实现里程碑式的跨越。 SOF是第一个真正可以替代干扰素清除HCV的口服药物,可以与利巴韦林联合治疗基因2、3型病毒株的感染或者和其他DAAs组合治疗非2、3型病毒株感染。随着获批的DAAs日益增多,治疗方案的选择也逐渐增加。应该了解所有方案的优势与局限,合理选择应用,才能得到最大治疗获益[2]。
一、现有DAAs治疗方案的特点
现阶段我国已获批的DAAs药物(含复方制剂)一共有10种(表1)。通过不同靶点药物之间组合或与利巴韦林组合,可以形成十多种全口服的治疗方案。基因型仍然是影响方案选择的关键,部分方案可以覆盖所有基因型,而某些方案仅针对某种特异基因型。因此在启动DAAs治疗前进行HCV基因型检测仍十分必要。除此以外,合并疾病、共用药物、是否初治、肝脏硬度及CTP评分等均对方案选择存在影响。
(一)全基因型治疗方案
我国现有上市的药物中全基因型方案包括:SOF联合利巴韦林,SOF联合DAC,SOF/VEL三种。
在中国大陆地区的Ⅲ期临床研究中,SOF联合利巴韦林12周到24周方案在基因型1、2、3和6型HCV感染者中均显示出较高的治疗后12周持续病毒学应答率(SVR12:92%~100%)。尤其针对基因2型HCV感染,第一代NS5A抑制剂疗效欠佳,在较长一段时间里SOF联合利巴韦林是这类患者仅能选择的治疗方案;而24周的SOF联合利巴韦林更是3型HCV感染的第一个全口服方案。但由于利巴韦林存在溶血等不良反应,且SOF作为单一DAA应用于治疗时易受耐药相关替换(RAS)影响,该方案在真实世界中并未显示出与其临床注册研究相当的有效性,不良事件发生率反而增加。因此,目前该方案并不被欧美或我国指南作为常规的全基因型治疗方案推荐,仅在治疗选择有限时使用[3-4]。
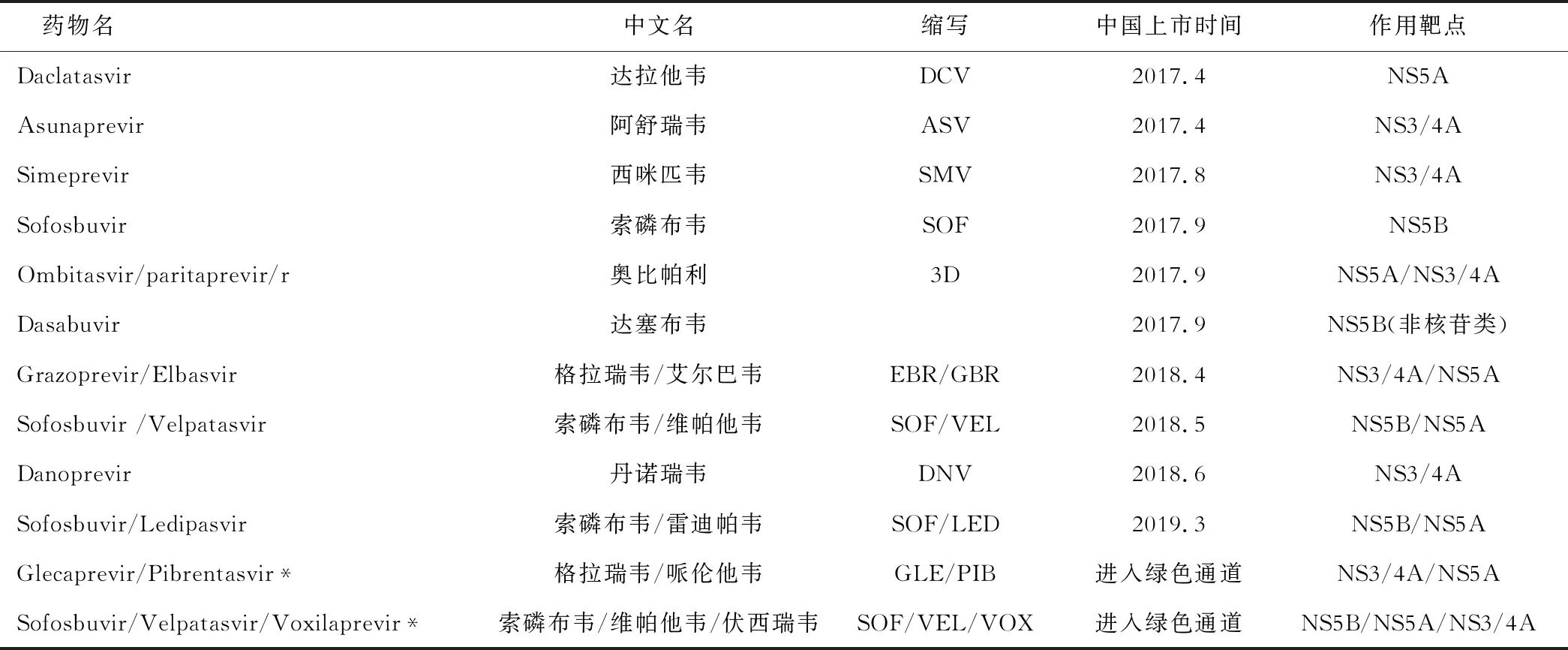
表1 目前中国已经上市的DAAs药物
*该药暂未在中国上市,但已经进入新药审批绿色通道
SOF联合DAC是通过研究者发起的临床研究而被证实有效的治疗方案。由于不含蛋白酶抑制剂,与其他药物合并使用时药物间相互作用小,该方案可以应用于有失代偿风险,甚至已处于失代偿期的肝硬化患者,也可应用于肝移植和HIV合并感染者。多个临床研究显示在不同人群中,该方案的SVR12可以达到95%左右。因此,在既往欧美及我国指南中,该方案联合或不联合利巴韦林使用12~24周被推荐用于所有基因型的HCV感染者。然而在2018年更新的EASL指南却不再对该方案进行推荐。药物经济学因素和完善前期临床研究数据的替代方案出现可能是影响指南推荐决策的原因。
SOF/VEL是目前应用最广的全基因型治疗方案,也是当下主流指南更为推荐的全基因型方案。其中的第二代NS5A抑制剂VEL有较强的HCV的抑制活性,与SOF联合应用12周可用于所有基因型患者的治疗,尤其在非基因3型的HCV感染者中,SVR12可以高达96%~100%。但是在基因3型HCV感染者中,12周SOF/VEL的治疗有效率有待进一步提高。基因3型HCV是DAAs难治型病毒株,有肝硬化或RAS(如Y93H)的基因3型患者推荐加用利巴韦林以提高应答率。我国基因3b型患者中A30K+L31M联合突变率高,SOF/VEL在中国的Ⅲ期临床注册研究中治疗失败的受试者也多为基因型3b型肝硬化患者。因此,在此类患者中同样推荐加用利巴韦林以提高疗效。
(二)基因型特异性治疗方案
在全基因型治疗方案之外,基因1型和4型HCV感染也可以选择SOF/LED、3D方案、SOF联合蛋白酶抑制剂SMV、EBR/GBR等进行治疗。
尽管暂时缺乏头对头研究,仍有几个大规模真实世界的注册研究提示,含有NS5A抑制剂的方案优于SOF联合蛋白酶抑制剂。此外,SOF/LED、3D方案、SOF联合蛋白酶抑制剂方案中均含有NS5B抑制剂,这似乎提示了抑制聚合酶的重要性。然而,EBR/GBR中因为含有第二代蛋白酶抑制剂,虽然没有靶向NS5B,却仍然在基因1b型和4型感染者中显示出同样强效的抗病毒能力。
(三)肝功能失代偿患者
部分HCV感染者在明确诊断时已进入失代偿肝硬化期(Child-Turcotte-Pugh B或C),或者在肝移植后HCV复发。由于蛋白酶抑制剂主要在肝脏进行代谢,在这部分患者中使用含蛋白酶抑制剂的方案有导致肝功能失代偿加重的风险,不含蛋白酶抑制剂的方案更为安全。基因型特异性方案SOF/LED,全基因型方案SOF/VEL、SOF+DAC均是可以选择的方案,并需要通过联合利巴韦林以缩短疗程,提高疗效。
(四)合并慢性肾脏疾病患者的治疗选择
无论是因为透析感染HCV抑或是HCV的肝外表现,HCV感染者常伴有肾功能不全。SOF需要通过肾脏清除,因此在肾小球滤过率低于30 mL/min的患者中未被批准使用;而利巴韦林在肾功能不全的患者中更不易耐受。寻求主要通过肝脏,较少或者不通过肾脏清除的DAAs方案是解决此类问题的关键。目前有三种不含SOF的方案被批准应用于终末期肾病患者,包括EBR/GBR,3D或者奥比帕利单用。然而这三个方案只能应用于基因1、4型HCV感染者,其他基因型感染者的治疗仍然存在问题。
(五)DAA治疗失败患者再治疗的选择
尽管DAAs有较高的病毒学应答率,仍然存在治疗失败的患者。依从性不佳、治疗早期中断用药、再感染、RAS、初治方案选择不当等都可能导致DAAs治疗失败。
SOF具有高耐药屏障,目前仅有体外研究证实S282T与SOF耐药相关,其他RAS位点的相关性并不明确。基因1型感染者使用SOF联合利巴韦林或者SOF联合PR方案治疗失败后,可以选择基于NS5A抑制剂的方案进行再治疗,如SOF/LED或者SOF/VEL。非基因1型感染者可以选择SOF/VEL,但研究数据并不充分。POLARIS研究更提示基因1a型和3型可能影响HCV感染者在接受SOF/VEL再治疗时的病毒学应答率。
蛋白酶抑制剂治疗失败患者多有药物诱导的RASs出现,基因1a型HCV最常出现的RASs多在D168位点,基因1b型HCV还可能在D168E基础上出现R155K。RASs的存在导致病毒株对所有NS3/4A蛋白酶抑制剂均耐药,因此,切换为基于NS5A抑制剂的方案(SOF/LED、SOF/VEL或者SOF+DAC)可能是更好的选择。
大部分NS5A抑制剂对所有基因型的HCV病毒株具有抗病毒活性,但耐药屏障较低。在基于LED或者DCV方案治疗失败的患者中,Q30H/R、L31M和Y93H为常见RASs。其中,在基因1b型病毒株中L31M和Y93M常见;在基因3型中Y93H常见。SOF/VEL联合利巴韦林治疗24周是欧盟第一个批准可以在NS5A抑制剂经治患者中使用的再治疗方案。第二代NS5A抑制剂VEL耐药屏障较第一代有所提升,但治疗失败仍然存在。小样本II期临床研究证实,VEL经治患者使用SOF/VEL联合利巴韦林24周,可以使91%的感染者获得病毒学应答。该研究同样证实了SOF/VEL联合利巴韦林24周作为NS5A抑制剂经治患者再治疗方案的有效性。
二、新的治疗方案的特点
(一)新的泛基因型复合制剂
Glecaprevir/Pibrentasvir (GLE/PIB)复合制剂中的两个成分分别靶向NS3/4A和NS5A,GLE在肝脏代谢,通过胆汁清除,PIB以原型形式通过胆汁清除,两药几乎不在肾脏中代谢。二者在体外研究中对所有基因型的HCV病毒株均显示出强大的抗病毒活性。全球范围内已有多个III期临床研究评价了8~16周GLE/PIB方案在基因1~6型非肝硬化或代偿期肝硬化HCV感染者中的疗效和安全性,结果显示97%~100%的患者均可以获得持续病毒学应答。安全性方面,GLE/PIB方案8周及12周疗程的严重不良事件(SAE)发生率分别为2%和3%,而其中DAA相关的SAE或停药事件总体小于1%。此外,PIB的耐药屏障高于其他NS5A抑制剂,已知的NS5A上28、30、31和93位点RASs均不会影响其抗病毒活性。因此,欧洲肝病学会及美国肝病学会指南均指出GLE/PIB方案在DAAs初治患者中的疗效不受基线RAS影响,无需检测基线RAS情况。
Sofosbuvir/Velpatasvir/Voxilaprevir(SOF/VEL/VOX)已在欧洲、加拿大和美国获批。该药物同时靶向NS5B、NS5A和NS3/4A。其12周方案被批准应用于NS5A治疗失败的非肝硬化或代偿期肝硬化患者。在欧洲,8~12周的方案也被批准应用于初治的非肝硬化或者代偿期肝硬化患者。四项大型III期临床研究(POLARIS系列研究)评价了该方案的疗效和安全性,结果显示无论何种基因型,是否NS5A抑制剂经治,是否产生药物诱导的RASs,超过95%的患者可以获得持续病毒学应答[5-6]。
(二)如何在现有路径中应用新方案
我国现有的全口服方案中,SOF/VEL是最常被选择的泛基因型治疗方案。因此,当新的DAAs上市后,以SOF/VEL和GLE/PIB作为主力,再以SOF/VEL/VOX作为后备力量,将可以解决几乎所有HCV感染的治疗挑战。8~16周的GLE/PIB方案虽然可以治疗所有基因型HCV的感染者,但其最显著的优势在针对基因1a型病毒株时强大的抗病毒活性。不仅如此,无论患者是否经治,是否存在肝硬化,均不会影响该方案的抗病毒效应。
SOF/VEL/VOX作为同时靶向三个靶点的药物,具有更强的抗病毒活性。虽然该药在欧洲被批准应用于初治,但考虑到SOF/VEL和GLE/PIB的可及性更广,多数专家更推荐将其纳入二线治疗选择,而非一线治疗。
基因3型DAAs经治肝硬化患者的治疗是大部分DAAs方案的软肋,8周的SOF/VEL/VOX方案是基因3型经治代偿期肝硬化人群的一种选择,16周的GLE/PIB方案也适宜在该类患者中应用。
GLE和PIB均不通过肾脏代谢和清除,使得该方案在慢性肾功能不全患者中有极佳的应用前景。2018年美国肝病会议报道了一项汇总分析,纳入2项III期开放性、多中心研究,分析了基因1~6型HCV感染合并CKD4~5期患者接受GLE/PIB方案治疗的疗效,总体SVR12为98%。如患者并非肝硬化,基因3型PR经治,暴露过其他DAAs等需延长疗程的指征,8周的GLE/PIB方案足以让其获得满意的病毒学应答率。GLE/PIB方案及EBR/GBR方案在基因1型和4型伴肾功不全患者中均有满意的疗效,GLE/PIB方案也应被推荐应用于其他基因型的感染者。
此外,尽管美国和加拿大批准GLE/PIB方案应用于基因1型DAAs经治患者的再治疗,欧盟却并未批准其挽救治疗适应证。尤其在既往应用蛋白酶抑制剂联合NS5A抑制剂治疗失败的患者中,再治疗的应用更需谨慎。如果确实必要,建议进行RASs检测。SOF/VEL/VOX在再治疗中有更为明显的优势。由于同时靶向三个位点,且均有较高耐药屏障,应用SOF/VEL/VOX进行挽救治疗时无须检测RASs。当GlE/PIB治疗失败后,SOF/VEL/VOX可以应用于挽救治疗。近期也有研究表明,SOF+GlE/PIB也可应用于GlE/PIB治疗失败患者的再治疗。
三、仍然存在的挑战
由于均含有蛋白酶抑制剂,GLE/PIB、SOF/VEL/VOX、SOF+ GLE/PIB不被推荐应用于失代偿期肝硬化患者。此外,当SOF/VEL/VOX治疗失败后,挽救治疗方案也并不明确,加用利巴韦林并延长疗程至24周,或者使用SOF联合GlE/PIB及利巴韦林至16周可能是此时进行再治疗的候选方案,但是还需要进一步的研究数据支撑。更重要的是,目前儿童HCV感染的DAAs治疗方案仍然欠缺。SOF/LED和SOF联合利巴韦林是目前仅有的可供12岁以上青少年选择的全口服方案。因此,要完成WHO提出的2030年清除丙肝的目标,我们仍然需要继续努力。

