生物反应器悬浮培养Vero细胞制备水貂犬瘟热活疫苗
冯二凯,程悦宁,罗国良,易 立,王振军,郭 利,陈立志,程世鹏∗
(1.中国农业科学院特产研究所,长春130112;2.吉林特研生物技术有限责任公司,长春130122)
水貂犬瘟热(Mink canine distemper,CD)是由犬瘟热病毒(Canine distemper virus,CDV)引起一种高度接触性传染病[1],与水貂阿留申病、细小病毒性肠炎并称为水貂养殖业的“三大杀手”,每年都给我国水貂养殖企业或养殖户造成巨大的经济损失,严重威胁水貂养殖业健康发展[2-4]。目前水貂犬瘟热没有特效的治疗药物,仅能通过疫苗免疫预防。中国农业科学院特产研究所先后研制了第一代水貂犬瘟热鸡胚成纤维细胞疫苗[5]和第二代水貂犬瘟热活疫苗(传代细胞源)[6],疫苗研制为有效控制我国毛皮动物犬瘟热疫情的发生和流行奠定了基础。但是,伴随着生物制品生产规模不断扩大,工艺水平不断提升,传统转瓶工艺已经不能满足现代疫苗企业的生产需求;另一方面,伴随着我国规模化养殖进程加速以及各种重大疫情频发的现实,疫病正在成为养殖产业的主要风险,一旦发生疫情,损失惨重。因此规模化养殖厂需要优质、高效疫苗[5]。本研究在前期初步掌握Vero 细胞悬浮培养工艺参数基础上[7],继续优化细胞培养方式、病毒最佳感染复数以及病毒感染时间等参数,建立水貂犬瘟热Vero 细胞活疫苗(CDV3-CL 株)的悬浮培养制备工艺,研制新型水貂犬瘟热高质量疫苗。
1 材料与方法
1.1 材料 犬瘟热病毒(CDV3-CL 株,105.0TCID50/0.1mL),由中国农业科学院特产研究所鉴定和保存;Vero 细胞(CCL-81),购自ATCC。新生牛血清(批号:20160405),由内蒙古金源康生物提供;MEM(批号:1823760)、DMEM(批号:1693945)和DMEM 低糖(批号:31600-091)由Gibco 公司提供;DMEM/F12(批号:66005-050),由甘肃健顺生物提供;二氯二甲基硅烷(硅油:批号F1721024)购自上海阿拉丁生化科技股份有限公司。7L 生物反应器购自广州齐志生物工程股份有限公司。
1.2 反应器处理 于通风橱内,取少量硅油均匀涂抹反应器以及2 L 蓝盖瓶内壁,倒置、自然晾干后,利用无水酒精中和,自来水冲洗6~7 次,双蒸水洗涤3 次,于60 ℃烘箱内烘干备用。
1.3 微载体处理 取已硅化蓝盖瓶,称取适量微载体,按照100 mL/g 微载体的比例加入无Ca2+、Mg2+的PBS,于4 ℃浸泡过夜;弃PBS 和漂浮微载体,按200 mL/g 微载体的比例加入无Ca2+、Mg2+的PBS,校正电极、安装生物反应器、120 ℃高压灭菌30 min,冷却至室温备用。
1.4 细胞培养及优化 以不同培养基(MEM、DMEM、DMEM(低糖)、DMEM/F12)以及不同初始接种密度接种生物反应器悬浮培养种子细胞,每天检测细胞密度、监测葡萄糖消耗量,根据葡萄糖消耗量和细胞生长情况,筛选合适的细胞培养基、初始接种密度以及合适的培养方式(批次、流加和灌流)。
1.5 病毒原液制备 以不同病毒感染复数(multiplicity of infection,MOI)(0.01、0.001、0.0001)的CDV 分别接种悬浮培养种子细胞,测定不同MOI对CDV 滴度的影响,确定最佳MOI。接毒后每24 h取样测定CDV 效价,确定最佳收获时间(TOI)。
1.6 工艺验证 采用确定的水貂犬瘟热Vero 细胞活疫苗悬浮培养工艺分别制备3 批水貂犬瘟热病毒液,测定其病毒TCID50,验证工艺参数的稳定性。
1.7 病毒滴度测定 病毒滴度参照常规方法测定,按照公式Reed-Muench 法计算病毒样品的TCID50。
1.8 疫苗制备 利用验证后工艺参数制备配苗病毒液,无菌检验合格、配制、分装、冻干;按照《中国兽药典》第三部附录完成疫苗物理性状、无菌、支原体和外源病毒检验等。
2 结 果
2.1 培养基对种子细胞、病毒增殖的影响 图1显示4 种商业化培养均能支持Vero 细胞生长,但DMEM(低糖)、MEM 培养基在培养72 h 后,细胞密度相对较低;而DMEM、DMEM/F12 都能支持Vero细胞高密度培养,其中以DMEM 培养基支持Vero细胞增殖效果最佳。
图2显示不同培养基条件下对悬浮细胞进行接毒后的病毒滴度情况,从中可以看出DMEM 培养条件下的CDV 增殖效果最佳。
2.2 初始接种密度对种子细胞增殖以及培养方式的影响 图3是不同初始接种密度对种子细胞培养密度及培养周期的影响。细胞接种后24 h,60 cells/球实验组的细胞密度略有下降,与39 cells/球实验组基本持平,但高于20 cells/球实验组;细胞接种后48 h,细胞密度迅速上升,60 cell/球实验组细胞密度最高,39 cells/球次之,20 cells/球最低;培养至72 h,60 cells/球和39 cells/球实验组的细胞密度可达到200 cells/球以上,满足了接毒要求;而初始接种密度为20 cells/球时,需要一直培养至144 h,才满足接毒要求。不同初始接种密度不仅影响培养细胞的密度和培养周期,而且还影响细胞培养的方式。以60 cells/球接种时,细胞在接种后24 h 即出现葡萄糖浓度不足,不得不改用灌流方式培养;而以20 cells/球接种时,细胞培养周期延长,虽然前期不需要灌流,但是后期也需要长时间的灌流培养才能获得满足接毒要求的细胞密度;而以39 cells/球接种时,在0~48 h 仅批培养即可;48 h~72 h 采用灌流方式让细胞快速增殖,以满足反应器接毒需求。
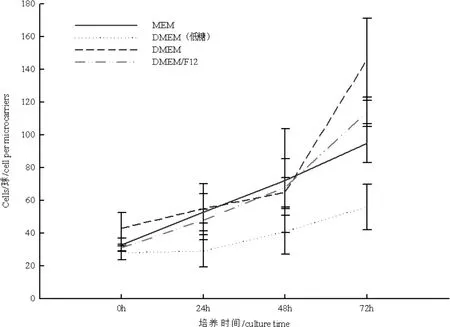
图1 不同培养基支持Vero 细胞增殖效果Fig 1 The influence of medium on the proliferation of Vero cell

图2 不同培养基支持水貂犬瘟热增殖效果Fig 2 The influence of medium on the proliferation of canine distemper virus
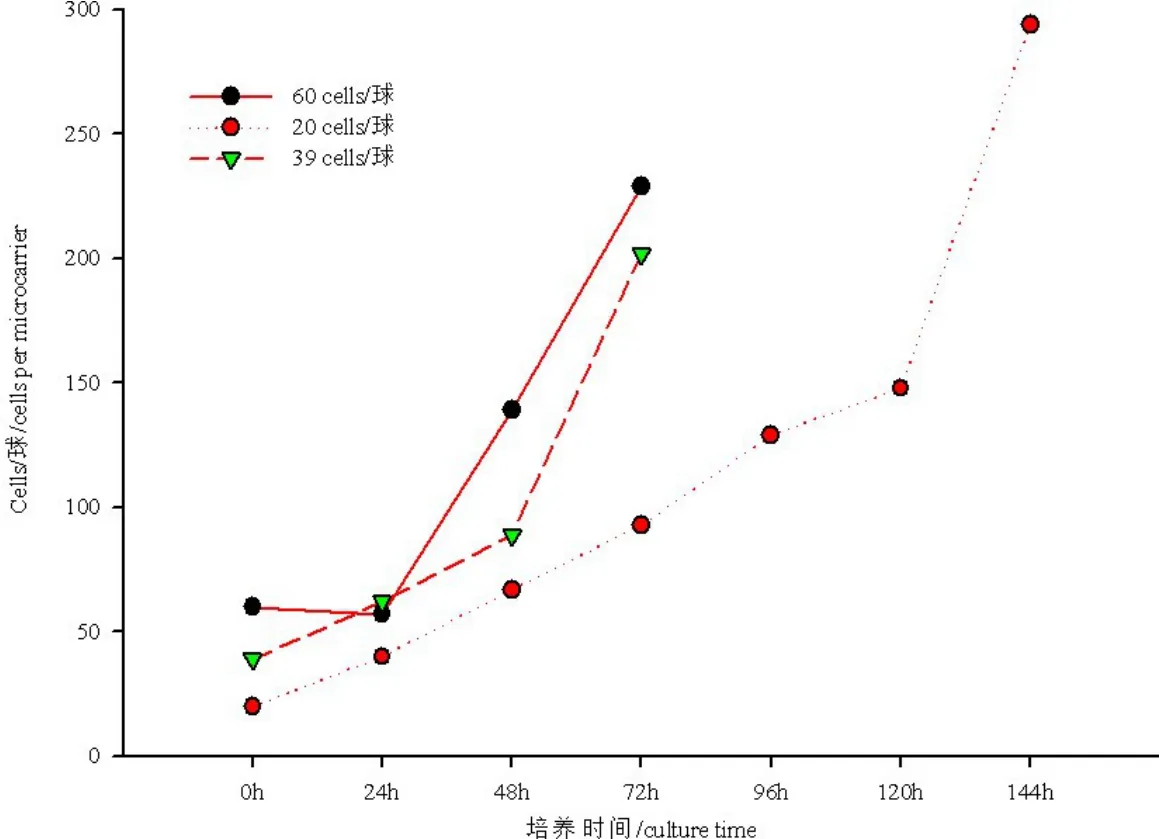
图3 初始接种密度对Vero 细胞增殖的影响Fig 3 The effect of the initial inoculation density on the proliferation of Vero cell
2.3 培养方式对Vero 细胞增殖的影响 图4直观地显示了培养方式对Vero 细胞增殖的影响。相对于批次培养,DMEM(批次+灌流),DMEM/F12(批次+灌流),甚至MEM(批次+灌流),均可以显著提升Vero 细胞的细胞密度;其中DMEM(批次+灌流),DMEM/F12(批次+灌流)均可以在培养第72 h范围内使Vero 细胞满足接毒要求。
2.4 最佳MOI 和TOI 确定 图5显示的是不同感染复数MOI 对CDV 滴度的影响。过高的MOI(0.01和0.04),导致细胞快速从微载体上脱落(48 h),病毒滴度较低(图5C 和5D),说明MOI 能够直接影响病毒增殖效率。当MOI 为0.0006 和0.0003 时,病毒增殖时间延长,均可以获得较高地的CDV 增殖效价,其中MOI =0.0006 效价最高,达到107.2TCID50/0.1mL(图5A),病毒的峰值均出现在120 h左右(图5A 和B),所以确定CDV 的最佳MOI 为0.0001~0.001,确定CDV 的最佳TOI 在100~120 h之间。
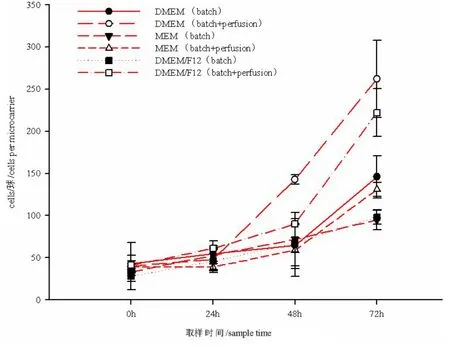
图4 培养方式对Vero 细胞增殖的影响Fig 4 The influence of culture mode on the proliferation of Vero cell
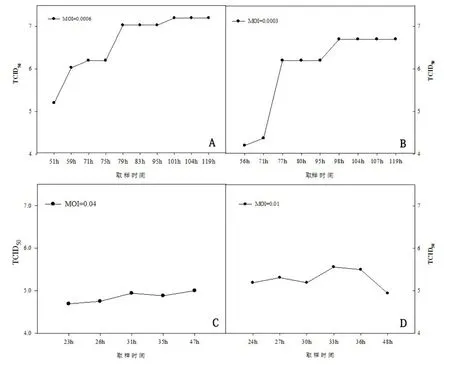
图5 不同感染复数对CDV 病毒效价的影响Fig 5 The MOI effect on tilter of CDV
2.5 工艺重复性验证 为了验证工艺的重复性,利用建立的水貂犬瘟热Vero 细胞活疫苗悬浮培养工艺参数重复培养水貂犬瘟热病毒(CDV3-CL 株)3 次,对每次获得的病毒液进行滴度测定,结果如图6所示。从图中可以看出,建立的工艺参数具有很好的重复性。
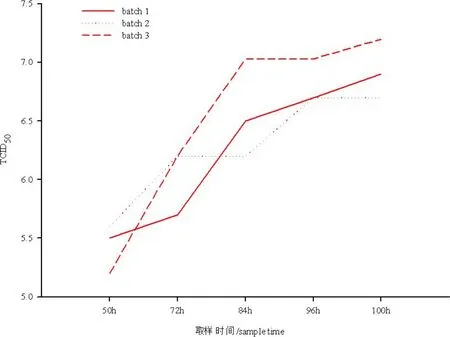
图6 水貂犬瘟热Vero 活疫苗悬浮工艺重复性验证Fig 6 The repeatability test of the suspension culture craft for preparing mink canine distemper attenuated lived vaccine
3 讨 论
毛皮动物养殖极易受到疫病威胁,急需高质量疫苗为行业健康发展保驾护航[5]。然而目前毛皮动物疫苗大多采用转瓶工艺生产,需要使用高浓度血清,生产的疫苗批间差异大,无法满足市场对高质量疫苗的需求,亟需对疫苗的制备工艺进行升级换代。
本研究基于已有的水貂犬瘟热活疫苗(CDV3-CL 株)的转瓶工艺参数,通过控制参数法对疫苗的悬浮培养制备工艺关键参数,例如培养基、初始接种密度、培养方式以及病毒MOI 以及TOI 等进行系统摸索和优化。以培养基为例,本研究发现所有培养基(MEM、DMEM、DMEM(低糖)、DMEM/F12)均可以维持Vero 细胞悬浮培养,但它们所能支持Vero 细胞增殖和病毒增殖的能力有差异:MEM 最弱,DMEM(低糖)次之,DMEM 最高(批次培养,图1和图2);与夏德镇等[7]报道略有不同,其利用MEM 培养基通过灌流培养可以支持3~20 g/L 微载体高密度培养Vero 细胞,但最高密度出现时间在120~140 h 之间。为了能在最短时间内获得较高的细胞密度,以便于与传统疫苗制备周期持平,试验选择了能够更好支持细胞增殖的DMEM 作为生产培养基。
细胞初始接种密度高或低以及微载体用量也是悬浮工艺开发的关键参数,因为其不但影响细胞培养周期,而且影响细胞的培养方式。韩中山等[8]在研究狂犬病毒悬浮制备工艺过程中,发现较高的初始接种密度会增加营养物质的消耗速率,需要通过灌流培养才能维持细胞增殖。本研究也有同样的发现,以60 cells/球为例,在培养早期(24~36 h)就需要对细胞进行换液或灌流培养;而细胞初始密度为20 cells/球时,虽然在培养早期不需要灌流培养,但其培养周期被延长至144 h 才满足接毒要求,随着培养时间的延长也需要进行换液或灌流操作;此外,较高的细胞密度会增加初始细胞的用量,在规模化生产过程中会增加初级种子的用量以及操作步骤,增加污染风险。
培养方式对工艺的影响主要体现在营养物质工艺和代谢废物清除两个方面。批次培养模式提供的营养物质不足以支持细胞高密度、长期培养,并且会造成代谢废物积累。Trabelsi K 等[9]在利用不同模式培养Vero 细胞生产狂犬病毒过程中发现,其乳酸的积累要高于灌流培养,细胞密度却低于灌流培养。
病毒感染复数(MOI)及病毒感染时间(TOI),主要影响病毒的增殖以及病毒收获时间。不同的病毒的MOI 和TOI 也不尽相同。在本研究早期,利用高MOI(0.01 和0.04)感染Vero 细胞,细胞在48 h即几乎全部脱落(数据未提供),病毒未能得到很好增殖,病毒滴度也较低(图3A);当MOI 调整为0.0006 时,病毒增殖周期从原来的48 h 延长至144 h,病毒的滴度也大幅提升(107.2),较转瓶工艺提升了近2 个滴度,极大地提升了疫苗的制备效率,降低了疫苗批次间的差异。
综合考虑以上因素,通过优化组合形成了适合水貂犬瘟热Vero 细胞活疫苗的悬浮制备工艺:培养基选择DMEM,微载体用量规定为5 g/mL,细胞初始接种密度设定为30~40 cells/球,培养方式为批次+灌流培养,培养细胞72~96 h 左右或细胞密度达到200 cells/球以上时,以MOI 为0.0001~0.001的比例接种水貂犬瘟热病毒CDV3-CL 株,调低培养温度(33 ℃)继续培养100~120 h,收获病毒液,即可用作配制疫苗的半成品。按照《中国兽药典》三部(2015 版)的规定完成半成品的相关检验,即可稀释、分装、配苗。本研究为水貂犬瘟热Vero细胞活疫苗规模化悬浮生产奠定了基础。

