ESR法研究pH值对Pt催化N2H4断键的影响机制
张晓腾,郝 帅,何 博,蒋冬梅,唐菲菲,夏良树,*
(1.南华大学 核科学技术学院,湖南 衡阳 421001;2.南华大学 化学化工学院,湖南 衡阳 421001;3.南华大学 创新创业学院,湖南 衡阳 421001)
废物的最小化是后处理流程中考虑到的非常重要的因素之一。为限制废物的体积,不向流程中引入除水和气体以外的其他新离子或废物的无盐流程更受欢迎。在N2H4作为支持还原剂的情况下,U(Ⅳ)是一种较好的Pu(Ⅳ)还原反萃剂,它具有对钚的还原反萃完全、不向系统引入杂质、反应速率较快等优点。但四价是铀的一种不稳定价态,在硝酸溶液中U(Ⅳ)很容易被氧化成U(Ⅵ),故乏燃料后处理厂需有专门的车间来制备U(Ⅳ)。因此,U(Ⅳ)的制备在Purex流程的实现过程中显得尤为重要。
目前,异相催化还原法制备U(Ⅳ)成为主流。近年来,Swanson[1]、Boltoeva等[2-5]、李斌等[6]一些国内外学者在N2H4催化还原U(Ⅵ)制备U(Ⅳ)的还原剂选择、催化剂类型及形式、反应体系及工艺条件优化等方面开展了较多研究。为能根据反应机理对目前工艺研究中存在的一些不足和问题进行改进,确定反应的控制步骤,有针对性地提高此控制步骤的反应速率而加快其反应速度,来进一步优化工艺条件,提高催化剂的活性和选择性,有必要明确N2H4被催化断键的机理以及反应历程。本课题组[7-8]已通过电子自旋共振(ESR)法研究了N2H4断键产生的初级自由基,并通过化学分析方法对硝酸介质下Pt催化N2H4还原U(Ⅵ)制备U(Ⅳ)过程中的产物进行了分析,确定了此反应过程中N2H4的断键机制,得出了肼在Pt催化剂表面N—N断键和N—H断键两种方式共存的结论。要深入研究N2H4还原U(Ⅵ)制备U(Ⅳ)过程中的反应历程以及反应机理,寻求最佳的反应工艺条件,就必须确认N2H4在Pt催化剂表面的断键机理。本文采用ESR法研究酸度对N2H4还原U(Ⅵ)制备U(Ⅳ)过程中N2H4断键的影响,探究N2H4在酸性条件下的断键机理,为乏燃料后处理中铀钚分离试剂U(Ⅳ)制备工艺的优化提供理论依据及技术支持。
目前国内外研究团队大多是在将N2H4作为燃料或电池使用时研究其分解,在此类应用条件下,反应体系对酸碱环境没有要求,但在碱性环境条件下可提高N2H4非解离分解反应比例,故研究pH值对N2H4分解的影响多集中在碱性环境。Wang等[9]的研究表明,加入OH-有利于N2H4的选择性分解;Yamada等[10]的研究表明,OH-的存在会影响N2H4断键的方式和程度;Yin等[11]的研究表明,在碱性条件下,N2H4分解程度随碱性增加而先升高后降低。在乏燃料后处理体系中,是以N2H4作为还原剂,铂催化N2H4分解产生的自由基来还原U(Ⅵ)制备U(Ⅳ),而该体系酸度达到2 mol/L[12]。目前在乏燃料后处理体系中研究pH值对N2H4分解的影响及N2H4分解机制的工作还未开展过。本文通过ESR法研究·NH2转化为·OH的机理,以及高氯酸介质下Pt催化N2H4还原U(Ⅵ)制备U(Ⅳ)过程中pH值对N2H4分解的影响,确定N2H4在酸性介质下的断键趋势及pH值对Pt催化N2H4断键的影响机制,从而为最终确定Pt催化N2H4还原U(Ⅵ)制备U(Ⅳ)的反应历程、反应机理及反应条件的优化提供理论技术支持。
1 仪器及试剂
N2H4(85%,分析纯)、高氯酸(72%,分析纯),国药集团化学试剂有限公司;氮气(99.99%),兴东气体有限公司;5,5-二甲基-1-吡咯啉-N-氧化物(DMPO),酷尔化学科技(北京)有限公司;SiO2负载Pt催化剂(粒径30~50目,3%负载),自制;二甲基亚砜(DMSO,分析纯),国药集团化学试剂有限公司。
Bruke A300电子自旋共振(ESR)仪,德国Bruke公司。
2 实验
2.1 高氯酸肼溶液配制
用N2H4(85%,分析纯)和高氯酸(72%,分析纯)分别配制N2H4浓度为0.25 mol/L,高氯酸浓度分别为3、1 mol/L,pH=1、2、3、5、7,以及N2H4浓度为0.5 mol/L,高氯酸浓度分别为3、1 mol/L,pH=1、2、3、5、7的反应体系。将制备液放置手套箱中通氮气除氧5 min,备用。
2.2 ·OH的分析检测
1) 向手套箱中通氮气,去除箱中的氧气;
2) 取80 μL N2H4浓度为0.25 mol/L、pH=1的高氯酸肼溶液,并加入极少量SiO2/Pt催化剂(粒径30~50目,5~6粒)反应2 min;
3) 向反应体系中加入8 μL DMPO,振荡并捕捉反应30 s后,用毛细移液管移取50 μL置于ESR仪中,检测磁场强度范围为0.346~0.356 T,分析检测可能出现的·H、·OH以及·NH2;
4) 另取80 μLN2H4浓度为0.25 mol/L、pH=1的高氯酸肼溶液,并加入极少量SiO2/Pt催化剂(粒径30~50目,5~6粒)反应2 min;
5) 向反应体系中加入4 mL DMSO,振荡,等待30 s;
6) 再向体系中加入8 μL DMPO,振荡并捕捉反应30 s后,用毛细移液管移取50 μL置于ESR仪中分析检测自由基。
2.3 ESR法研究pH值对N2H4断键的影响
分别按照2.2节中的实验步骤改变反应液中N2H4浓度和酸度,分析检测在0.25 mol/L和0.5 mol/L N2H4浓度及高氯酸浓度分别为3、1 mol/L,pH=1、2、3、5、7条件下产生的自由基,探究反应体系pH值对N2H4断键的影响。
3 结果与讨论
3.1 ·NH2转化为·OH的实验研究
Ertl等[13-14]及Falconer等[15]的研究表明,N2H4在分解过程中会产生·NH2;本课题组[8]在通过化学分析方法对硝酸介质下Pt催化N2H4还原U(Ⅵ)制备U(Ⅳ)过程中的产物进行分析研究时也得出同样的结论。但杨海军等[16]的研究表明,在酸性条件下,·NH2会向·OH转化,郝帅等[7]通过ESR法研究Pt催化N2H4分解时也得到同样的结论,并确定了Pt催化N2H4分解的反应机理。然而Madden等[17-18]的研究表明,在DMPO存在的情况下可能会出现DMPO自捕捉以及DMPO加成·H异化形成·OH,导致样品中原有·OH表达出现误差。
为验证ESR谱中·OH峰的形成是DMPO对实验产物进行的捕捉,而不是由于DMPO的加入而引起的自旋捕捉,进行2组对比实验,实验条件为:pH=1、N2H4浓度0.25 mol/L。第1组实验,在pH=1的高氯酸肼溶液中,加入少量SiO2/Pt催化剂,反应2 min后再加入DMPO捕捉剂,得到的ESR谱示于图1。
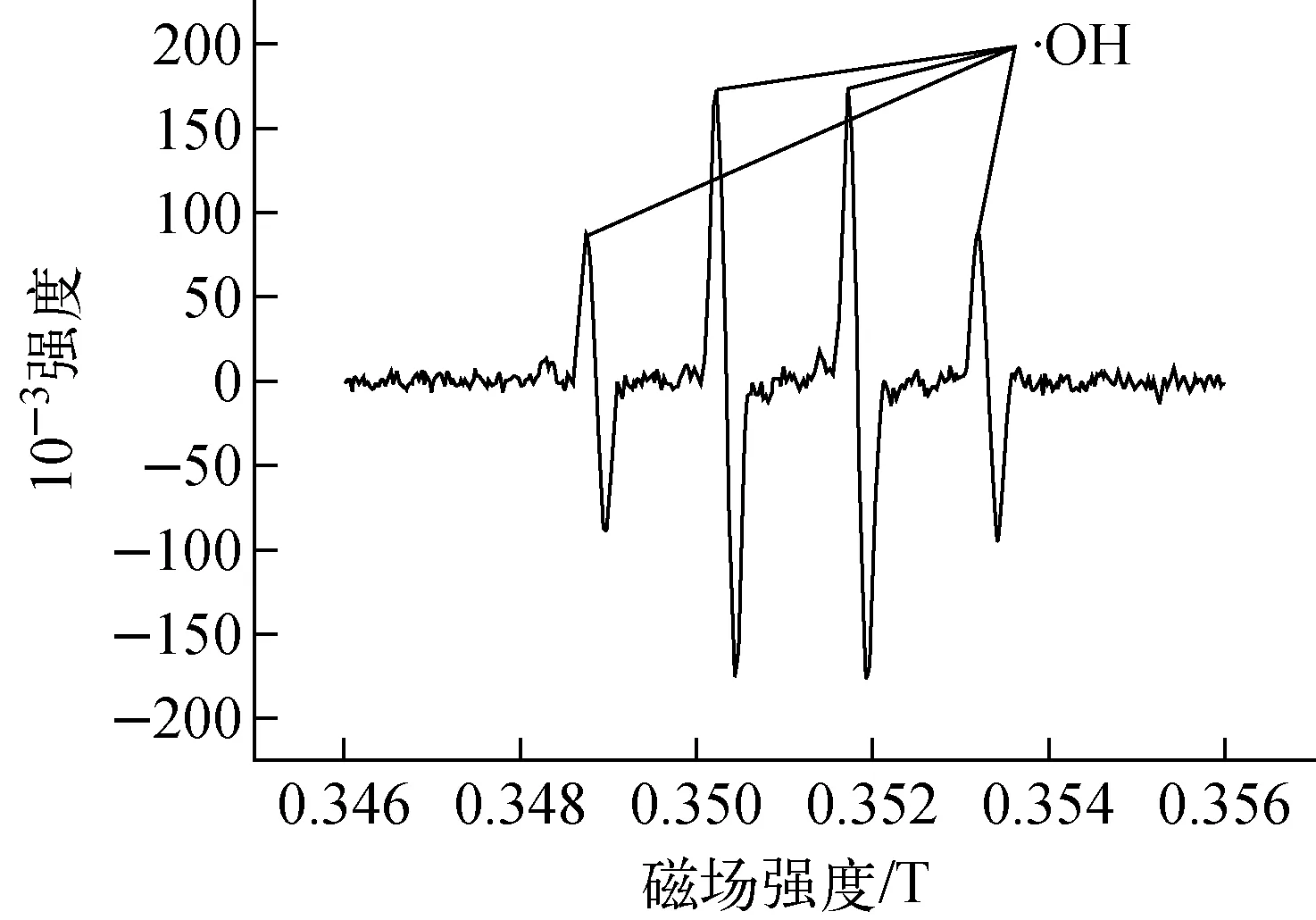
图1 Pt催化高氯酸肼溶液反应体系的ESR谱
第2组对照试验,在加入SiO2/Pt催化剂反应2 min后,加入羟基清除剂DMSO,而后再加入DMPO捕捉剂,得到的ESR谱示于图2。
图1中出现明显的·OH峰,说明实验过程中产生了·OH。但为排除DMPO自捕捉以及·H被DMPO捕捉后发生异化而产生·OH的可能性,在第2组试验中特别加入DMSO清除反应产生的自由基。由图2可看出,图中显现为清除·OH后的·NH2峰,并没有明显的DMPO捕捉·OH峰。此结果表明,ESR谱上显现的·OH是在加入DMPO前的实验过程中产生的,并不是DMPO自捕捉或·H被DMPO捕捉后发生异化而产生的。这与Takayanagi等[19]以及本课题组前期研究结果[7-8]相一致。其中·OH的产生途径为:

(1)

(2)
(3)
(4)
因此,本实验以N2H4分解产生·NH2在酸性条件下转化的次级自由基·OH为标准,用以表达·NH2的量,进而反映N2H4的断键情况。
3.2 酸度对N2H4断键的影响
初始N2H4浓度为0.25 mol/L、SiO2负载3%Pt作催化剂、反应时间为2 min、捕捉剂为DMPO、捕捉时间为30 s时,不同酸度条件下Pt催化N2H4分解形成的ESR谱示于图3。
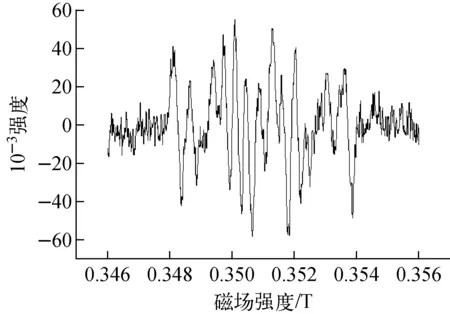
图2 加入DMSO后的Pt催化高氯酸肼溶液反应体系的ESR谱
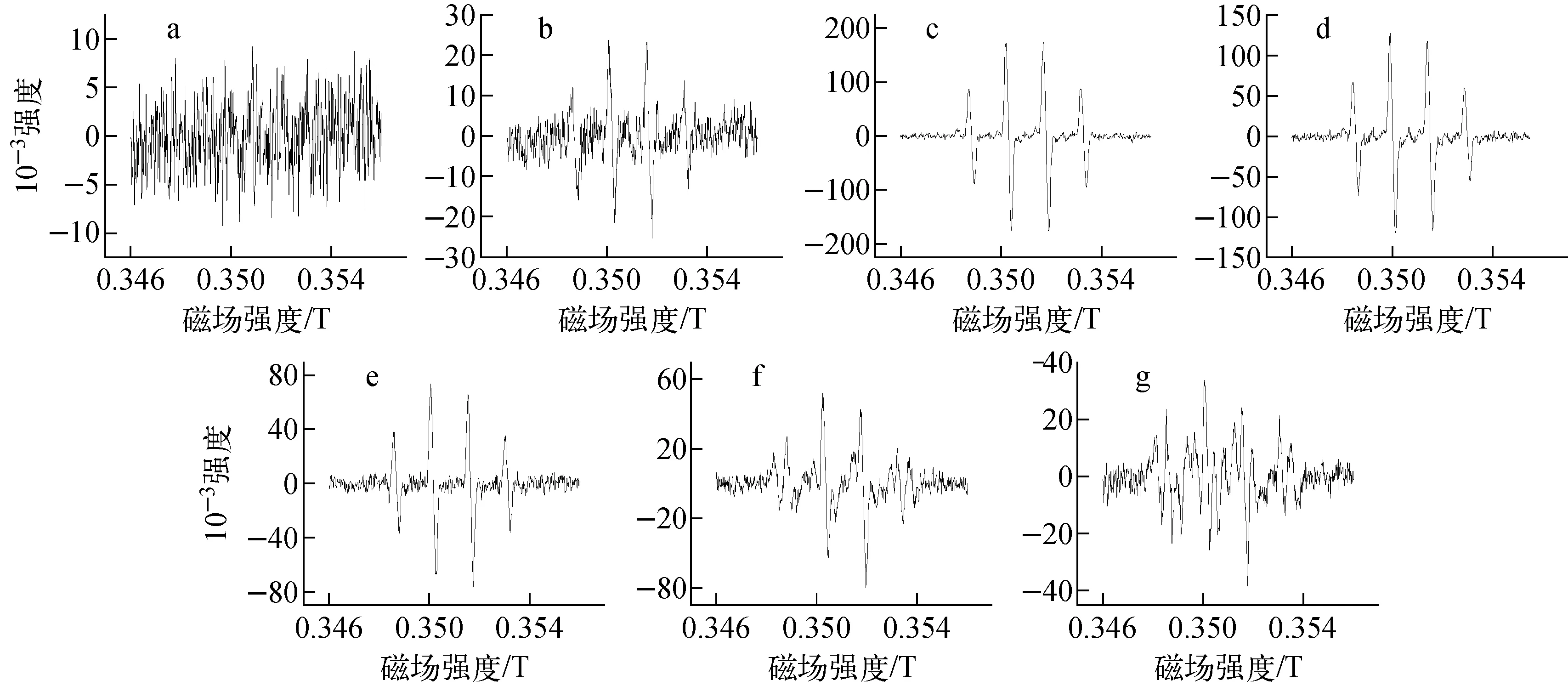
酸度:a——3 mol/L;b——1 mol/L;c——pH=1;d——pH=2;e——pH=3;f——pH=5;g——pH=7图3 初始N2H4浓度为0.25 mol/L时酸度对N2H4断键的影响
在初始N2H4浓度为0.5 mol/L、SiO2负载3%Pt作催化剂、反应时间为2 min、捕捉剂为DMPO、捕捉时间为30 s时,不同酸度条件下Pt催化N2H4分解形成的ESR谱如图4所示。
图3、4中0.348~0.354 T范围内出现的与图1中类似的、峰高比例为1∶2∶2∶1的峰皆为·OH特征峰。在反应过程中,样品的取样量皆为50 μL,峰高体现的是相同条件下,此种自由基的相对含量。从图3可看出,当反应体系酸度较高(>1 mol/L)时,几乎检测不到有效的自由基;当酸度逐渐降低时,·OH峰逐渐显现且有增高的趋势,并在pH=1~2时达到最高;而后随着酸度的降低,·OH峰再次降低,同时逐步出现少量·NH2峰,这与杨海军等[16]的研究结果相符。从图4可看出,改变体系N2H4的浓度,·OH峰高有所改变,主要是由于改变了体系反应物浓度,导致反应进程改变,因此在2 min时间段检测到的自由基含量有所变化,但·OH峰高的变化趋势与图3保持一致,依然是先升高后降低,其中在pH=1~2之间峰高达到最大值。
为能直观地观察·OH峰高随酸度的变化,进而分析酸度对Pt催化N2H4分解反应的影响,以·OH相对峰高为纵坐标,反应体系酸度为横坐标绘制曲线,结果示于图5。
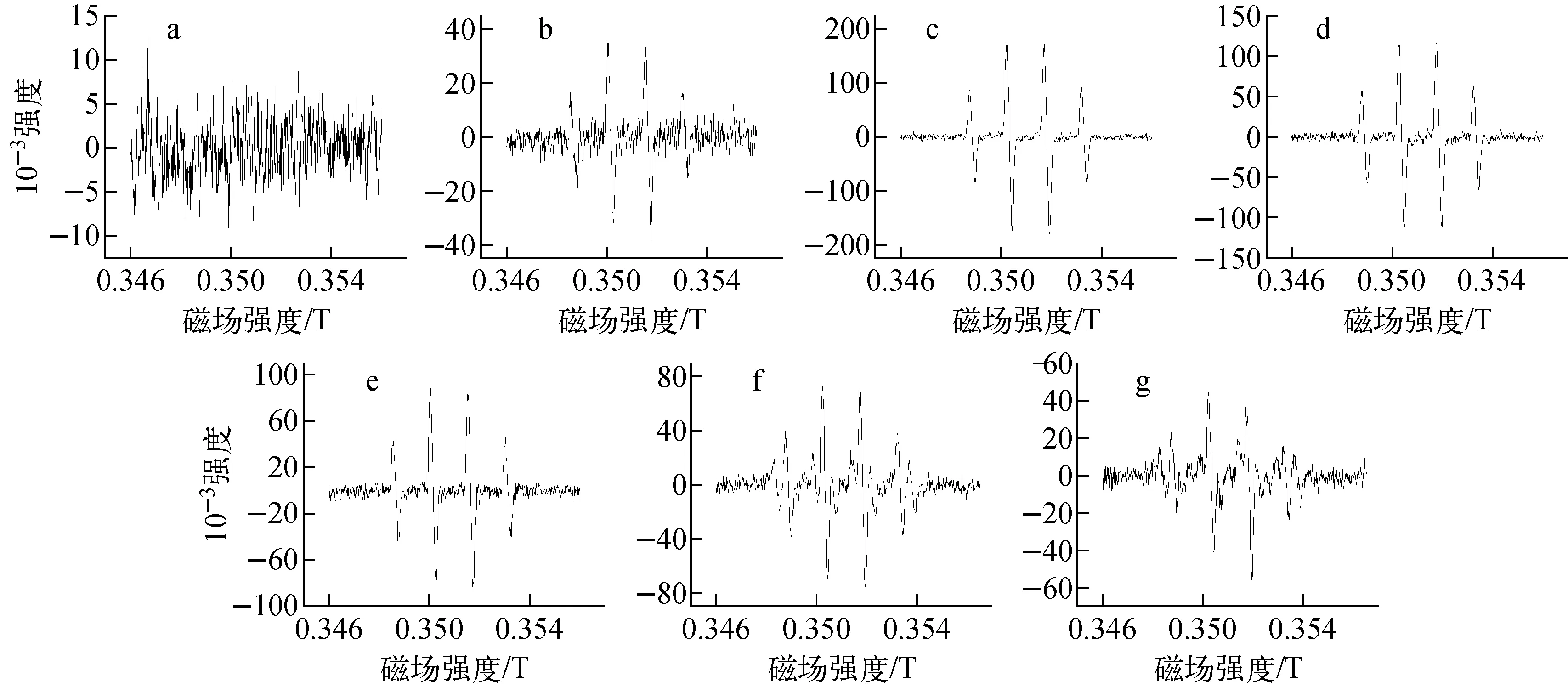
酸度:a——3 mol/L;b——1 mol/L;c——pH=1;d——pH=2;e——pH=3;f——pH=5;g——pH=7图4 初始N2H4浓度为0.5 mol/L时酸度对N2H4断键的影响

图5 ·OH峰高随酸度的变化
由图5可明显看到实验产生的·OH峰高随pH值的变化趋势,进而体现了2 min内N2H4分解反应的反应速率随酸度的变化。此结果说明,在高氯酸介质下,酸度对N2H4分解会产生影响,Pt催化N2H4分解反应的反应速率在酸度逐渐降低的过程中表现为先增大后减小的趋势,其中分解反应在pH=1~2之间进行得最为迅速。
4 影响机理分析
4.1 ·NH2向·OH转化机理
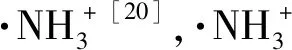
(5)
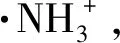

(6)
(7)
(8)
(9)
4.2 酸度对N2H4断键的影响机制
在高氯酸体系下随着酸度的增加,N2H4断键产生的次级自由基·OH的量呈现先增加后降低的趋势,·OH产生的量最大出现在pH=1~2之间,说明在pH=1~2时N2H4出现N—N断键最为剧烈,分析其影响机制如下。
N2H4在Pt表面的断键反应过程为:
(10)
(11)

(12)

(13)
(14)
(15)
氢离子浓度低至一定程度,将会导致反应体系电荷量较少,从而使电荷可移动性降低。另外由于氢离子处于反应物中,浓度过低将导致反应速度过慢。

5 结论
1) 在酸性条件下,Pt催化N2H4分解产生的次级自由基·OH是由N2H4断键产生的·NH2的次级产物,而不是由DMPO自捕捉或DMPO捕捉·H而异化产生的。
2) 酸度会影响Pt催化N2H4的分解过程,且在酸性条件下,随着酸度的降低,N2H4分解反应的反应速率呈先增加后减小的趋势,其中反应在pH=1~2之间最为迅速。
3) 活性位点的电荷转移对分解反应的发生速率影响较大,可考虑使用双金属或多金属复合材料增加催化剂的电荷转移和提供能力,以提高反应发生速率。
——酸度

