复合微生物菌剂对鲫鱼生长及消化功能的影响
陈总会,赵长臣,江小燕,孙承文,黄志斌,巩华
(中国水产科学研究院珠江水产研究所,广东 广州 510380)
随着人们生活水平的不断提升,人们对食品的安全性及营养价值的要求也日益提高。而随着人们健康意识的不断提升,水产品在人民群众的膳食结构中占据的比例也越来越高。因此,人们对水产养殖行业就提出了更高的要求。目前水产养殖业已趋向集约化、高密度、高产出的养殖模式,这同时也导致水产养殖废弃物增加,对环境污染日益严重。微生物菌剂是由多种环境友好型微生物复配而成的混合微生物菌剂。微生物菌剂由于其无毒性、无污染、强大的繁殖能力和废弃物利用能力逐渐在水产养殖行业得到广泛利用。但目前市场上水产微生物菌剂种类繁多,如何充分保证微生物菌剂的安全性和有效性及提高水产品营养价值,是当前开发微生物菌剂的关注热点[1]。
目前,在水产养殖方面有不少关于复合微生物制剂改善水质、改善生态微环境及提高水产动物生长的报道[2-5],但对水产养殖动物体内的本身的作用机制研究相对较少。倪寿文等[6]报道微生物制剂作为饲料添加剂喂养不同的鱼类可以显著提高其生长特性,并提高相关消化酶的活性。
该文对市场上购买的1种水产微生物菌剂进行菌群种类和数量鉴定,采用选择性培养基可以鉴定微生物菌群的种类,采用微生物菌落计数器可以对微生物菌剂中的微生物数量进行简便、快速、高效地计数。然后将该微生物菌剂作为饲料添加剂投喂鲫鱼,并测量投喂后鲫鱼的体质量及肠道淀粉酶和脂肪酶活力,通过该论文对市售微生物菌剂的鉴定及其对鲫鱼生长特性的促进作用分析可以为水产养殖微生物菌剂的安全性和有效性提供可靠的技术支撑,从而促进水产行业的发展。
1 材料与方法
1.1 微生物制剂产品
市售微生物菌剂M(粉剂),主要包含芽孢杆菌、光合细菌、酵母菌、硝化细菌、反硝化细菌、乳酸菌和放线菌。
1.2 选择性计数培养基
酵母菌培养基霉菌培养基、放线菌培养基、乳酸菌培养基、光合细菌培养基、芽孢杆菌培养基、硝化细菌培养基和反硝化培养基配方采用文献中的配方[3,7-10]。培养基于 121 ℃高压灭菌 20 min,用于不同细菌的选择性培养。
1.3 试验鱼
试验在广东省韶关市水产研究所养殖基地进行,养殖池面积约1 000 m2,水深约2.0 m,试验用鱼为该养殖基地的健康鲫鱼苗,平均体质量为(123.6±10)g。
1.4 分组及饲养管理
购买的复合微生物菌剂代替麦麸作为饲料添加剂投喂鲫鱼,基础饲料(鲫鱼颗粒饲料)为对照,复合微生物菌剂先溶解,再添加1%复合微生物菌剂混悬液为试验组。试验组对照组各设置3个平行,每组随机投放1 000尾鲫鱼苗。制备好复合微生物菌剂后,1 h 后投喂鲫鱼,每天 8:00、17:00 各投饲料1次,共30 d。
1.5 鲫鱼生长性能指标测定
试验结束前停食12 h,每组随机取鱼8尾,分别测量体质量、体长,然后断脊处死,置于冰箱-20℃冷冻备用。
1.6 鲫鱼肠道淀粉酶活性测定
淀粉酶活性的测定采用DNS还原糖法[11]。在冰浴中分离鲫鱼的肠道和肝脏,匀浆,得到匀浆液即为粗酶液。取粗酶液1 mL,加新鲜配制的2%淀粉溶液4 mL,于37℃糖化30 min,取出后立即于沸水中15 min,完全失活淀粉酶,得到糖化液。取糖化液1mL,加1 mL DNS显色剂在沸水中煮沸显色5 min,加蒸馏水稀释10倍摇匀,于波长520 nm下测吸光度,同时以1 mL已煮沸失活的粗酶液作空白对照。1个单位(U)淀粉酶活性为pH值7.0、37℃保温30 min条件下,1 g组织中的淀粉酶能完全水解10 mg淀粉时的酶量[3,11]。
1.7 鲫鱼肠道脂肪酶活性测定
测定时取出样品,用剪刀剪碎鱼体后,在冰浴中获得鲫鱼的肝脏和肠道,用研钵迅速研磨成匀浆,加2倍体积预冷蒸馏水制成粗酶液,于12 h内测定匀浆液酶活性。采用聚乙烯醇橄榄油乳化液水解法测定脂肪酶活性[11]。取5 mL 0.025 M pH值7.5的磷酸缓冲液和2 mL聚乙烯醇橄榄油乳化液于锥形瓶中,30℃水浴预热5 min,然后加入匀浆粗酶液0.5 mL,30 min后,立即加入95%乙醇终止酶反应。加1%酚酞指示剂3滴,用0.05 moL/L氢氧化钠标准液滴定脂肪酸含量。在上述条件下,将1 g组织中的脂肪酶催化脂肪水解产生1 μmoL脂肪酸的酶量定为一个酶活性单位(U)。
1.8 数据分析
应用单因素方差分析处理试验数据,并用t检验法对数据平均数进行多重比较。
2 结果与分析
2.1 复合微生物制剂中菌落种类和数量分析
将复合微生物菌剂稀释后用不同的选择培养基进行培养,然后采用全自动菌落计数仪(HiCC-B2,杭州万深检测科技有限公司)对复合幑生物菌剂的不同微生物进行菌落计数,结果如表1所示。制剂主要由酵母菌、放线菌、乳酸菌、芽孢杆菌、光合细菌和硝化细菌组成,其中益生菌乳酸菌和芽孢杆菌含量最多,测得菌剂的种类和数量与包装袋标识基本一致,证明所购买的复合微生物菌剂M质量较好,符合试验标准。

表1 复合微生物菌剂中的菌落种类和数量
2.2 对鲫鱼生长指标的影响
试验前,鲫鱼的平均体质量为(101.2±2.1)g,体长为(16.5±1.1)cm。经40 d的复合微生物菌剂M的投喂试验,对照组鲫鱼的平均体质量为(115.7±2.3)g,体长为(18.20±3.2)cm,体质量增加 14.38%(P<0.01),与对照组相比,实验组鲫鱼体长增加10.3%(P<0.01)(表2)。可见,试验组鱼的各项生产性能指标高于对照组,证实了微生物菌剂M作为饲料添加剂投喂鲫鱼能显著提升鲫鱼的生长性能。

表2 复合微生物菌剂对鲫鱼生长的影响(n=10)
2.3 对鲫鱼肠道淀粉酶活性的影响
选取试验组和对照组鲫鱼,分离获得其肠道组织,采用DNS法测定其淀粉酶活性。结果表明,经过微生物菌剂M的投喂,试验组鲫鱼肠道淀粉酶活性相对于对照组显著提升(P<0.01)。投喂前鲫鱼肝脏淀粉酶活性为(105.5±5.5)U,肠道淀粉酶活性为(112.3±8.6)U;对照组鲫鱼肝脏淀粉酶活性为(186.6±10.2)U,肠道淀粉酶活性为(213.5±16.8)U;试验组鲫鱼肝脏淀粉酶活性为(726±20.6)U,肠道淀粉酶活性为(763.3±15.2)U;微生物菌剂M的投喂能使鲫鱼肝脏和肠道淀粉酶的活性相比对照组提升 290.32%,258.2%(P<0.01)(图 1)。
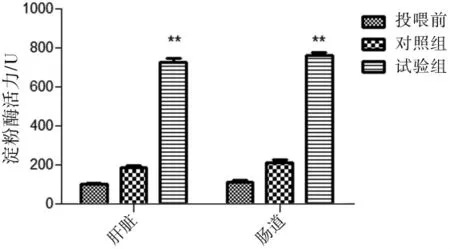
图1 复合微生物制剂对淀粉酶活力的影响
2.4 对鲫鱼肝脏和肠道脂肪酶活性的影响
结果表明,经过微生物菌剂M的投喂,试验组鲫鱼肠道脂肪酶活性相对于对照组显著提升(P<0.01)。投喂前鲫鱼肠道脂肪酶活性为(30±3.6)U,肝脏脂肪酶活性为(28.2±2.1)U;对照组鲫鱼肠道脂肪酶活性为(38±4.5)U,肝脏脂肪酶活性为(46.2±4.8)U;试验组鲫鱼肠道淀粉酶活性为(45±2.8)U,试验组鲫鱼肝脏脂肪酶活性为(59.5±6.5)U。说明微生物菌剂M的投喂能使鲫鱼肠道和肝脏脂肪酶的活性相比对照组分别提升18.4% 和28.3%(P<0.01)(图2)。
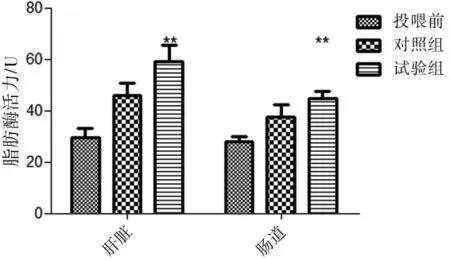
图2 复合微生物制剂对肝脏和肠道脂肪酶活性的影响
3 讨论
复合微生物制剂M中含大量的益生菌以及多种维生素及多种微量元素、辅酶Q等[3]。光合细菌能充分利用光能,转化至可利用的能量,再转移至鲫鱼鱼体内,促进鲫鱼的生长[12]。硝化细菌能充分利用水体中的各种废料,减少污染的同时并充分利用能量。酵母能产生丰富的蛋白酶,为鲫鱼提供丰富的能量并提高其对蛋白质的消化能力。芽孢杆菌和乳酸菌作为益生菌,被鲫鱼服食后能有效改善肠道微环境,提高鲫鱼免疫力并减少有害细菌的产生。放线菌可以产生丰富的次级代谢产物,从而为鲫鱼提供丰富的维生素等小分子营养物质,并可以产生抗生素以减少有害菌体的滋生。复合微生物制剂作为饲料添加剂被鱼类摄食后,其所包含的多种微生物可进入消化系统,并在消化道内繁衍、代谢,产生动物生长所必需的营养物质,从而促进鱼类的快速生长[13-15]。
据报道,微生物制剂作为饲料添加剂可以促进消化道分解酶活性提高,促进了鱼类对饲料的消化吸收和鱼类生长[6,13]。该试验组鲫鱼的肝胰脏和肠道淀粉酶、脂肪酶活性均比对照组显著提高(P<0.01)。推测酵母和芽孢杆菌可以产生丰富的淀粉酶、蛋白酶和脂肪酶,从而将饲料降解成为更容易吸收的葡萄糖和氨基酸等。而且这些淀粉酶、蛋白酶和脂肪酶能进入鲫鱼体内,促进鲫鱼的消化能力和营养吸收能力,促进鲫鱼的生长。
研究表明,淀粉酶主要是由在肝脏中产生,并且在肠道中被进一步激活[19]。该试验的结果也表明鲫鱼肠道中的淀粉酶活性要高于肝脏。而微生物菌剂产生的淀粉酶和脂肪酶进入鲫鱼体内,能提高鲫鱼淀粉酶和脂肪酶的活力。而乳酸杆菌和芽孢杆菌能提高鲫鱼的免疫力,提高身体机能,促进鲫鱼的肝脏和肠道产生更多的淀粉酶和脂肪酶,从而进一步提高其淀粉酶和脂肪酶活力,提高鲫鱼的体质量和体长。

