利福平对附子急性毒性物质诱导降解的研究△
陈彦旭,周坤,范丽玮,韩冰毓,陈洛晖,唐志豪,向秋玲
中山大学 中山医学院,广东 广州 510080
附子是毛茛科乌头属植物乌头AconitumcarmichaeliiDebx.的子根的加工品。主产于四川、湖北、湖南等地。它是中药中“回阳救逆第一品”,属温里药,具有回阳救逆、补火助阳、散寒止痛的功效[1],可治疗阴盛格阳,用于一切沉寒痼冷之疾。但附子目前临床应用存在的主要问题是具有毒性。附子中含有的乌头类生物碱,包括乌头碱、新乌头碱和次乌头碱等,是乌头类有毒中药的药效成分,同时也是毒性成分[2]。通过加热[3]、配伍甘草人参、生姜[4-6]等中药材炮制附子的方法,虽然可以显著降低附子的药毒性,但其安全范围仍然很窄[7],加之个体耐受程度不同,进一步限制了附子在临床上的用途。相关研究报道,附子可引起多个系统症状,以心血管系统症状尤为突出,常表现为多种类型的心律失常重叠或交替出现[8-9]。其心肌毒性还可以导致膜通透性增高,心肌细胞内乳酸脱氢酶同工酶(lactate dehydrogenase isoenzyme,LDH1)外漏,心肌细胞水肿[10]。因此附子的减毒方法及毒性机制的研究已经成为研究人员关注的焦点。近年来许多学者运用现代技术对附子的减毒方法及毒性作用的机制进行了研究,主要从配伍后药效学改变、化学成分变化等方面进行。本课题组试图通过改变药代动力学的方式探索一种新的减轻附子毒性的方法,为中医临床使用附子时提供拓宽其安全范围的新途径。已有研究显示乌头碱类主要通过肝药酶CYP3A4/5、CYP2D6[11]代谢后排出,本研究拟在此基础上选取利福平作为肝药酶诱导剂,通过比较小鼠单独给予生附片与不同剂量的利福平诱导后再给予生附片的急性毒性实验结果,通过心电图、LDH1、心脏病理切片等指标,明确肝药酶诱导剂对生附片毒性的保护影响,探讨CYP450在生附片毒性表现过程中的作用。
1 材料
1.1 动物
昆明鼠50只,雌雄各半,体质量(25±5)g,由中山大学实验动物中心提供,动物合格证号:SYXK(粤)2017-0081。常温常湿,自由饮水,适应性饲养3 d后随机分为5组,每组10只:对照组(Control),生附片组(Model),生附片+利福平低剂量组(RFP-L,90 mg·kg-1),生附片+利福平中剂量组(RFP-M,120 mg·kg-1),生附片+利福平高剂量组(RFP-H,150 mg·kg-1)。
1.2 仪器
BL-420生物机能实验系统(四川省成都泰盟科技有限公司);乳酸脱氢酶同工酶(LDH1)试剂盒(南京建成生物工程研究所);SC-02离心机(安徽中佳科学仪器有限公司);紫外分光光度仪(上海元析仪器有限公司)。
1.3 药物
生附片(产地为四川江油)购于广州同仁堂药店,经中山大学附属第一医院中医科莫穗林主任医师鉴定为乌头AconitumcarmichaeliiDebx.的子根的加工品。利福平(浙江医药股份有限公司新昌制药厂,批号:H33020235)购于中山大学附属第一医院。
2 方法
2.1 动物分组给药与实验操作
按照文献报道[4],取生附片加入8倍剂量蒸馏水浸泡5 h,煮沸后加热提取30 min,过滤得到第一次滤液;过滤物再次加6倍量蒸馏水,煮沸后加热提取30 min,再次过滤得到滤液;合并两次滤液,70 ℃浓缩至足够质量浓度后经计算定量稀释至3.3 g·mL-1。取450 mg利福平溶于37.5 mL蒸馏水制成溶液。实验前所有小鼠禁食不禁水8 h,利福平低、中、高剂量组(RFP-L、RFP-M、RFP-H)分别用不同质量浓度利福平溶液灌胃。4 h后生附片组(Model)和利福平低、中、高剂量组分别用生附片提取液(按照55 g·kg-1)灌胃。对照组给予等量蒸馏水灌胃。于灌胃1 h后将小鼠仰位固定于木板,连接已预热的心电图电极(II导联),用BL-420生物机能实验系统持续监测1 h并记录原始心电图数据。完成记录心电图后眼眶取血,用脊椎脱臼法处死小鼠,立即取心脏于固定液中浸泡备用。
2.2 心电图分析
从BL-420生物机能实验系统持续记录的1 h心电图数据中,由BL420系统自动统计各组记录的1 h区间内的平均心率。从每只小鼠的心电图中随机截取10段时长1 min的图像,在截取的心电图中识别并标记每一个PR间期、P波、QRS波群,并由BL420系统自动记录并统计各自时限,得到对应的均值与标准差。观察并计数10段心电图数据中房室传导阻滞以及T波高耸的病理性波段出现的频次,结合预实验,确定每只小鼠异常心电出现频次,≥10次则记录为病理性心电异常阳性。
2.3 LDH1酶活性测定
LDH1活性采用酶分析法测定。小鼠眼眶取血后室温静置1 h,5000 r·min-1离心10 min。离心后将上清液吸出,分装备用。取24 μL双蒸水,向其中加入800 μL试剂1,混匀后37 ℃孵育3 min,加入200 μL试剂2,混匀后37 ℃孵育2 min,用UV-5200型紫外可见分光光度计在340 nm波长检测吸光度,按LDH1试剂盒说明书上的公式计算LDH1活力。
2.4 组织病理切片分析
取小鼠心脏组织放入甲醛溶液中固定,乙醇脱水,石蜡包埋后切片,切片厚约5 μm,每个标本各切3片,脱蜡、二甲苯透明,进行苏木精-伊红(HE)常规染色,光镜下观察心肌组织病理学变化。按Rezkalla1的方法计算心肌病理组织学积分1[12],即每张切片随机取5个高倍视野,计算每个视野中炎性细胞浸润及坏死区域面积与整个视野心肌切片面积之比:无明显病变计0分;病变面积<25%,计1分;病变面积25%~50%,计2分;病变面积51%~75%,计3分;病变面积>75%,计4分。
2.5 统计学分析

3 结果
3.1 利福平诱导减少生附片引起的心律失常
小鼠心电图变化如图1所示。图1A为小鼠正常心电图,可见P波规律出现,PR间期恒定,QRS宽度恒定。图1B为二度房室传导阻滞,窦性心律,PR间期恒定,P波未见异常,每隔数个心动周期出现正常P波后无QRS波群。图1C可见窦性心律,PR间期恒定,P波后QRS波群规律出现,QRS波群与T波分界不清,T波高尖明显,部分心动周期ST段呈上斜型表现,提示发生心肌缺血。对照组PR间期(0.037±0.011)s,P波时间(0.017 5±0.035 0)s,QRS波群时限(0.027 5± 0.012 5)s,心率平均为514次/min。与对照组相比,生附片组小鼠出现心动过速,平均心率达到738次/min;同时可见多处二度房室传导阻滞及T波高耸心电图改变。而在加入不同质量浓度的利福平后,小鼠的心电图均发生了不同程度的改善。随着利福平质量浓度的提高,利福平低剂量组、利福平中剂量组、利福平高剂量组的小鼠相比附子组房室传导阻滞发生率分别下降20%、40%、60%,T波高耸发生率分别下降12.5%、25%、50%,结果和生附片组比较差异有统计学意义(见表1);心率分别下降8.6%、17%、17.1%,结果和生附片组比较差异有统计学意义(见图2);提示利福平诱导可改善附子引起的心律失常。

注:A.小鼠正常心电图;B.二度房室传导阻滞;C.T波高耸。图1 小鼠心电图变化
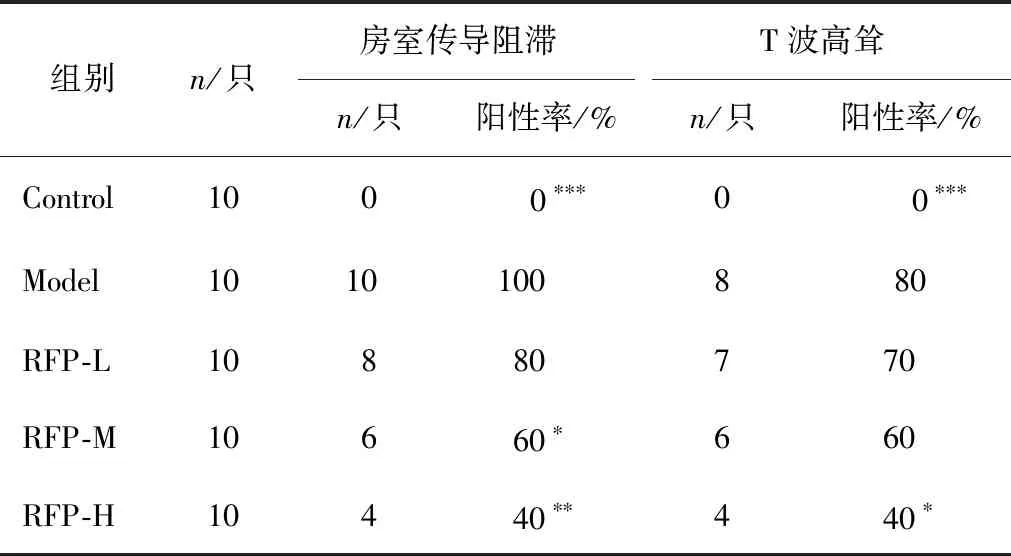
表1 不同质量浓度利福平对附子致小鼠异常心电发生的影响
注:与Model组比较,*P<0.05,**P<0.01,***P<0.001。

注:与Model组比较,*P<0.05,**P<0.01,***P<0.001;下同。图2 不同质量浓度利福平对附子致小鼠心动过速的影响
3.2 利福平抑制附子损伤心肌引起的血清LDH1活力升高。
当心肌受到损伤时LDH1可释放到血清中,其活性可反映出心肌损伤程度。如图3所示,生附片组LDH1活性为(817.4±104.5)U·L-1,较对照组(32.14±12.64)U·L-1显著升高。而预先使用低、中、高剂量利福平诱导组酶活性分别下降了71.54%、78.73%、86.01%,与生附片组比较差异均有统计学意义(P<0.05),提示利福平诱导可降低血清中LDH1酶活性,且具有剂量依赖性。

图3 不同质量浓度利福平含药血清对附子致LDH1释放的影响
3.3 利福平改善附子引起的心肌组织损伤
对照组心肌纤维排列规则,心肌细胞形态正常;模型组心肌细胞液化性坏死,细胞内出现空泡及空泡融合,肌原纤维和细胞器广泛溶解消失,细胞呈空鞘状;RFP-L组心肌损伤有所改善,视野内仅见局部因缺血而呈波浪状变形,病变心肌纤维变细;RFP-M组心肌波浪状变形区域减小;RFP-H组心肌几无病理改变。与对照组相比,其他各组病理积分有不同程度的升高。病理评分均值:附子组>低剂量利福平组>中剂量利福平组>高剂量利福平组>清水组(见图4)。评分病理图片见图5所示。运用方差分析显示:生附片组与对照组相比,病理积分明显升高,且差异有统计学意义;高、中、低剂量利福平组较附子组而言病理积分均值下降,且差异具有统计学意义。附子组模型建立成功,利福平灌胃能降低附子造成的心肌病理改变,且随利福平剂量增大心肌病理改变越明显。

图4 不同质量浓度利福平对附子致小鼠心脏组织病理评分的影响
4 讨论
本研究发现加用不同质量浓度的利福平可以减少附子诱导的心肌毒性作用,包括附子引起的心电图异常(心动过速、房室传导阻滞和心肌缺血)[13-15],心肌损伤(血清心肌酶活力增高和心肌组织病理积分增高)。利福平不同质量浓度实验组的结果显示毒性作用减轻水平与利福平不同质量浓度存在正相关,表明利福平作为肝药酶诱导剂可以显著减轻附子的急性毒性,并且存在显著的剂量依赖性。
与对照组小鼠心电图相比,生附片组小鼠出现心动过速与心律失常。乌头碱是附子引起心律失常的物质之一,其心脏毒性主要机制是通过兴奋延髓的迷走神经中枢节后纤维释放大量乙酰胆碱,引起心肌细胞膜钾离子通道通透性增加,钾离子外流增多,第四期自动除极化速度减慢,导致窦房结自律性下降。除窦房结外,房室结的功能也受到抑制,其他部位异位起搏点节律相对增强,从而产生房室传导阻滞与逸搏,生附片组与3个实验组中均可见典型的房室传导阻滞,但发生的频率有显著差异。此外,附子也可以使心肌细胞动作电位时程(APD)延长,增强细胞膜钠电流[16],增强心室肌内向整流钾电流、L型钙离子电流,抑制瞬时外向钾电流,易引起折返冲动[17]以及房性早搏、房性心动过速、心房颤动等多种类型的心律失常。当心室内异位起搏点兴奋性增加[18],可导致室性心动过速、室颤等,但这部分类型的心律失常在本次实验中表现不明显。

注:图A、B、C、D依次记为0分、1分、2分与3分,其中红色箭头为心肌细胞胞浆空泡变性和肌原纤维溶解,蓝色箭头可见扩张血管周围心肌间质浸润的炎细胞。图5 利福平对小鼠心脏组织形态学的影响(×100)
LDH能催化丙酮酸的氧化转化为乳酸,常被用作炎症标记物。它存在于几乎所有组织的细胞质中,在细胞损伤后从细胞中释放出来,因此血清中的LDH浓度反映了细胞膜通透性增高程度。可以用于监测细胞和组织损伤。而LDH1亚型主要存在于心肌组织中,因此血清中LDH1酶活性反映了心肌组织损害程度。在本实验中,小鼠血清中LDH1值随利福平剂量增加而减少,体现小鼠心肌细胞损伤减轻;组织切片病理评分亦随之下降,也佐证了这一点。
为了实现进一步临床应用上的推广还需要解决几个问题:一是利福平对附子急性毒性的缓解作用存在剂量依赖性,但目前的实验尚未确定其是否存在最佳效应浓度,加之利福平本身具有一定的肝毒性,所以临床应用时的用量规范亟需进一步探究与测试。二是选取的昆明鼠构建附子心脏毒性的病理模型存在一定的局限性,临床上在人体内用药的探究应选用更加多元化的指标,更多的样本数据进行评估分析才能进一步得到成熟的结论作为该用药方式推广的依据。三是我们对于慢性毒性的认识仍需要更进一步的探究。
综上所述,利福平作为肝药酶诱导剂可以显著减轻附子的急性毒性,并且存在显著的剂量依赖性,但短时间内无法扭转附子造成的急性损伤。本实验结论为临床附子减毒提供了一个新的思路与理论数据参考,将促进附子的临床应用安全范围扩大。当然这也只是初步的探究,虽然应用于临床尚待进一步的研究,但这方面的实际效益展望良好,将对附子在中医的临床应用提供实验参考。

