内皮祖细胞条件培养基对间充质干细胞向内皮细胞分化的影响
韩欢欢,郭黎姣,杨雄峰,周青,姜慧娇,王小艺,陈雪玲,吴向未*
(1石河子大学医学院第一附属医院,新疆 石河子 832008;2 石河子大学医学院, 新疆 石河子 832002)
近些年,对动脉粥样硬化的研究已经取得了一系列的进展,但其发病率与致残率仍较高,动脉粥样硬化及其并发症仍对人类健康造成极大威胁[1],并且动脉粥样硬化性血管疾病是心梗、中风、心绞痛和心源性猝死的根本原因[2]。目前认为动脉内皮细胞出现功能障碍是动脉粥样硬化病变的第一步,许多心血管疾病发生的危险因素,如高血压、糖尿病、高脂血症、吸烟、性激素不平衡等都可以造成内皮细胞功能发生障碍[3-4]。因此,探索有效措施促进有益的血管内皮细胞再生是动脉粥样硬化防治的关键。
内皮细胞(ECs)是血管壁的主要成分之一,越来越多的证据表明ECs治疗能促进新生脉管系统的形成,但自体的ECs治疗难以获得足够量的细胞,因此限制了其临床应用[5]。内皮祖细胞(endothelialprogenitorcells,EPCs)是一类公认的具有分化为成熟内皮细胞和通过旁分泌作用产生促血管生成能力的细胞群[6]。但EPCs含量少,增殖能力低,无法满足临床的需求。因此,寻求合适的种子细胞成为亟待解决的问题。
间充质干细胞(mesenchymal stem cells,MSCs)具有多向分化潜能,具有分化成多种不同成熟细胞类型的能力,包括脂肪细胞,软骨细胞,骨细胞,内皮细胞,心肌细胞和平滑肌细胞[7]。MSCs在机体内分布广泛,易于分离培养,在体外容易培养得到治疗所需要的细胞数目;此外,MSCs具备低免疫原性的特点,在相同种属之间引起免疫排斥反应的几率低[8]。因此,MSCs是一种可作为内皮细胞来源的合适的种子细胞。本实验组前期实验已证明EPCs-CM可促进MSCs的增殖和成骨分化[9]。本实验旨在利用EPCs-CM诱导培养MSCs,探讨EPCs-CM对MSCs向内皮细胞分化及体外成管的影响,为MSCs分化为血管组织工程的种子细胞提供实验依据。
1 材料与方法
1.1 材料
5周龄左右健康清洁型C57B/L6小鼠,雌雄均可,购于新疆医科大学实验动物中心,(动物合格证号为SCXK(新)2011-0003),于光照良好、温度及湿度适宜的环境下饲养。实验试剂:抗小鼠CD31抗体(美国Abcam);大鼠抗小鼠CD34抗体(美国Abcam);FITC标记山羊抗兔二抗、PE标记山羊抗大鼠二抗(北京中杉金桥);Trizol(美国Invitrogen);逆转录试剂盒(美国Thermo Fisher Scientific);基因引物使用Primer5.0软件合成,合成于上海生工生物工程公司,CD31上游引物为:5’-CCAACAGAGCCAGCAGTATG-3’,下游引物为:5’-TGACCACTCCAATGACAACC-3’;vWF上游引物为:5’-TGCCTCAGTGGGAGAAAGAT-3’,下游引物为:5’-CAGGTTTGTGCTCTGCTTGA-3’,eNOS上游引物为:5'-CATCACCTACGACACCCTCA-3',下游引物为:5'-CGGCTCTGTAACTTCCTTGG-3';β-actin上游引物为:5'-TTCCTTCTTGGGTATGGAAT-3',下游引物为:5'-GAGCAATGATCTTGATCTTC-3';荧光染料(SYBR GreenⅠ)(德国QIAGEN公司)。
1.2 方法
MSCs、EPCs的分离培养方法参照本课题组前期实验方法[9-10]。本实验主要选取3代MSCs和7-14 d的早期EPCs作为实验细胞。
1.3 流式细胞术检测MSCs和EPCs的表面标记物
分别取第3代MSCs和第12天左右的EPCs,胰蛋白酶消化后,PBS重悬后细胞密度为1×106/mL,每管100 μL,分别加入直接荧光标记MSCs抗小鼠Sca-1-FITC、CD34-FITC、CD11b-PE和直接荧光标记EPCs抗小鼠CD34-FITC、CD133-PE、VEGFR2-APC。常温避光孵育30 min后PBS洗涤,流式细胞术检测MSCs和EPCs的表面标记物表达。
1.4 EPCs的功能鉴定
(1)双荧光染色鉴定EPCs 取12 d左右EPCs,消化计数后,以1×104个细胞密度接种到24孔板中的盖玻片上,12 h后用20μg/mL的Dil-AC-LDL置于37 ℃避光孵育4 h,PBS清洗后用4%多聚甲醛固定10 min,PBS清洗3次,加入10μg/mL的FITC-UEA-1,避光孵育1 h,PBS洗3次后置于荧光显微镜下观察;(2)EPCs体外成管 基质胶在4 ℃冰箱内过夜,48孔板的每孔加入100 μL,置于37 ℃培养箱内30 min。取第12天左右EPCs消化计数后以每孔5×104个细胞接种于48孔板,倒置显微镜下观察管腔结构形成情况。
1.5 EPCs-CM的制备
取第7~第14天的早期EPCs,以1×106个细胞密度接种于60 mm培养皿中,12 h后换为每皿2.0 mL无血清、生长因子的EGM-2,培养24 h,收集上清,离心(3000 r/min,10 min)后取上清液,加入10%FBS制成EPCs-CM。重复制备至实验需要量。使用0.22 μm滤膜过滤后贮存于-80 ℃冰箱中。
1.6 EPCs-CM对MSCs向内皮细胞分化的影响
取第3代MSCs消化、计数后,以1×105/孔接种于6孔板中,将MSCs分为对照组(采用LG-DMEM培养)和实验组(25%EPCs-CM组和50%EPCs-CM组),每组各设2个复孔。
1.6.1 qRT-PCR检测各组细胞在不同时间点CD31、vWF、eNOS mRNA表达
分别在培养1、2、3周时收集上述各组MSCs,使用TRIzol裂解细胞获得总RNA,按照第一链cDNA合成试剂盒说明反转录为cDNA,进行实时PCR分析,PCR反应条件:95 ℃变性15 s、52 ℃退火延伸30 s,共40个循环。2- ΔΔCt法计算目的基因mRNA相对表达量。
1.6.2 MSCs体外成管实验
在第3周取对照组(采用LG-DMEM培养)与实验组(采用50%EPCs-CM组)MSCs,胰蛋白酶消化后,对照组和实验组分别用LG-DMEM和EPCs-CM重悬细胞,以1×104个/孔接种于预先铺有250 μL基质胶的24孔板,每组各设2个复孔。12 h后倒置显微镜观察小管形成情况并拍照。
1.6.3 免疫荧光实验检测各组MSCs CD31、CD34表达
将2×2 cm的无菌盖玻片放置在12孔板中,在第3周取对照组(采用LG-DMEM培养)与实验组(采50%EPCs-CM组)MSCs消化计数后,分别以2×104个/孔接种到盖玻片上,培养箱中培养24 h后,依次进行固定、封闭,加入均为1∶100稀释的CD31抗体 和CD34抗体,4 ℃孵育过夜后,次日避光操作下滴加二抗工作液,37 ℃孵育1 h,甘油封片后拍照。
1.6.4 NO含量测定
收集上述对照组和实验组3周时细胞上清液,离心(3000 r/min,20 min)后获取上清液,采用NO检测试剂盒测定各组分泌的NO含量。
1.7 统计学分析
2 结果
2.1 MSCs和EPCs的形态学
MSCs多于48 h内开始贴壁,首次换液时见贴壁细胞形态及大小不均一,可见多边形、长梭形及小圆形细胞;隔日液后可见细长梭形细胞数量增加,并可见集落形成。7 d左右后能达90%左右融合,消化传代后,2周左右基本贴壁铺展,细胞形态逐步趋于均一的细长梭形;48 h首次换液时取细胞悬液离心,沉淀重悬后,接种于包被过鼠尾胶原的60 mm培养皿中,继续培养72 h后首次换液,可见周边梭形细胞围绕中央圆形细胞放射性生长的集落,周边梭形细胞增殖速度较快,7 d时细胞可达到80%~90%融合,12 d左右可见少量类圆形细胞,长梭形细胞增殖速度明显下降,类圆形细胞增殖速度增加,长梭形细胞逐渐减少,3周左右可见大量类圆形细胞形成的集落,呈“铺路石”状(图1)。
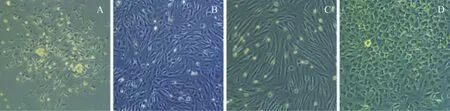
A:MSCs 原代第48 h,多边形细胞为主;B:MSCs第3代第2天,细胞呈细长梭形细胞为主; C:EPCs原代第7天,长梭形细胞为主;D:EPCs第3代第3天,细胞呈“铺路石”状图1 倒置光学显微镜下细胞形态学的变化(×100)Fig.1 Morphological characteristics of MSCs and EPCs (×100)
2.1.1 MSCs和EPCs的表面标记物表达
Sca-1广泛存在于干细胞表面,第3代MSCs 表达阳性率为93%; CD34、CD11b均低表达,阳性率分别为18.2%、31.9%。EPCs均高表达VEGFR2、CD34、CD133,分别为91.8%、67.4%,98.9% (图2)。
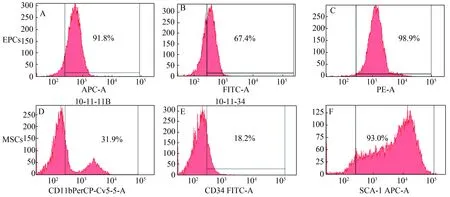
A:VEGFR2; B:CD34: C:CD133; E:CD11b; F:CD34图2 EPCs 和MSCs的表面标记物阳性率流式检测结果Fig.2 Cellular surface antigens on EPCs and MSCs detected by FCM
2.1.2 EPCs的功能鉴定
(1)双荧光染色鉴定EPCs EPCs可以吞噬Dil标记的乙酰化低密度脂蛋白(Dil-AC-LDL)而呈红色荧光,并可以结合凝集素(UEA-1)而呈绿色(图3)。(2)EPCs体外成管第12天左右的早期EPCs体外可形成管腔样结构,镜下观察,4~6 h后细胞变形拉长,可见较多细胞形成突起,6~9 h细胞突起进一步伸长,首尾相接,形成管腔样结构,10~12 h达到顶峰(图4)。
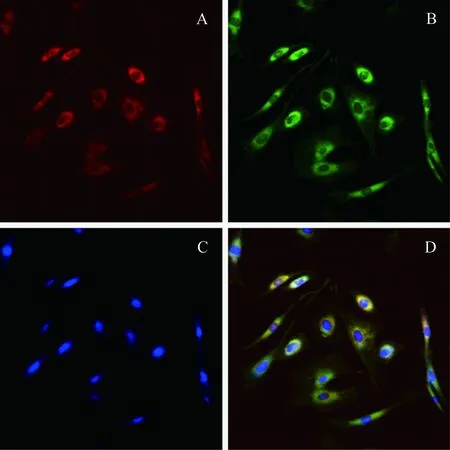
A:Dil-AC-LDL; B: FITC-UEA-1; C:DAPI; D:Merge图3 EPCs的双标记染色Fig.3 Double marker staining of EPCs
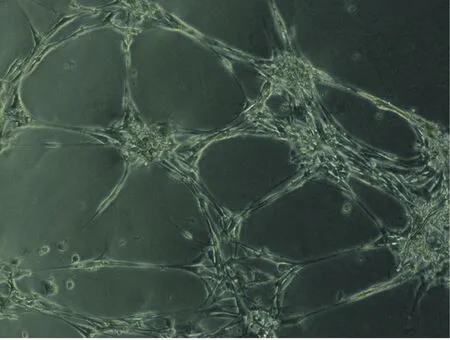
图4 EPCs形成管腔样结构(×100)Fig.4 EPCs form a lumen-like structure (×100)
2.2 不同时间点各组MSCs CD31、vWF、eNOS的mRNA表达
qRT-PCR结果(图5)显示:1周时CD31、vWF、eNOS的mRNA表达在25%EPCs-CM组(1.05±0.17;1.06±0.95);3.87±0.90),在50%EPCs-CM组(1.64±0.27;1.04±0.87;3.85±0.64);2周时分别在25%EPCs-CM组(1.02±0.14;1.34±0.95;1.64±0.24),在50%EPCs-CM组(2.18±0.99;1.82±0.26;1.72±0.22);3周时分别在25%EPCs-CM组(1.45±0.81;1.47±0.92;3.79±0.85),在50%EPCs-CM组(2.28±0.25;1.76±0.71;8.27±1.65)。2周、3周时CD31、vWF、eNOS的mRNA表达在50%EPCs-CM组较对照组升高显著(P<0.05)。

图5 各组细胞CD31、vWF、eNOS的mRNA相对表达量Fig.5 Relative mRNA expression levels of CD31, vWF and eNOS in each group
2.3 EPCs对MSCs体外成管能力的影响
EPCs-CM体外培养MSCs 12 h后可见较多MSCs发出突起,细胞之间突起相互连接且连接完整,可见较多单层细胞相连形成的管腔样结构。(图6B)。对照组大多数MSCs呈长梭形、多角形,仅少数细胞形成突起,细胞与细胞之间突起不连接或连接不完整,较少细胞形成不完整的管腔样结构(图6A)。
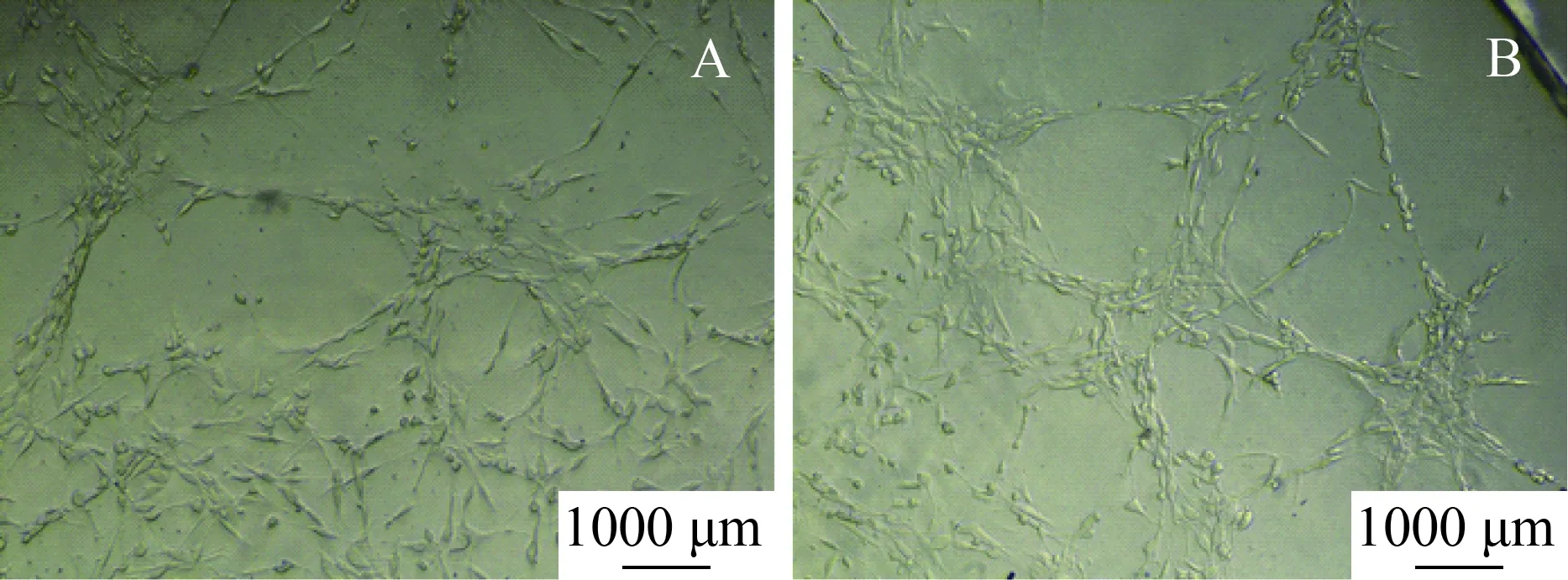
图6 对照组和实验组体外成管Fig.6 In vitro tube formation in the control and experimental groups
2.4 EPCs-CM促进MSCs CD31、CD34表达
实验组与对照组MSCs CD31和CD34表达量均较低;相比之下,实验组MSCs CD31和CD34的表达明显高于对照组(图7)。
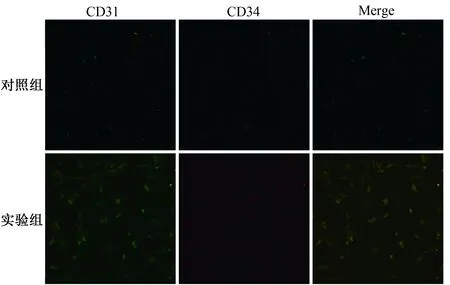
图7 各组细胞CD31、CD34的表达Fig.7 Expression of CD31 and CD34 in each group
2.5 EPCs-CM可促进MSCs分泌NO
EPCs-CM可促进MSCs分泌NO结果见图8。
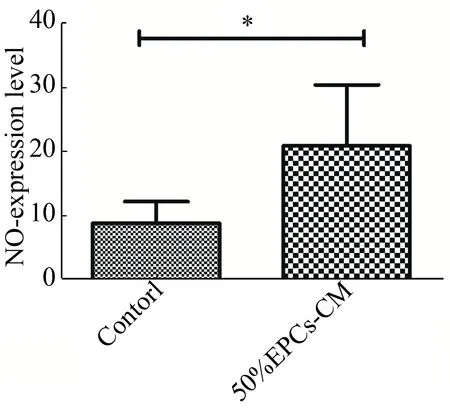
图8 各组NO分泌量Fig.8 NO secretion of each group
由图8可知,在第3周时采用NO检测试剂盒对对照组与实验组中细胞上清液进行测定,结果显示对照组细胞培养上清液中NO的含量为(8.81+3.41) μmol/L,实验组细胞培养上清液中NO的含量为(20.93±9.47) μmol/L,较对照组升高,差异显著(t=3.96,P<0.05)。
3 讨论
在不同类型的干细胞中, MSCs作为再生医学的有力候选者,并且用于再生医学细胞分化的研究。它代表了一种极具吸引力的移植细胞来源,MSCs来源广泛,可以从不同的组织中分离获取,除了能够分化成脂肪细胞,骨细胞,软骨细胞,内皮细胞和心肌细胞的能力外,MSCs还能够分化成其他的细胞谱系,如神经元和肝细胞[11-13]。从1968年Friedenstein[14]等首先证实MSCs在骨髓组织中的存在以来,它的分化潜能越来越受到学者的关注。
MSCs用于治疗缺血性疾病、体外血管组织工程等方面是当前的研究热点之一。Wang等[15]利用含10 ng/mL ECGF,10 ng/mL VEGF,1 ng/mL bFGF的DMEM诱导犬骨髓MSC分化为EPC和血管内皮细胞。李鹏等[16]研究发现,在体外低氧条件下高浓度(50 ng/mL)外源性VEGF可促进人脐带血来源的MSCs 分化为内皮样细胞。Wang等[17]发现利用含有含有50 ng/mL VEGF,10 ng/mL bFGF,20 ng/mL IGF, 5 ng/mL EGF的内皮诱导培养基培养时,MSCs可以有效地分化为ECs。辛毅等[18]研究表明经内皮细胞培养基(含VEGF 50 μg/L、bFGF 10 μg/L)诱导培养后的小鼠MSCs具有分化为ECs的潜能。由此可见,VEGF、bFGF等因子在体外MSCs向内皮细胞分化过程中具有重要作用,并提供了MSCs向内皮细胞分化的实验依据。
EPCs具有分化为成熟内皮细胞和旁分泌功能。在成人外周血中存在两种EPCs,早期和晚期EPCs。体外培养4~7 d后,出现的呈长梭形、集落样生长的为早期EPCs;培养2~3周后,逐渐出现的一些呈典型的鹅卵石样细胞,称为晚期EPCs[19]。早期和晚期EPCs在血管发生中作用不同,早期EPC主要通过旁分泌血管生成细胞因子促进新生血管形成[20],这些细胞因子有助于募集成熟内皮细胞并促进其增殖和存活,而晚期EPCs通过基于其高增殖能力提供足够数量的内皮细胞来增强新血管的生成。有学者实验发现早期EPCs的上清液中VEGF和IL-8的浓度显着高于晚期EPC[21]。本实验采用实验组前期提取EPCs条件培养基的方法,尝试利用EPCs条件培养基对MSCs进行诱导培养,探讨EPCs-CM是否可以促进MSCs向内皮细胞分化。
CD31、vWF广泛表达于成熟内皮细胞,是内皮细胞的特异性表面标志[22-23]。内皮型NOS(endothelial ni-tric oxide synthase,eNOS)主要存在于内皮细胞中。有学者研究发现eNOS存在于特定细胞(主要是内皮细胞)。内皮细胞中eNOS 表达量增加,可以促进NO的合成和释放[24]。本实验结果显示分别在1周、2周、3周时50%EPCs-CM组CD31mRNA表达量均较对照组显著升高,25%EPCs-CM在第3周时CD31mRNA表达量较对照组显著升高。50%EPCs-CM组vWF mRNA表达量在2周、3周时较对照组显著升高,25%EPCs-CM组在第3周时vWF mRNA表达量较对照组显著升高。25%EPCs-CM组与50%EPCs-CM组eNOS mRNA表达量在1周、2周、3周时均较对照组显著升高。这些结果表明,EPCs条件培养基可促进MSCs向内皮细胞分化,且具有浓度、时间依赖性。与25%EPCs-CM组相比,50%EPCs-CM组对MSCs的促进作用更明显。通常可以通过内皮细胞特异的表面标志物,如CD31和CD34来鉴定内皮细胞[25]。本实验利用50%EPCs-CM作为实验组与LG-DMEM作为对照组对3周后的各组细胞进行免疫荧光检测,细胞体外成管实验及对各组细胞上清中的NO含量进行测定。结果显示实验组与对照组CD31和CD34的荧光表达量均较低,与对照组相比,实验组荧光表达量明显增高。体外成管能力与内皮细胞的黏附、迁移等功能有关,涉及到体内血管新生的机制,本实验对各组细胞行体外成管实验证实,经EPCs-CM诱导后的MSCs具有内皮细胞体外成管能力。通过对各组细胞上清中的NO含量的测定结果表明,实验组细胞具有内皮细胞分泌NO的能力。
EPCs条件培养基中含有EPCs旁分泌的多种因子,本实验组前期已对EPCs条件培养基中VEGF、TGFβ1、PDGF、IGF-1、SDF-1、bFGF的含量进行了测定[26], EPCs-CM中因子含量较低,可促进MSCs向内皮细胞分化,而对诱导后的细胞增殖及存活,EPCs-CM中的因子含量可能无法满足,随着培养时间增长,细胞的状态可能会逐渐下降。EPCs-CM中因子种类繁多,除外已知的可促进MSCs分化为ECs的因子外,是否包含其他一种或多种因子可以促进或抑制MSCs向ECs分化,尚需要进一步探讨。
综上所述,EPCs条件培养基可促进MSCs向内皮细胞分化,内皮化的MSCs具有成熟内皮细胞体外成管能力,可以为血管内皮细胞提供新的来源,而其是否可以代替血管内皮细胞成为构建组织工程化血管种子细胞的主要来源,及是否可以进一步应用于临床缺血性疾病的治疗仍需要进一步研究。

