基因芯片与线性探针技术检测涂阳肺结核患者痰标本MTB耐药性的价值
刘元 周俊 崔晓利 雷佳媛 党丽云
耐药结核病尤其是耐多药结核病(MDR-TB)的出现,在许多国家已经成为重大的公共卫生问题和全球结核病有效控制的障碍。据WHO估计,2017年全球新发利福平耐药结核病(RR-TB)患者55.8万例,其中82%为MDR-TB,我国结核病患者对利福平的耐药率依然高居全球第二[1]。目前,MTB的表型药物敏感性试验(简称“药敏试验”)由于耗费时间长,操作复杂,已难以满足耐药结核病的诊疗需要,而分子生物学药敏试验方法以其简便、快速的优点已成为结核病快速诊断的重要手段[2]。基因芯片技术和线性探针技术(GenoType MTBDRplus)是两种比较常用的分子生物学药敏试验方法[3-4]。基因芯片技术可以检测耐药基因突变位点,避免检出与耐药无关位点突变而导致的假阴性[2];线性探针技术是WTO推荐的涂阳肺结核患者的耐药检测技术。两种方法检测耐药基因的覆盖位点各有不同。目前,虽然有文献分别就两种方法的检测效能进行了评价[3-4],但对两种方法的对比研究较少。笔者通过对454例涂阳肺结核患者痰标本的检测,分析两种方法的异同。
资料和方法
一、研究对象
选取西安市胸科医院2017年4月至2018年8月确诊并住院治疗的493例涂阳肺结核患者作为研究对象,其中,初治患者386例,复治患者107例。收集研究对象痰标本,痰标本量均不少于2 ml。每例患者用同一份痰标本分别进行基因芯片检测、线性探针检测和BACTEC MGIT 960液体培养(简称“MGIT 960液体培养”),同时对培养阳性且鉴定为MTB的临床分离株进行MGIT 960液体药敏试验。
二、试验方法
1.仪器与试剂:(1)仪器:PCR扩增仪、芯片杂交仪和微阵芯片扫描读片仪(北京博奥生物有限公司);GT-Blot 48杂交仪(法国生物梅里埃公司);MGIT 960液体培养系统(美国BD公司)。(2)试剂:晶芯结核分枝杆菌耐药基因检测试剂盒(北京博奥生物有限公司);GenoType MTBDRplus ver 1.0试剂盒(法国生物梅里埃公司);MGIT 960液体培养管及分枝杆菌药敏试验检测试剂盒(美国BD公司);MPT64快速抗原检测试剂(杭州创新生物检控技术有限公司)。
2.标本前处理:采用中和离心法去污染处理,涂阳痰标本采用N-乙酰-L-半胱氨酸(NALC)-NaOH消化液处理15 min,加磷酸盐缓冲液(PBS)至40 ml,在4 ℃下3000×g离心20 min,弃上清液,沉淀加入1.5 ml PBS振荡重悬。重悬后的痰标本各取0.5 ml分别进行MGIT 960液体培养、基因芯片检测和线性探针检测。
3.MGIT 960液体培养:参照《结核病诊断实验室检验规程》及MGIT 960液体培养操作手册进行标准化操作。取0.5 ml前处理后的痰标本加入MGIT 960培养管中,放入MGIT 960液体培养系统中培养。一旦MGIT 960培养管通过仪器报告呈阳性,使用痰涂片镜检确认阳性产物,并用MPT64快速抗原检测试剂确认阳性产物为MTB。
4. MGIT 960液体药敏试验:取MTB阳性产物0.5 ml接种到含药培养基上(利福平药物浓度1 μg/ml,异烟肼药物浓度0.1 μg/ml)。另取0.2 ml阳性产物用PBS稀释100倍后,取0.5 ml接种到生长对照管中,放入MGIT 960培养系统培养。当生长对照管中生长单位(growth unit,GU)指数达到400时(4~13 d内),评估含药培养管的GU值;含药培养管的GU值<100为敏感,含药培养管的GU值≥100为耐药。
5.基因芯片法耐药基因检测:应用核酸提取试剂盒提取研究对象痰标本中的MTB-DNA,进一步按照晶芯结核分枝杆菌耐药基因检测试剂盒的说明书进行PCR扩增、芯片杂交、洗涤、甩干及结果扫描。
6.线性探针法耐药基因检测:采用超声裂解法提取研究对象痰标本中的MTB-DNA。取5 μl提取后的DNA加入已准备好的45 μl扩增混合物,按照说明书的扩增程序进行扩增。扩增完成后取20 μl 扩增产物进行杂交,杂交过程包括化学变性、杂交孵育、洗涤、偶联和显色等。根据显色结果进行耐药情况的判读。判读标准:野生条带均显色且突变条带无显色时为敏感,野生条带有缺失或突变条带显色为耐药。
三、统计学分析
采用SPSS 17.0软件对数据进行统计学分析。以MGIT 960液体药敏试验结果为参照标准,分析基因芯片技术及线性探针技术检测涂阳肺结核患者痰标本MTB对利福平和异烟肼耐药性的效能,各项指标计算方法:敏感度=真阳性例数/(真阳性例数+假阴性例数)×100%;特异度=真阴性例数/(真阴性例数+假阳性例数)×100%;阳性预测值=真阳性例数/(真阳性例数+假阳性例数)×100%;阴性预测值=真阴性例数/(真阴性例数+假阴性例数)×100%;一致性检验采用Kappa检验,Kappa值≥0.75时认为两者一致性较好。
结 果
一、基本情况
493例研究对象痰标本经MGIT 960液体培养,阴性18例(3.7%)、污染6例(1.2%)、阳性469例(95.1%);培养阳性的469例研究对象,经鉴定5例(1.1%)为非结核分枝杆菌感染,464例研究对象完成了表型药敏试验。493例研究对象痰标本经基因芯片检测,469例具有药敏试验结果;经线性探针检测,472例具有药敏试验结果。共有454例研究对象同时具有表型药敏试验、基因芯片检测及线性探针检测结果。
二、MTB利福平耐药性检测结果分析
454例涂阳肺结核患者痰标本,经MGIT 960液体药敏试验检测利福平耐药73例,耐药率为16.1%。以MGIT 960液体药敏试验结果为参照标准,基因芯片法和线性探针法检测涂阳肺结核患者痰标本MTB利福平耐药性的敏感度、特异度、阳性预测值、阴性预测值、Kappa值见表1。Kappa检验显示,基因芯片法和线性探针法药敏检测与MGIT 960液体药敏试验均具有较好的一致性。
三、MTB异烟肼耐药性检测的结果分析
454例涂阳肺结核患者痰标本,经MGIT 960液体药敏试验检测异烟肼耐药116例,耐药率为25.6%。以MGIT 960液体药敏试验结果为参照标准,基因芯片法和线性探针法检测涂阳肺结核患者痰标本MTB异烟肼耐药性的敏感度、特异度、阳性预测值、阴性预测值、Kappa值见表2。Kappa检验显示,基因芯片法和线性探针法药敏检测与MGIT 960液体药敏试验均具有较好的一致性。
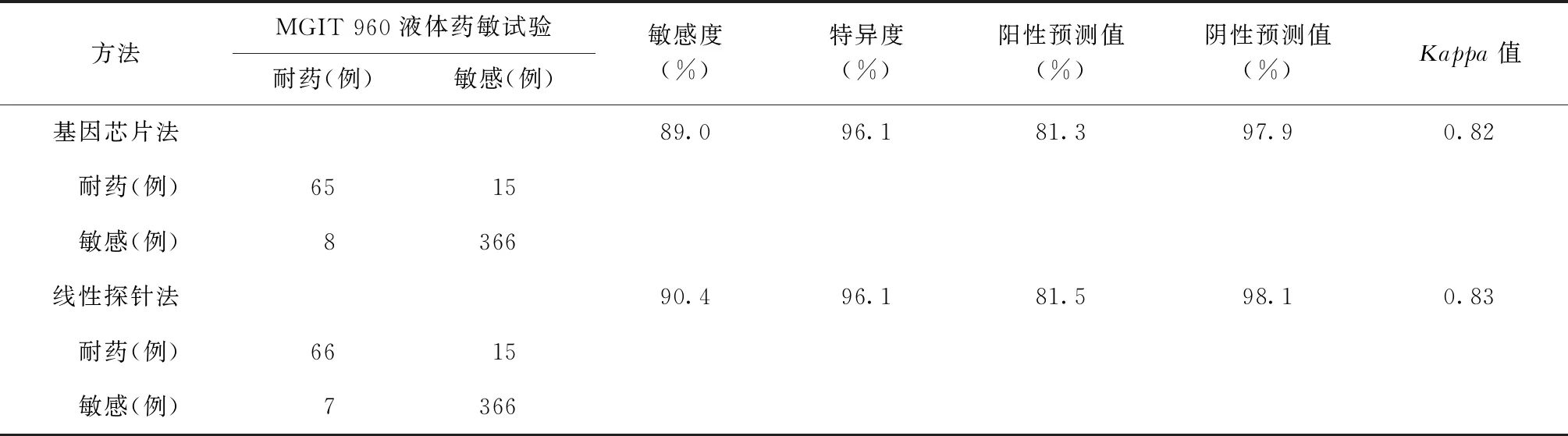
表1 两种分子生物学检测方法以MGIT 960液体药敏试验结果为参照检测涂阳肺结核患者 痰标本MTB利福平耐药性效能
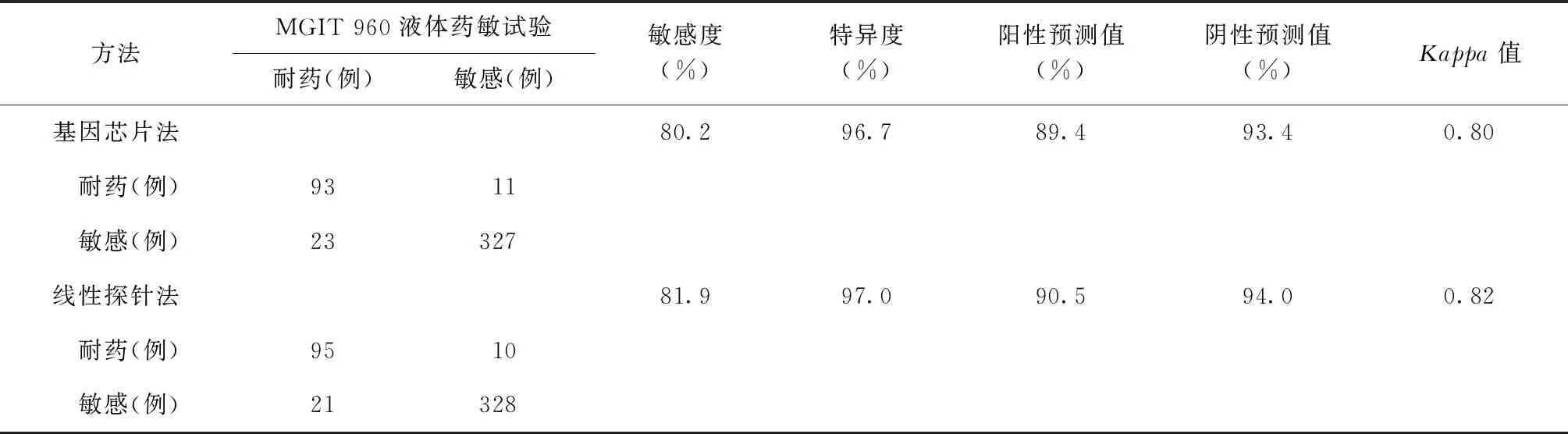
表2 两种分子生物学检测方法以MGIT 960液体药敏试验结果为参照检测涂阳肺结核患者 痰标本MTB异烟肼耐药性效能
四、两种分子生物学检测方法药敏试验结果比较
454例涂阳肺结核患者痰标本中,453例应用2种分子生物学检测方法检测MTB利福平耐药性结果相同,符合率为99.8%。1例线性探针检测为rpoB基因S531L突变,基因芯片检测为敏感。445例应用2种方法检测MTB异烟肼耐药性结果相同,符合率为98.0%。9例不一致结果中,5例线性探针检测为异烟肼耐药,分别是2例katG基因S315T2突变即315(AGC→ACA)突变,3例inhA基因-8(T→C)突变,而基因芯片检测结果均为敏感。4例基因芯片检测为异烟肼耐药,均为katG基因315(AGC→AAC)突变,线性探针检测结果均为敏感(如图1中所示的4、13、32、93号标本条带)。

图中右侧箭头从上至下所示分别为93、32、13、4号标本所对应的线性探针显色条带(此4份标本katG WT条带显色强度均弱于katG 条带)。图中上侧箭头及下侧箭头所示为本研究所关注的katG和katG WT基因显色条带。93、32、13、4号标本经基因芯片检测均为katG 315 (AGC→AAC)突变,而线性探针检测条带显示其katG WT 条带并未缺失(突变条带也未出现),却有不同程度的减弱,且katG WT条带显色强度均弱于katG 条带。这与katG基因真正的野生型条带明显不同,真正野生型katG WT条带显色强度均强于katG 条带图1 线性探针法检测MTB异烟肼耐药基因katG 315 (AGC→AAC)突变时的显色条带
讨 论
基因芯片和线性探针技术是两种能够快速检测MTB利福平和异烟肼耐药性的分子生物学检测方法,其最大优点是检测快速,均能在6 h内获得药敏结果。两种方法虽然都是通过检测rpoB基因、katG基因和inhA基因的突变来检测MTB利福平和异烟肼的耐药性,但其检测耐药基因的覆盖位点各有不同。例如:对于MTB利福平耐药性的检测,基因芯片技术仅检测了rpoB基因核心突变区的6个位点(531、526、516、511、533、513)的13种突变类型,而线性探针技术则通过8条分子探针覆盖了rpoB基因核心突变区的全部27个氨基酸的81个碱基。本次研究,笔者就两种方法检测结果的异同进行了对比分析。
本研究中,以MGIT 960液体药敏试验结果为参照标准,基因芯片检测涂阳肺结核患者痰标本中MTB利福平耐药的敏感度和特异度分别为89.0%和96.1%;线性探针检测的敏感度和特异度分别为90.4%和96.1%,与文献报道的结果基本一致[5-7]。两种方法检测结果有1例不同,线性探针法检测为rpoB基因S531L突变,基因芯片法检测为敏感,可能由操作误差所致。本次研究未发现rpoB基因6个常见突变位点以外的突变,表明基因芯片检测位点以外的突变相当稀少,与欧维正等[8]报道的基因芯片检测位点之外的位点突变仅为0.33%(9/2738)一致。与MGIT 960液体药敏试验结果相比,两种方法对MTB利福平耐药性的检测均具有较高的一致性(Kappa值>0.75),表明基因芯片和线性探针两种技术都能够胜任本地区MTB利福平耐药性的快速检测。
MTB对异烟肼的耐药机制较复杂。目前研究发现,至少有katG、inhA、ahpC、kasA、ndh等5种不同的基因突变与异烟肼的抗药性有关。据报导,katG315位点和inhA-15位点突变占异烟肼耐药突变的80%以上[9-10]。由于基因芯片和线性探针检测的分子载量有限,故两种方法都是通过检测katG基因和inhA基因突变实现对MTB异烟肼耐药性的预测。
本研究中,以MGIT 960液体药敏试验结果为参照标准,基因芯片检测涂阳肺结核患者痰标本中MTB异烟肼耐药性的敏感度和特异度分别为80.2%和96.7%;线性探针检测的敏感度和特异度分别为81.9%和97.0%。两种方法的检测效能相差不大,但两种方法检测结果仍有9例不同,这是由于两种检测方法覆盖的突变位点不同所致,如线性探针含有katG315(AGC→ACA)、inhA-16(T→G)、inhA-8(T→C)和inhA-8(T→A)突变类型,而基因芯片有katG315(AGC→AAC)突变类型,这些突变类型在文献[4]和[11]中均能看到,但突变频率均不高。
在本研究中,通过对基因芯片和线性探针检测结果的逐一对比分析,发现MTB在发生katG315(AGC→AAC)突变时,由于线性探针未涵盖该突变,其检测结果如图1中4、13、32、93号标本条带:野生型条带既未缺失,突变型条带也未出现,根据判读标准应判为敏感。但笔者发现在这种情况下,4例标本的显示条带都具有共同特征:“katGWT”条带会有不同程度的减弱,且“katGWT”条带的显色均弱于“katG”条带,这与真正野生型的条带是不同的。对比其他349条katG基因野生型的条带,发现 “katGWT”条带的显色均强于“katG”条带(图1中4、13、32、93号标本条带以外的条带),这与许多文献上展示的条带带型也是一致的[12-13]。分析发生katG315(AGC→AAC)突变时“katGWT”条带减弱的原因,可能是与异质性耐药有关。异质性耐药是一种客观存在的现象,即结核病患者体内通常敏感菌和耐药菌并存[2],在这种情况下,野生型细菌可以显色,而突变型细菌则不能显色,且由于不同患者突变菌所占的比例不同,所以 “katGWT”条带的显色强弱也不同,突变菌所占比例越高则“katGWT”条带显色越弱直至缺失。根据本研究的对比结果,在应用线性探针进行MTB异烟肼耐药基因检测时,如果出现“katGWT”条带显色弱于“katG”条带的情况,则该患者极有可能发生katG基因的突变,建议通过测序或其他方法确认。目前,二代线性探针在临床上已经有所应用,其和一代产品的最大差异是提高了检测临床标本中MTB的敏感度,可直接检测涂阴肺结核患者的耐药性。笔者提出的“如果出现‘katGWT’条带显色弱于‘katG’条带则极有可能具有katG突变”是否也适用于二代产品则还有待于进一步研究。
综上所述,基因芯片技术与线性探针技术检测涂阳肺结核患者痰标本中MTB利福平和异烟肼耐药性与MGIT 960液体药敏试验结果具有较高的一致性,由于两类检测方法各自有其优缺点,有条件的实验室可以选择进行联合检测。基因芯片技术和线性探针技术具有同等的检测效能,都可应用于本地区的结核耐药检测。由于两种分子生物学方法覆盖耐药基因的位点不同,故检测结果会有所差异。当线性探针的显色结果中“katGWT”条带的显色弱于“katG”条带时,该患者极有可能已经发生katG基因突变,建议再通过测序或其他方法确认。

