不同水分含量糙米动态储藏过程中叶黄素含量及色度值变化
顾佳缘,王 琰,杨 恒,胡慧敏,陈银基
(南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏南京 210023)
糙米为人们提供丰富的能量来源,同时也含有丰富的蛋白质、脂肪、维生素,还包括了少量的叶黄素等其他营养素。叶黄素属于类胡萝卜素的一种[1],具有紫罗酮环二羟基结构,为胡萝卜素的含氧衍生物。叶黄素常常与另外一种类胡萝卜素——玉米黄质共存,并与之互为同分异构体,化学式为C14H56O2[2]。叶黄素具有重要的生理功能,是眼部黄斑区有效的抗氧化剂[3-4],同时,可预防动脉硬化、白内障等[5]。尽管与大多数水果和蔬菜相比,糙米中类胡萝卜素含量低,但作为东亚、南亚、东南亚及中北非人们(部分人处于贫困线以下,营养摄入不均衡)的主食,每天主食的摄入量可能对消费者的营养状况产生一定的影响[6-7]。Kean[8]等人研究表明叶黄素是碾磨谷物组分中主要的类胡萝卜素,约占70%。在一些高叶黄素小麦品种中,叶黄素含量达5.4~7.4 μg/g。成熟收获后的糙米中含有游离的叶黄素和叶黄素酯,它们主要存在于胚芽和糊粉层中[9-11]。
随着消费者个性化需求越来越高,对富含类胡萝卜素等微量营养素的糙米(呈淡黄色或米黄色)营养更丰富的观念也逐渐接受。学者逐渐对研究糙米储藏过程中如何保持其更多营养素更加重视。糙米在粮食消费里,一般认为属于半成品,其储藏性能明显优于碾白后的大米,而且稻谷砻谷去壳后以糙米的形式储藏能有效提升粮食仓储能力,改善卫生状况,降低能源消耗,是未来稻谷储藏的优先和重点发展方向之一。另一方面,高水分糙米由于水分活度较高,在温湿条件适宜下易发生霉变、结块等现象,使粮食储备遭受巨大损失。研究显示每年在运输、储藏、加工等环节浪费的粮食占粮食总量的15%;而每年由于潮湿的气候,不能及时干燥而造成霉变、结露、发芽等损失的粮食至少在5%以上[12]。目前对糙米的储藏等相关研究主要集中在通过控制温度、湿度的静态储藏以及通过新手段提高糙米储藏性能等[13-14]。而糙米在储藏过程中易受光照、雨水及昼夜温湿差影响,粮堆实际温湿度波动很大,储藏过程中品质劣变也给后期精深加工带来严重影响。常规的研究往往采用静态储藏的方法,温度和湿度没有变化或变化相对单一,所测得的粮食质量数据与实际储运条件下粮食质量并不相符。而对糙米进行动态温湿度的实仓或模拟储运的分析研究鲜见报道。本实验基于温湿度条件的动态变化,研究比较储藏过程中糙米叶黄素含量和色度值变化规律,为糙米的合理储藏提供科学依据。
1 材料与方法
1.1 材料与仪器
稻谷(华梗5号,产地宿州) 砻谷机脱壳为糙米;叶黄素标准品(97%) 美国Sigma公司;2,6-二叔丁基-4-甲基苯酚(BHT) 上海阿拉丁生化科技股份有限公司;四氢呋喃(THF) 天津市致远化学试剂有限公司;甲醇(色谱纯) 天津市科密欧化学试剂有限公司;氢氧化钾 西陇科学股份有限公司。
Dionex Ultimate 3000高效液相色谱仪(配有光电二极管阵列检测器DAD) 戴安中国有限公司;高速万能粉碎机 天津市泰斯特仪器有限公司;超声波清洗机 宁波新芝生物科技股份有限公司;DKZ系列电热恒温振荡水槽 上海一恒科技有限公司;电子天平 赛多利斯科学仪器(北京)有限公司;N-1100D-WD型旋转蒸发仪 上海爱朗仪器有限公司;BLH-3250型实验砻谷机 浙江伯利恒仪器设备有限公司;PQX-300D型人工气候箱 宁波东南仪器有限公司;CM-5型色差仪 日本柯尼卡美能达公司;SFY-20A型快速水分测定仪 深圳市冠亚电子科技公司。
1.2 实验方法
1.2.1 实验分组与模拟储藏方法 本实验采取实验室模拟储藏,粮库选取三种类型:配置制冷空调的低温粮库(可控温控湿,对应本实验L组)、通风条件较好的普通粮库(对应本实验M组)、南方小型粮库(夏季高温高湿,对应本实验H组)。温湿度设定主要依据2016~2017年间测定的三个典型粮库第一年10月至第二年2月的各月份粮堆实际温度和湿度监测数据,取每月日间均值和夜间均值(如表1所示),将动静态温湿度数据输入三个智能人工气候箱。2017年秋新收获的稻谷,通过水分调节,分别获得初始含水量为15%、17%、19%和21%的稻谷,砻谷去壳后,快速水分测定仪实测糙米水分含量分别为14.4%、16.6%、18.7%、20.5%。糙米用PVC塑封袋包装,置于人工气候箱中进行模拟储藏,每30 d测定一次叶黄素含量和色度值。
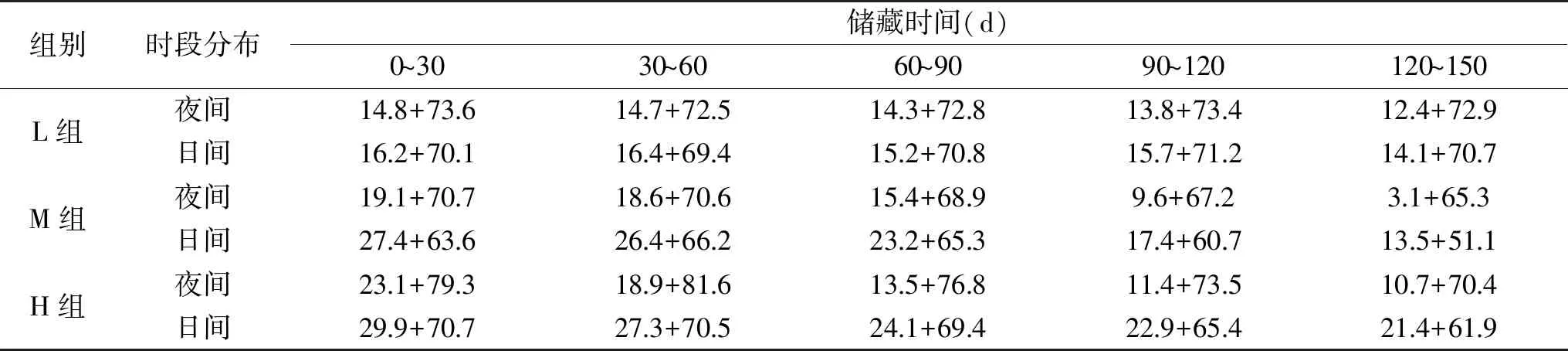
表1 动态储藏温湿度条件(℃+RH%)构建
1.2.2 叶黄素标准曲线的绘制 用电子天平精确称取叶黄素标准品5.0 mg置于50 mL棕色容量瓶中,用甲醇(色谱级)溶解并稀释至刻度,摇匀,配制成浓度为50 μg/mL的标准溶液,精密移取0.5、1、2、4、6、8、10 mL置于50 mL棕色容量瓶中,用甲醇稀释至刻度并摇匀,制得浓度分别为0.5、1、2、4、6、8、10 μg/mL的标准溶液,充氮备用,操作在昏暗条件下进行,每个系列浓度进样三次,按照上述色谱条件测定标准叶黄素的峰面积,以峰面积为纵坐标(y),质量浓度(μg/mL)为横坐标(x),绘制标准曲线。
1.2.3 糙米中叶黄素的提取及测定 叶黄素的提取:将糙米倒入粉碎机中碾磨成粉,过80目筛,精确称取1.0000 g,溶于15 mL四氢呋喃,加入0.2 g抗氧化剂BHT以及0.15 g/mL KOH-甲醇溶液10 mL,避光振荡2 h。过滤后的残渣重复提取一遍,合并两次上清液于50 mL离心管中。5000 r/min离心20 min,转移上清液至另一离心管中,重复上述离心操作一次,合并上清液,旋转蒸发仪上50 ℃蒸至近干,残留物溶于2 mL甲醇,过0.45 μm微孔滤膜备用。上述操作均在避光条件下进行[15]。
叶黄素的测定:采用色谱法。色谱条件:色谱柱YMC-C30(4.6 mm×250 mm,5 μm);检测波长:445 nm;柱温:35 ℃;流动相:甲醇∶水=95∶5,等梯度洗脱;流速:0.8 mL/min;进样量:20 μL。
1.2.4 表面颜色的测定 选取完全去壳,无黄变,霉变现象的糙米。测定时,将糙米均匀充分的填满在玻璃皿中,利用色差仪测定糙米色度的3个指标:L*、a*和b*值,每次测定重复三次。
1.3 数据处理
每次测定至少重复3次,各指标差异显著性分析采用单因素方差分析(One-way ANOVA),并采用LSD法进行多重比较,各指标相关性采用Person相关性分析,数据处理及统计分析采用SPSS 23.0软件进行,采用Graphpad Prism 7.0等软件进行处理及制图。
2 结果与分析
2.1 HPLC-DAD法构建叶黄素标准曲线图
根据色谱分析条件,绘制出叶黄素标准曲线图(见图1):Y=1.3484X-0.1749(R2=0.9995),叶黄素标准品浓度在0.5~10 μg/mL时与峰面积呈良好的线性关系。

图1 叶黄素标准曲线图
2.2 糙米中叶黄素含量变化分析
糙米在150 d的储藏,结果见图2。L组中,各水分含量的糙米在储藏30 d内变化较小,30 d后叶黄素缓慢下降。储藏期150 d结束后,L组中,水分含量为14.4%糙米的叶黄素平均剩余含量为1.54 μg/g,水分含量为16.6%糙米中叶黄素平均剩余含量为1.44 μg/g,水分含量为18.7%、20.5%的糙米中叶黄素平均剩余含量分别为1.40、1.36 μg/g。相比之下,M组中,水分含量为14.4%、16.6%、18.7%、20.5%的糙米在储藏150 d后,叶黄素平均剩余含量分别为1.43、1.39、1.33、1.30 μg/g。在H组,糙米在储藏前120 d叶黄素含量下降较快,120 d后下降较缓慢,其中水分含量为18.7%、20.5%的糙米中叶黄素含量下降较快。储藏期结束后,水分含量为14.4%、16.6%、18.7%、20.5%的糙米中叶黄素平均剩余含量分别为1.40、1.37、1.27、1.25 μg/g。可以看出,在相同储藏条件下,糙米中叶黄素含量随水分含量的增加而缓慢下降。在相同储藏周期内,L组、M组、H组中温度越高,糙米中叶黄素的流失越严重。采用SPSS对各因素进行显著性分析,结果见表3。结果显示,分水含量对糙米中叶黄素含量影响极显著(p<0.01),储藏温度对糙米中叶黄素含量影响极显著(p<0.01),储藏温度和水分含量的交互作用对糙米中叶黄素含量影响极显著(p<0.01)。可得结论,在储藏过程中,应尽量保持糙米中水分含量低于15%,同时控制在低温下储藏,可减少糙米中叶黄素的流失。

表3 糙米储藏过程中各指标相关性

图2 不同水分糙米在储藏过程中叶黄素含量变化
不同的储藏温度会对糙米的外观、风味、营养成分产生不良的影响。本实验中,由于糙米没有外壳的保护作用,暴露于空气中,易受到水分、温度及霉菌的影响[16],随着储藏时间的增加,L组、M组和H组糙米中叶黄素的含量均出现缓慢下降,且储藏温度越高,叶黄素含量下降速度越快。Mattera[17]通过研究证实,储藏中的高温机制会导致游离叶黄素含量的降低。采后贮藏过程中,游离的叶黄素会部分转化为叶黄素酯,从而导致糙米中叶黄素含量的下降[18]。叶黄素酯在储藏过程中并不会表现出明显的变异,它比游离的叶黄素稳定。Ahmad[19]和Mellado[20]也通过实验证实温度对谷物中叶黄素酯化有影响。此外,也有学者报道含有叶黄素的小麦制品在经过热处理或者在长时间的储藏后,叶黄素中原先占主导地位的反式异构体会部分转变成顺时异构体,如13-顺式叶黄素、13′-顺式叶黄素、9-顺式叶黄素、9′-顺式叶黄素[21-22]。
不同的水分含量会影响储藏中糙米的叶黄素含量。储藏期结束后,由于缺乏稻壳的保护[23],四组水分梯度的糙米中叶黄素含量均出现了流失。在同一储藏温度下,水分含量越高,糙米中叶黄素的流失越多。原因可能是较高的水分含量适合微生物生长,易引起附着在表面及内部的霉菌快速生长繁殖[24],另一方面,水分含量高,会加强糙米本身的呼吸作用,从而消耗糙米中的营养成分[25-26]。在模拟高温高湿的H组,糙米中叶黄素含量出现了明显的下降,且下降速度快于L组和M组,国外有学者报道这是由于类胡萝卜的降解与温度、氧含量、水分含量有关,在温度与水分含量的作用下,氧化反应和酶及非酶作用会促进降解酶与色素的接触,引起贮藏和加工中叶黄素等类胡萝卜素的损失,同时带来品质的劣化[27]。
2.3 糙米表面颜色变化分析
不同水分含量的糙米表面颜色在动态温湿度条件储藏过程中的变化情况见表2。在整个储藏周期中,L组、M组和H组中糙米的色度L*值均逐渐减小,表明糙米的表面颜色逐渐变暗。在L组中,水分含量为14.4%、16.6%、18.7%、20.5%的糙米L*值比储藏前分别减少了0.06、0.08、0.63、1.15。相比之下,M组的L*值分别下降了0.10、0.14、0.60、1.21,H组的L*值分别下降了0.16、0.25、0.63、1.22,即同一储藏条件下,水分含量越高,ΔL*变化越大,温度对L*值影响显著(p<0.05),初始水分含量对L*值影响极显著(p<0.01)。在储藏期内,糙米表面a*值缓慢上升,L组的a*值比储藏前分别增加了0.03、0.04、0.24、0.49。相比之下,M组的a*值分别增加了0.13、0.15、0.45、0.68,H组的a*值分别增加了0.18、0.25、0.63、1.22,温度对a*值影响显著(p<0.05),初始水分含量对a*值影响极显著(p<0.01)。随着储藏时间的增加,糙米表面的b*值逐渐增加,L组的b*值比储藏前分别增加了0.56、0.60、0.61、0.66,M组的b*值分别增加了0.60、0.68、0.72、0.74,H组的b*值分别增加了0.64、0.75、0.86、1.39,温度对b*值影响极显著(p<0.01),初始水分含量对b*值影响显著(p<0.05)。

表2 不同水分含量条件下糙米色度值变化
动态温湿度储藏条件会对糙米的表面颜色产生不同的影响。在低水分(14.4%)条件下储藏,糙米的L*值下降较慢,偏高水分(18.7%、20.5%)组则出现了较大幅度的下降。在储藏期内,低水分组中糙米的a*、b*值增加较慢,偏高水分组则增加较快,这与前人研究结果一致[28-29]。相同水分含量的糙米,储藏温度越高,L*值下降越快,a*、b*值增加也越快。有研究认为水分含量越高、温度越高,糙米的呼吸作用越强,就越容易发生黄变。另一方面,糙米没有外壳保护,黄变现象表现的更加明显。在为期150 d的储藏期中,通过控制糙米在低水分(14.4%)条件下储藏,并合理控制储藏温度,可减缓糙米表面颜色的变化,从而减少黄变现象的发生。
2.4 糙米中各指标相关性分析
对储藏过程中各指标进行相关性分析,结果见表3。由表3可知,L*值与糙米中叶黄素含量极显著正相关(r=0.81,p<0.01),说明叶黄素含量降低,L*值下降,糙米表面颜色变暗。a*值与糙米中叶黄素含量极显著负相关(r=-0.74,p<0.01),说明叶黄素含量降低,a*值增加,糙米颜色变红。b*值与糙米中叶黄素含量极显著负相关(r=-0.92,p<0.01),说明叶黄素含量降低,b*值增加,糙米颜色变黄。糙米中叶黄素含量与储藏温度呈显著负相关(r=-0.30,p<0.05),说明储藏过程中,叶黄素含量随温度的上升而下降。
糙米在储藏过程中叶黄素含量缓慢下降,L*值缓慢下降,a*和b*值不断增加。Hayashi[30]通过研究红米贮藏过程中颜色变化,认为红米样品的颜色变化是由类胡萝卜素等色素氧化而不是生物诱导反应引起的。Oli[31]也认为一些黄色或红色的类胡萝卜素如叶黄素,玉米黄质等含量的变化,可能导致糙米表面颜色的变化。本研究通过对糙米中叶黄素含量与色度值L*、a*和b*值的相关性分析,也揭示了这样的规律。
3 结论
本研究探讨动态温湿度储藏条件下糙米中叶黄素含量及色度值的变化规律。结果表明,糙米中叶黄素含量随储藏温度的上升而下降。在模拟高温的H组,糙米中叶黄素含量出现了大幅度的流失,而在模拟低温的L组中,叶黄素含量损失较少。相同储藏条件下,糙米中叶黄素含量随水分含量的上升而缓慢下降。水分含量越高,糙米中叶黄素含量下降越快,尤其是在模拟高温的H组中。储藏过程中,L*值随储藏时间的增加而下降,a*,b*值随储藏时间的增加而呈上升趋势。在为期150 d的储藏期中,通过控制糙米在低水分条件(14.4%)下储藏,不宜采用偏高水分(18.7%、20.5%),可有效减缓叶黄素含量的流失。

