木犀草素对高血脂症SD大鼠肝脏脂肪变性及抗氧化水平的影响
孙霁寒,王兆丹,孙桂菊,*,彭 景
(1.扬州大学食品科学与工程学院,江苏扬州 225001;2.东南大学公共卫生学院营养与食品卫生系,江苏南京 210009)
高脂血症(hyperlipidemia,HLP)是指脂代谢异常导致血浆总胆固醇、低密度脂蛋白胆固醇及甘油三酯中一种或多种超过正常范围的病症。脂肪性肝病(fatty liver disease,FLD),是指肝细胞中脂肪堆积导致脂肪变性,引起肝脏代谢的异常,通常分为酒精性脂肪肝(alcoholic fatty liver disease,AFLD)和非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)。HLP可诱导肝脂肪变性,其中重度变性产生的高脂性脂肪肝(hyperlipidemic fatty liver,HFL)属于NAFLD[1]。目前主要认为NAFLD发病机制与氧化应激损伤、胰岛素抵抗有关,氧化应激损伤可认为是NAFLD的重要环节[2]。
目前常见的治疗HFL、FLD的药物有他汀类、贝丁酸类、烟酸类、树脂类和抗氧化剂,而他汀类作为临床降血脂药物,常用来联合治疗脂肪肝合并高脂血症[3],多项研究已表明,辛伐他汀能显著降低胆固醇,具有良好降血脂作用、服用简便、不良反应低等优点[4-5]。
木犀草素(luteolin)作为食源性黄酮类化合物,广泛存在于各种食用植物和传统药用植物中[6]。研究表明,木犀草素具有广泛的生物活性,在心血管疾病[7]、肥胖[8]、治疗癌症[9-11]等方面正获得越来越多的关注。周丽嫦等[12]研究表明,木犀草素可显著抑制体重、血脂、血糖及胰岛素水平的升高;马宝慧等[13]研究表明,木犀草素的降脂作用可能与HDL的升高、LDL的降低和减少机体NO的产生有关,提示木犀草素具有一定的降血脂作用。前期实验表明,木犀草素中剂量(50 mg/kg)对SD高脂血症大鼠有显著降血脂和急性酒精性肝损伤保护作用[14-15]。
目前,关于木犀草素的研究主要停留在降血脂作用及其可能的机制,对肝脂肪变性以及抗氧化水平影响的研究较少,为此本研究通过病理切片以及对大鼠血脂和抗氧化指标的检测,探讨木犀草素对高脂血症SD大鼠肝脏脂肪变性及抗氧化水平的影响,并旨在为今后研究开发木犀草素药理保健功能提供科学依据。
1 材料与方法
1.1 材料与仪器
40只清洁级雄性SD大鼠 体质量(200±9) g,购自南京医科大学实验动物中心;羧甲基纤维素钠(CMC)、木犀草素纯品 南京泽朗医药公司;辛伐他汀 天津怀仁制药有限公司;马斯亮蓝蛋白测定试剂盒、胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)测定试剂盒 南京建成生物工程研究所;低脂饲料D12450B、高脂饲料D12492 协同生物有限公司。
RT-6000酶标分析仪 美国雷杜公司;Centrifuge 5424R高速冷冻离心机 德国Eppendorf公司;Spectrumlab755s紫外可见分光光度计 上海棱光技术有限公司;DK-S26水浴锅 上海精宏实验设备有限公司;BS224S电子天平 赛多利斯科学仪器有限公司;Milli-Q Advantage超纯水系统 南京汉隆实验器材有限公司;TYXH-II涡旋混合器 天悦电子。
1.2 实验方法
1.2.1 动物模型的建立与分组 40只雄性SD大鼠适应性喂养一周后随机分为正常组10只和模型组30只。正常组喂养基础饲料D12450B,模型组喂养高脂饲料D12492。4周后禁食8 h,称重并断尾取血,测定血清TC、TG、HDL-C、LDL-C,若TG、TC与正常组有显著差异(p<0.05),则造模成功。将模型组再随机均分为模型对照组、木犀草素组、辛伐他汀组。称取5 g CMC加入1 L蒸馏水配成0.5%的CMC溶液,称取木犀草素和辛伐他汀溶解于0.5%CMC溶液中配成灌胃溶液使其浓度都为10 mg/mL,干预期间正常组和模型对照组每天灌胃0.5%的CMC溶液(10 mL/kg),木犀草素组每天灌胃5 mL/kg 木犀草素溶液,辛伐他汀组每天灌胃1 mL/kg辛伐他汀溶液,各组动物自由摄食饮水,干预6周后处死。
1.2.2 体质量、肝湿重等一般性指标的测定 干预期于每周一晨间称重,干预结束后称体质量并处死后取出肝脏称重,计算肝系数。
肝系数(%)=肝湿重/体质量×100
1.2.3 血脂四项(TC、TG、HDL-C、LDL-C含量)的测定 干预结束后处死,股动脉取血,3000 r/min离心10 min取上层血清,按试剂盒说明采用COD-PAP酶法和GPO-PAP酶法,取2.5 μL血清样本,同时取等量蒸馏水和校准品作为空白对照和标准对照,均加入250 μL工作液后37 ℃孵育10 min,波长510 nm处酶标仪测定血清中TC、TG、HDL-C、LDL-C含量。
1.2.4 肝脏抗氧化指标的测定 制备成10%的肝组织匀浆,按试剂盒说明采用考马斯亮蓝法测肝匀浆蛋白浓度;采用TBA法测丙二醛(MDA)含量;采用比色法测谷胱甘肽过氧化物酶(GSH-Px)含量;采用可见光法测过氧化氢酶(CAT)含量;将肝组织匀浆稀释至1%,按试剂盒说明采用羟胺法测超氧化物歧化酶(SOD)含量。
1.2.5 病理学检查 取约3~5 mm2大小的肝组织,用10%福尔马林溶液固定48 h,将组织切成0.2~0.5 cm的薄片,经梯度酒精脱水二甲苯透明后,浸蜡包埋,将蜡块切成约5 μm的切片,之后脱蜡洗净,HE染色后脱水透明并进行封固,光学显微镜下100倍放大率观察肝脏组织脂肪变性情况,采用Image-Pro Plus 6.0软件观察肝脏脂肪变性程度,根据病变范围可分为6级[16]:0分(基本正常),1分(病变<5%),2分(病变5%~29%),3分(病变30%~49%),4分(病变50%~75%),5分(病变>75%)。
1.3 统计分析
采用Excel和SPSS 16.0处理分析数据,结果以均数(标准差来表示。
2 结果与分析
2.1 模型建立
4周后鼠尾采血测血脂四项,由表1可知,与正常组相比,模型组血脂四项均显著高于正常组(p<0.05),可认为高脂血症SD大鼠造模成功,可进行进一步的干预实验。

表1 造模4周后模型组和正常组血脂四项的比较
2.2 木犀草素对高血脂症SD大鼠体重、肝质量及肝系数的影响
脏器指数变化可以较好地判断化学毒物对内脏器官的损伤情况,脏器指数增加表示脏器有充血、水肿、增生及肥大等变化,下降表示脏器萎缩、生长受阻或退行性变化[17],因此采用体重、肝湿重和肝系数等一般性指标表观评价大鼠肝脏的变化。由图1各组大鼠的体重变化曲线可见,各组大鼠的体重均呈一定的上升趋势,第4周开始,模型对照组的体重增长速度明显快于其他组,表示随着干预时间的延长,后期与模型对照组的增重速度相比,木犀草素能降低高脂血症大鼠的增重速度,与辛伐他汀阳性药物组相一致。
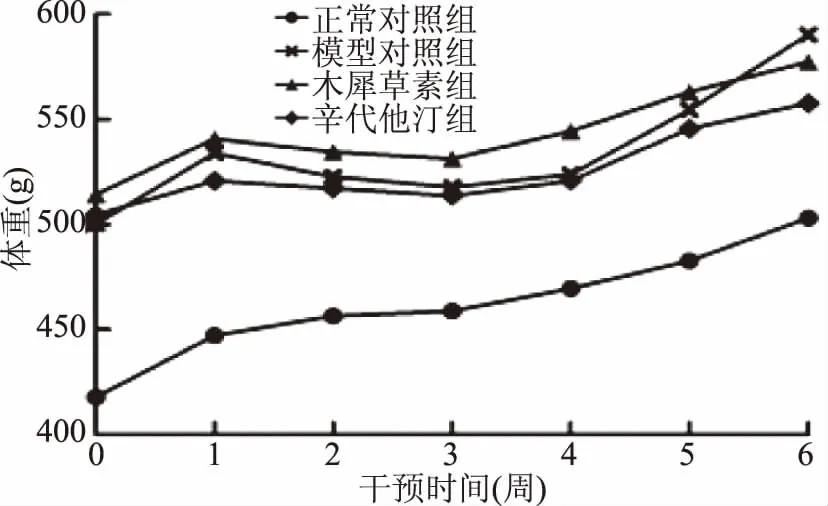
图1 干预期各组大鼠体重变化曲线
由表2可知,模型对照组的体重、肝湿重及肝系数极显著高于正常组(p<0.01);木犀草素组的体重、肝系数极显著低于模型对照组(p<0.01),肝湿重无显著性差异;辛伐他汀组的体重、肝湿重和肝系数极显著低于模型对照组(p<0.01);与阳性药物对照辛伐他汀组相比,木犀草素组没有显著性差异。体重、肝湿重和肝系数的变化均能一定程度地体现病理性变化,结果表明模型对照组大鼠的体重、肝重和肝系数极显著的升高可能与一系列的病理变化有关,经过木犀草素和辛伐他汀的干预可能对肝脏的病理性变化有所改善,且两者之前无显著差异。

表2 各组大鼠体重、肝湿重及肝系数
2.3 木犀草素对高血脂症SD大鼠血脂四项的影响
由表3可知,经6周的干预,模型对照组相比正常组,血清TC、TG、LDL-C、HDL-C含量显著升高(p<0.05);与模型对照组相比,木犀草素干预组和辛伐他汀干预组的血清TC、TG、LDL-C含量显著降低(p<0.05),HDL-C的含量变化无显著性差异;木犀草素组和辛伐他汀组的各血脂指标间均无显著性差异,表明木犀草素和辛伐他汀能极显著降脂,且两者无显著性差异。

表3 木犀草素对高血脂症SD大鼠血脂四项含量的影响
2.4 木犀草素对高血脂症SD大鼠肝脏脂肪变性的影响
干预6周后采用HE染色,制备高血脂症SD大鼠肝脏的病理切片,观察脂肪的变性情况(图2)。结果显示,正常组细胞结构规则整齐,肝窦清晰可见,肝细胞内未出现脂滴。模型对照组肝窦消失,通过Image-Pro Plus6.0读片发现,超过30%的肝细胞脂肪变性,与正常组相比有极显著差异(p<0.01)。木犀草素组脂滴明显减少,脂变程度减轻,肝窦清晰。辛伐他汀组大鼠肝窦清晰,肝细胞内脂滴明显减少。肝脏脂肪变性评分统计学分析结果见图3,与正常组相比,木犀草素组和辛伐他汀组有显著差异(分别为p<0.01,p<0.05);与模型对照组相比,两组评分均降低但无显著性差异。从病理图像结果表明木犀草素和辛伐他汀均能减轻大鼠的肝脏脂肪变性,从脂肪变性评分上表明木犀草素和辛伐他汀能降低脂肪变性程度,但无显著性差异。
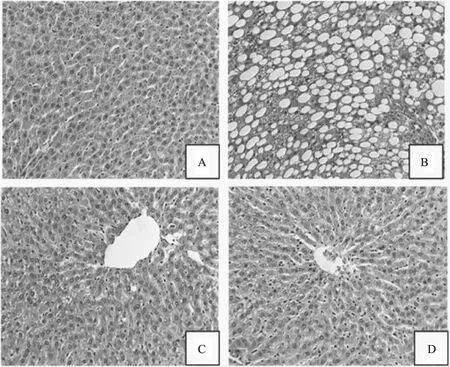
图2 木犀草素对高血脂症SD大鼠肝脏脂肪变性的影响(200×)

图3 SD大鼠肝脏脂肪变性评分
2.5 木犀草素对高脂血症SD大鼠肝脏抗氧化水平的影响
丙二醛(MDA)作为脂质过氧化终产物之一,可间接反映过氧化损伤程度。SOD、GSH-Px、CAT等作为体内抗氧化防御系统,均可清除活性氧,反映机体的抗氧化能力[18]。表4结果显示,与正常组相比,模型对照组MDA含量极显著升高(p<0.01),CAT含量显著降低(p<0.05),GSH-Px和SOD含量无显著变化;与模型对照组相比,木犀草素组和辛伐他汀组的MDA含量极显著降低(p<0.01),CAT含量显著升高(p<0.05,p<0.01),GSH-Px和SOD含量无明显变化,且无显著组间差异。采用单因素方差分析LSD两两比较,结果表明与正常对照组相比,模型对照组出现了一定程度的氧化损伤,木犀草素和辛伐他汀干预组均能显著改善氧化损伤程度,两两比较两组之间无显著性差异,但均值上看辛伐他汀抗氧化水平更好。
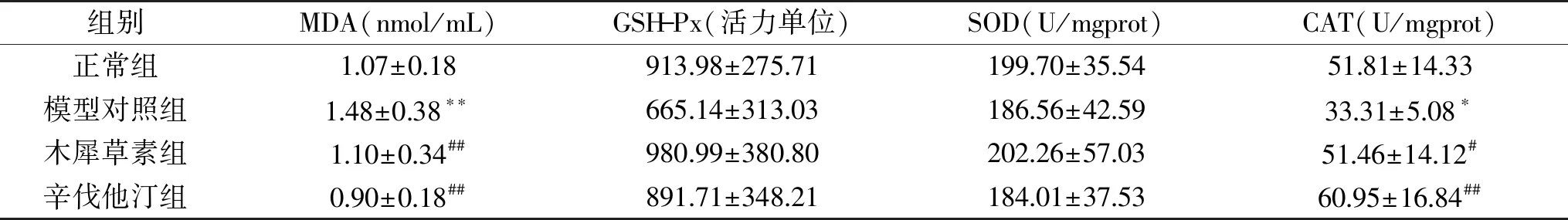
表4 木犀草素对高脂血症SD大鼠肝脏抗氧化水平的影响
3 讨论
脂肪肝与多种生理病理的改变有关。高脂血症被认为是脂肪肝的首次打击,破坏了脂质代谢的平衡,导致TG合成增加,并以脂滴的形式沉积于肝脏[19]。Day[20]提出的“二次打击学说”被认为较为全面地解释了肝脏脂肪病变,该学说认为以氧化应激、脂质过氧化为核心的二次打击导致了脂肪肝的发展,研究表明高脂血症造成脂代谢紊乱,同时容易引起机体抗氧化水平失调,即氧自由基产物增加和相关自由基清除酶活力降低[21]。因此降血脂、增加抗氧化能力成了治疗脂肪肝的重要方法[22]。
吕海英等人的研究显示,黑果枸杞叶总黄酮的抗氧化和降血脂作用可能与含木犀草素在内的五种黄酮成分有关[23],而本研究进一步通过观察血脂和抗氧化水平的变化探讨木犀草素对高脂血症大鼠肝脏脂肪变性的影响,结果表明木犀草素可以显著降低大鼠血脂改善脂代谢紊乱,从而防止肝脏的脂肪变性,其降血脂效果与辛伐他汀相比无显著差异。氧化应激是指机体促氧化物和抗氧化物之间动态平衡失调所导致的对细胞内大分子的氧化损伤[24],活性氧自由基过量易导致肝组织氧化应激。实验结果提示,木犀草素能够极显著降低脂质过氧化产物抑制脂质过氧化,提高抗氧化酶活性从而全面提高抗氧化能力与辛伐他汀相比较弱,但无显著差异。SOD、GSH-Px两个抗氧化指标在干预组有所升高,但均无显著差异,肝脏组织切片结果显示,病理形态上木犀草素能有效改善脂肪变性,变性评分有所降低,但无显著差异,提示可能与木犀草素的干预周期较短有关,对今后进一步探讨木犀草素改善肝脏脂肪变性的干预手段及机制研究提供了一定的研究基础。
4 结论
综上所述,经木犀草素干预,大鼠的体重、肝系数、血清TC、TG极显著降低(p<0.01),病理形态上肝脏脂肪变性的程度明显改善,脂肪变性评分有所降低,但无显著差异,同时脂质过氧化产物极显著减少(p<0.01),抗氧化酶CAT活性显著升高(p<0.05),本实验结果提示木犀草素可以显著降低高脂血症大鼠的血脂水平,减轻肝脏脂肪变性程度,同时能提高抗氧化水平,改善高脂血症带来的氧化损伤,结合有关学说提示木犀草素可能是通过降低SD大鼠的血脂水平以及提高抗氧化能力,从而改善大鼠肝脏脂肪变性,但其效果和机制有待进一步完善,木犀草素作为常见的可食用黄酮类化合物,在预防脂肪肝、降血脂和抗氧化方面的保健功效有待进一步研究。

