糯米酒发酵过程中微生物基因组提取方法比较
赵文婧,燕平梅
(太原师范学院生物系 山西 晋中 030619)
在生活实践中,功能性微生物的重要来源途径是传统的发酵食品,在各个方面都表现出重要作用,而被称之为发酵食品是通过微生物的作用而制成的一大类产品,在我国不仅历史悠久,而且更包含着丰富的内涵.
随着分子生物学实验技术的日渐发展,用于提取生物基因组的方法也越来越多,如:物理法中的研磨、高温、超声波、颗粒破碎[1].化学方法的SDS法、酶裂解的蛋白酶-K、溶菌酶以及他们之间相互结合等方法[2].这些方法各自有其优缺点,但是,根据不同的实验目的、不同的实验材料,选择的方法也是不同的.物理方法因破坏力度较大,往往得到的条带较小,一般为5到10kb[3];化学法有成本低、效率高等优点;酶裂解方法温和,所以应用较为普遍且效果良好的为化学法和酶裂解法[4].
而不同种生物,由于其结构不同,因此提取方法也有所不同,比如提取植物中基因组时因其细胞有细胞壁,提取土壤中微生物时多需要研磨和洗涤,所以经常采用物理与化学方法相互结合的办法[5-10];再提取其他种类生物的基因组DNA时也多见物理法与酶裂解法结合的应用.因糯米酒是由谷物发酵得来,所以不需要研磨,且糯米酒中含有多糖,所以本实验运用化学法和酶裂解法互相结合的三种方法,即:溶解酶-SDS-蛋白酶-K法,改良CTAB法和改良CTAB-溶菌酶法,对糯米酒发酵过程中微生物基因组DNA进行提取.
糯米酒,又称江米酒、甜酒、水酒、酒酿、醪糟.口味香甜浓郁,以糯米为原材料,通过泡、蒸、拌等工艺,制作成为米白色、黄色或褐红色、清晰透明的饮品.中国酿造糯米酒历史悠久,距今已有7 000余年,糯米酒品种繁多,包括:传统糯米酒、客家糯米酒、黑糯米酒、花色糯米酒等等,且可以在其中添加很多种材料,以求有不同的养生效果.如糯米酒冷喝有助消化的作用,烫热时饮用能驱寒祛湿、活血化淤,且其酒精含量小,营养丰富,适合所有人食用,故深受人们喜爱[11].
糯米酒是由多种菌种发酵谷物所得,经实验探究糯米酒最佳发酵条件为:0.4%~0.5%酒曲添加量、料水比为5∶3(g∶mL)、28 ℃、培养50 h[12].
为了了解糯米酒发酵过程中所含微生物的种类,可以运用的办法分为两种,一是传统微生物的培养方法,即:经过纯培养后,获得菌株,再对菌种类群的特性进行描述和研究;另一种方法是在分子生物学的基础上,运用免培养的方法,进行更加深入的研究,克服了传统培养方法中的无法培养自然少量菌种的不足[13-14].所以简便、高效地提取DNA对于微生物的深入研究有着重要意义.
国内对于糯米酒的研究多局限于其酿造工艺的改进和对于新型糯米酒的开发,而对于糯米酒发酵过程中微生物基因组的提取研究还很少见[15-20].因而本实验对这三种提取微生物基因组的方法进行评析、比较,找到其中更加高效、简便的方法,为后续糯米酒发酵过程中微生物类群的鉴定和研究提供坚实的基础.
1 材料与方法
1.1 材料与试剂
糯米酒原液 称取糯米50 g中加入0.2 g酒曲,添加料水比为5∶3(g∶mL),在28 ℃培养50 h;
PDB培养基;
Sodium-Chloride-Tris-EDTA Buffer(STE缓冲液) 、10% SDS(十二烷基硫酸钠)、蛋白酶-K(10 mg/L)、TE、50×TAE购于索莱宝生物科技有限公司;
裂解缓冲液:20 mmol/L Tris-Cl (pH=8.0) 10mL,NaCl 0.12 g,0.5 mol/L (w/v) EDTA 400 μL,ddH2O 9.96 mL,121 ℃灭菌20 min,加入200 ng溶菌酶;
Tris-Cl饱和酚、氯仿、异丙醇购于天津市富宇精细化工有限公司;
2×CTAB:2% CTAB (w/v) 、1.4 mol/L NaCl、0.1 mol/L EDTA(pH=8.0),121℃灭菌20 min;
β-巯基乙醇:北京庆盛达化工技术有限公司;
Mr:购于天根生化科技(北京)有限公司.
1.2 仪器与设备
冷冻离心机 Eppendorf;全温型多振荡高速轨道摇床(上海智城分析仪器制造有限公司);数显恒温水浴锅(国华电器有限公司);电泳仪(北京百晶生物科技);凝胶成像系统(Alpha ImagerHp);美国Alpha Inotech 多功能酶标仪;美国Bio Tek PCR仪.
1.3 方法
1.3.1 溶菌酶-SDS-蛋白酶-K法
以常健提取酸粥基因组DNA的方法为基础[21],做出如下改进:取糯米酒发酵液9 mL,4 ℃12 000 r/min离心10 min,弃上清, 去除培养基,得到糯米酒中的菌种;于PDB液体培养基中培养28 ℃培养50 h.设置三个重复,分别标号为:A1、A2、A3,其余一致.
1.3.2 改良CTAB法
以常健提取酸粥基因组DNA的方法为基础[21],做出如下改进:取糯米酒发酵液9 mL,4 ℃12 000 r/min离心10 min,弃上清, 去除培养基,得到糯米酒中的菌种;于PDB液体培养基中培养28 ℃培养50 h.设置三个重复,分别标号为:B1、B2、B3,其余一致.
1.3.3 改良CTAB-溶菌酶法
以常健提取酸粥基因组DNA的方法为基础[21],做出如下改进:取糯米酒发酵液9 mL,4 ℃12 000 r/min离心10 min,弃上清, 去除培养基,得到糯米酒中的菌种;于PDB液体培养基中培养28 ℃培养50 h.设置三个重复,分别标号为:C1、C2、C3,其余一致.
1.3.4 酶标仪测定DNA浓度
取对照液——无菌去离子水2 μL、4 ℃保存DNA样品TE溶解液各2 μL分别点样于酶标仪上,测定所提取的微生物基因组DNA的ABS 260nm/280nm值,以及DNA浓度,实验设置三个重复,三个数值取平均值.
1.3.5 琼脂糖凝胶电泳
取DNA样品5 μL于0.6 %琼脂糖凝胶电泳.Mr为 λDNA/HindⅢ,Mr加样量5 μL.6×Loading Buffer 1 μL,电泳结果用UV凝胶成像仪进行照胶检测.
1.3.6 提取DNA样品体外PCR扩增
细菌16SRNA序列通用引物[22]27F-1541R,27F:AGAGTTTGATCCTGGCTCAG-3’,1541R:AAGGAGGTCATCCAGCCGCA-3’(上海生工生物工程有限公司合成).
DNA模板1 μL,上下游引物各1 μL,PCR mix 12.5 μL,ddH2O 9.5 μL,各种试剂加好后缓慢摇匀.
反应条件:预变性94 ℃,5 min;变性94 ℃,30 s;退火55 ℃,30 s;延伸72 ℃,90 s;35个循环;72 ℃,保温10 min.
1.4 统计学分析
每个实验方法设置三次重复,实验数据用SSPS软件进行分析,Duncan多重比较法[23]进行多个均数间的差异显著性比较.
2 结果与分析
2.1 糯米酒发酵过程中微生物基因组提取浓度的比较
三种方法均在提取糯米酒微生物基因组的过程中,有同一现象的出现,即水浴时离心管中的样品液由黏稠状白色液体逐渐变化为澄清的较为透明的液体.
由图1可知,用溶菌酶-SDS-蛋白酶-K法(A法)提取的DNA浓度为:411.67±133.29 ng/μL.用改良CTAB法(B法)提取的DNA浓度为:1 436.03±128.0 ng/μL.用改良CTAB-溶菌酶法(C法)所提取的DNA浓度为:1 573.97±711.51 ng/μL.C法所得的基因组DNA浓度最高,B法第二,A法是三种方法中提取浓度最小的.三种基因组提取方法在DNA浓度水平上差异较为显著.
A法反应条件较为温和,糯米酒又是谷物发酵所得到的产品,其中微生物的类群比较繁多,要求进行长时间的水浴,所以长时间的裂解有利于提取到浓度更高且更为完整的基因组DNA,所以把裂解时间确定为18 h左右.
B法反应强烈,短时间就可以使细胞裂解,较长时间反而可能损害基因组DNA,提取的基因组DNA通过晃动由松散逐渐变得紧密.但是实验过程会使用到具有毒性和刺激性的β-巯基乙醇,在实验室操作时注意通风.
C法在B法的基础之上进行了改良,可以更加快速地裂解细胞,提高提取基因组DNA的效率.
三种方法提取所得的微生物基因组DNA浓度之间存在显著差异(p<0.05).
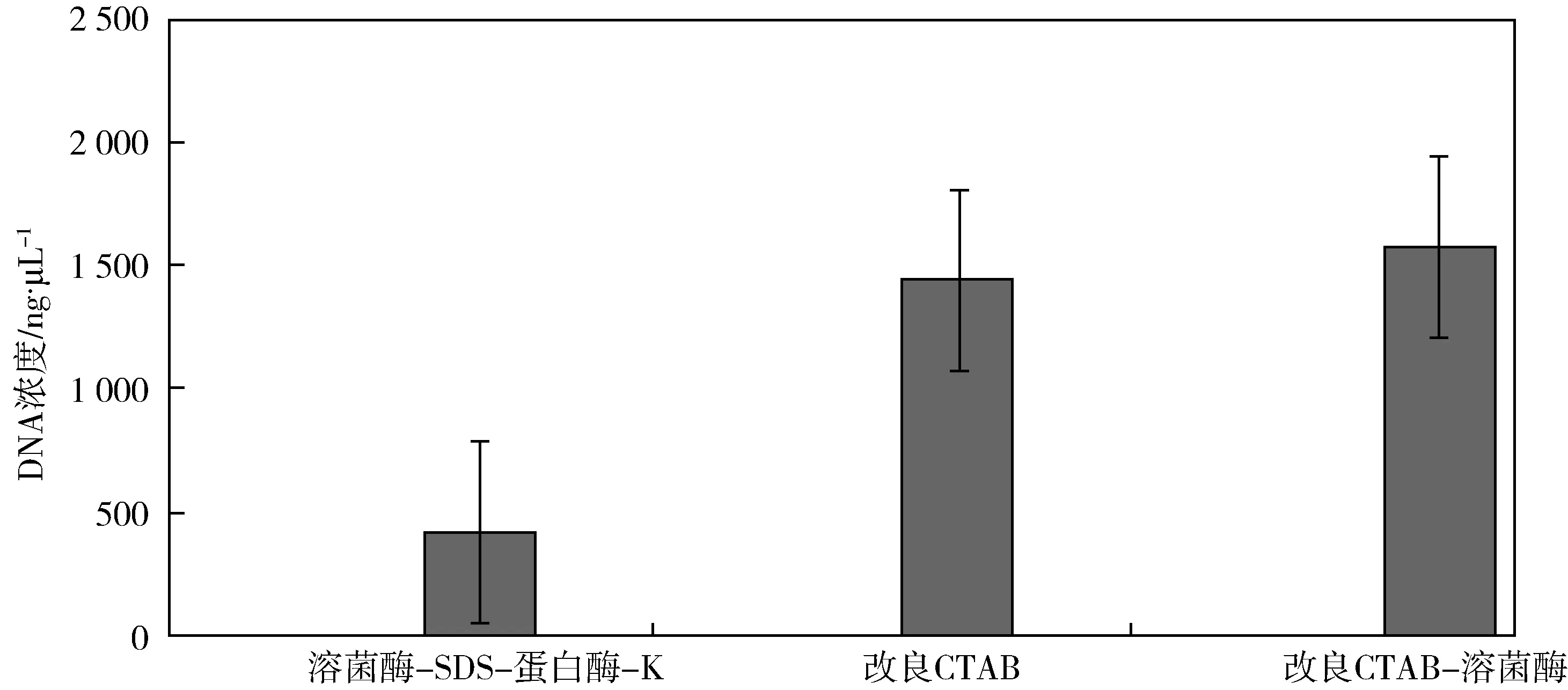
图1 基因组浓度
2.2 糯米酒发酵过程中微生物基因组提取ABS 260nm/280nm的比较
由图2可知,A法所提取的DNA样品ABS 260nm/280nm为:1.82±0.012.B法ABS 260nm/280nm为:1.99±0.07.C法所提取的DNA样品ABS 260nm/280nm为:1.99±0.12.通过数值显示,三种方法之间的差异显著,且数值都处于1.8到2.0之内,表明三种提取方法都可获得高纯度的DNA,所得样品中杂质RNA和蛋白质含量比较少,三种方法提取所得的微生物基因组DNA浓度之间存在一定的显著差异(p<0.05),可进行下一步的研究.
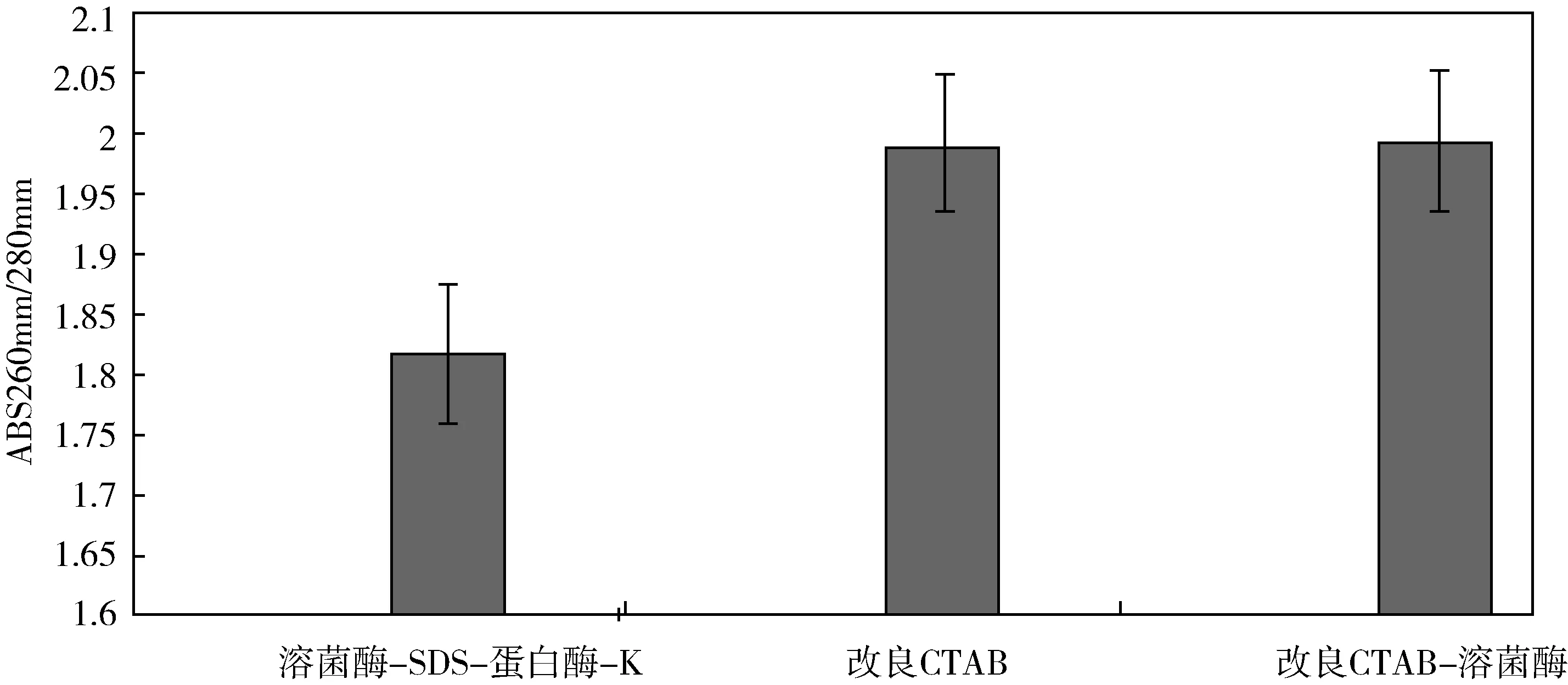
图2 ABS 260nm/280nm
2.3 糯米酒发酵过程中微生物基因组提取样品的电泳检测结果比较
由图3可知,本实验中的三种方法都可以提取到糯米酒发酵过程中的比较完整的基因组DNA,其大目标条带大小约为23 kb,条带清晰.B法和改良C法方法的电泳条带亮度无肉眼可见的差别;A法电泳条带亮度最低.三种方法点样孔中均无蛋白质和RNA残留.
2.4 糯米酒发酵过程中微生物基因组提取样品体外扩增PCR结果的比较
由图4可知,三种方法提取出的基因组DNA都可直接用于聚合酶链式反应,并且其产物条带亮度都很亮,杂带和目标条带之间有清晰的分界线.

图3 三种方法提取的DNA琼脂糖凝胶电泳结果图4 三种方法提取的DNA PCR产物琼脂糖凝胶电泳图
3 结论
三种方法提取到的DNA浓度分别为:411.67±133.29 ng/μL;1 436.03±128.0 ng/μL;1 573.97±711.51 ng/μL.三种方法提取基因组DNA的ABS260nm/280nm比值分别为:1.82±0.012;1.99±0.07;1.99±0.12.这两组数值都表明这三种方法都能够提取到糯米酒发酵过程中质量较高的基因组DNA.其中改良CTAB-溶菌酶法能够得到最高含量的基因组DNA,为后续的实验奠定了基础,更加有利于后续的糯米酒发酵过程中微生物的类群鉴定和研究.改良CTAB-溶菌酶法,在改良CTAB法的基础上加入了溶菌酶,但是唯一的缺点是较改良CTAB法消耗了更多的试剂.改良CTAB法提取的DNA浓度较为低,其提取消耗时间短,但是具有一定的毒性,且实验过程中有刺激性气味的试剂.溶解酶-SDS-蛋白酶-K法实验所需条件温和,刺激性较弱,安全系数高相比之下更加适宜在室内进行实验室操作,但是所得的基因组DNA浓度却是三种方法中最低的.综上所述,改良CTAB-溶菌酶法是糯米酒发酵过程中微生物基因组的三种提取方法中效果最好、最适合的方法.

