链霉蛋白酶消化时长对气液相培养原代小鼠气道上皮细胞的影响
高璇 徐菲 许先荣
气道上皮是呼吸系统的一部分,与外界环境直接接触,是机体与外界环境的屏障,能保护机体免受各种吸入性损害,如化学因子、污染性微粒、病原体等[1]。体外培养原代小鼠气道上皮细胞(mouse tracheal epithelium cell,MTEC)建立体外模型,在呼吸系统疾病研究中具有重要意义。相关实验证明,气液相(ALI)方法能培养出正常化、高质量、具有黏膜纤毛分化能力的不同物种的原代气道上皮细胞,包括MTEC[1-2]。培养MTEC对气道上皮细胞生长、分化过程的观察,以气道上皮细胞为基础的研究等具有重要意义。因此,建立高效、可靠的MTEC培养方法十分重要[3]。目前比较成熟的方法是利用消化酶链霉蛋白酶将气道上皮细胞从小鼠气管内皮消化分离,并在富含特殊生长因子(如胰岛素、表皮生长因子等)的培养基中增殖,最终在ALI分化成为MTEC[4-7]。消化酶消化时长会影响目标细胞的产量、细胞活力、杂质细胞数量等,因此选择合适的消化时长很有必要。本文将介绍一种培养原代MTEC的方法,并通过一系列实验确定合适的消化酶消化时长,现将结果报道如下。
1 材料和方法
1.1 实验动物 周龄5~8周的无特定病原体(SPF)级雄性小鼠32只,购自上海斯莱克实验动物公司。所有小鼠在SPF级条件下养育,所有实验步骤遵守中国动物研究委员会关于实验动物的伦理规定。
1.2 培养基 (1)采集培养基:含有左旋谷酰胺(LGlutamine,E15-817,美国 PAA公司)的 Ham’s F-12培养基,添加青霉素 100IU/ml、链霉素 100IU/ml。(2)消化培养基:采集培养基加入10U/ml链霉蛋白酶(P5147,美国 Sigma-Aldrich 公司)、0.01mol/L CaCl2、0.5mg/ml粗胰腺DNA酶Ⅰ(DN25,美国Sigma-Aldrich公司)、10mg/ml牛血清白蛋白(中国BIOSHARP公司)。(3)孵育培养基:含有左旋谷氨酰胺的 DMEM/Ham’s F-12(1∶1)培养基,添加青霉素 100IU/ml、链霉素 100IU/ml、10%FBS(美国PAA公司)。(4)基础培养基:由BEBM基础培养基(LONZA,Switzerland)与高糖左旋谷酰胺DMEM按1∶1比例配置,并添加青霉素100IU/ml、链霉素100IU/ml、5%FBS,每500ml混合培养基中加入一份SingleQuotsTMKit(瑞士LONZA公司)。(5)分化培养基:不添加FBS的基础培养基。
1.3 包被半渗透基底膜 将Ⅳ型人胎盘胶原(美国Sigma-Aldrich公司)溶于蒸馏水制备的0.2%冰乙酸溶液中,配制成胶原浓度1mg/ml的混合液;再以蒸馏水稀释至50μg/ml。基底为半渗透膜的细胞培养嵌入小室(24孔板,孔径0.4μm,透明PET膜,美国BD公司)置入24孔细胞培养板中,每个小室加入100μl胶原混合液进行包被。将细胞培养板放入孵育箱中过夜,弃去残余液体,紫外线照射至少30min灭菌,使用前用无菌PBS溶液冲洗3次。
1.4 分离原代MTEC 将小鼠分成4组,均予过量戊巴比妥钠处死,浸泡在75%乙醇溶液中10min,置于无菌操作台上。在无菌条件下,剪开小鼠胸部皮肤,充分暴露颈部。轻柔地去除周围组织,将气管分离完全。分别在主气管至支气管分叉处、甲状软骨上端剪断气管,取得气管。将气管置于冷的无菌采集培养基中[3,8-9]。再将气管转移至冷的无菌PBS溶液中,仔细去除气管上附着的其他组织,置于新的、冷的无菌采集培养基中。将气管纵向剪开,转移至含有新鲜配置的消化培养基的试管中(6~10支试管/2ml培养基)。轻柔地上下颠倒试管数次,确保气管中的气体被完全排出。将试管保持竖直,置于4℃条件下进行消化;根据分组不同,分别消化 6、12、18、24h。
1.5 采集MTEC 将试管轻柔地上下颠倒10次,使气管分散;加入占总体积10%的FBS后,再次轻柔地上下颠倒15次,以分散气道上皮细胞。将混合液收集至一支新的试管中,再向装有气管的试管中加入8ml含10%FBS的采集培养基,再次轻柔地颠倒试管20~30次,以获得更多气道上皮细胞,同时再次收集该混合液。重复上述步骤2次后,将所有混合液收集至同一个试管中,弃去气管。将混合液在500g、4℃的条件下离心10min,小心弃去上清液,将底部细胞团以2ml孵育培养基重悬。将细胞悬液移至6cm组织培养皿中,在37℃孵育箱中孵育2h以去除非上皮细胞。轻柔地旋转、晃动培养皿数次,收集上清液至新的试管中。在500g、4℃的条件下再次离心5min,小心去除上清液,将底部细胞团以100μl/支气管的基础培养基重悬,使用细胞计数器对4组获得的细胞数进行计数。以上实验步骤重复2次。
1.6 流式细胞术检测 4组小鼠获得的细胞分别用洗涤缓冲液(美国BD公司)洗涤,7-AAD生存力染色液(美国eBioscience公司)染色5min,再使用流式细胞仪(美国BD公司)进行细胞信号通路分析,以上实验步骤重复2次。阳性标记通常表示细胞处于已死亡或无存活力的状态,细胞存活率=阴性细胞数/细胞总数×100%。
1.7 MTEC孵育 将分离的细胞配制成密度为每150μl基础培养基1×105个细胞的细胞悬液,加入已包被好的嵌入小室中;小室外的培养板底部加入600μl基础培养基。将细胞在37℃、5%CO2的孵育箱中孵育72h。小心吸弃小室内外旧的培养基、未贴壁的细胞及其他残片,更换新的培养基,以后每2d更换1次培养基。
1.8 ALI条件下诱导MTEC分化 第4~5天,细胞增殖且相互贴合。此时使用上皮伏欧表(EVOM2,美国WPI公司)测量Rt值,判断细胞是否贴合。若Rt值>1000Ωcm2,表示细胞已贴合,可建立ALI培养环境[10]。将小室内外旧的培养基吸弃,仅在小室外侧加入新鲜的分化培养基,同时保持细胞层表面干燥。每2d更换1次新的分化培养基,并用温的PBS轻柔地冲洗上层细胞层表面。在建立ALI培养条件的7~10d,细胞将呈现出鹅卵石样外观。
1.9 免疫组化染色 在建立ALI培养条件后第14天,采用免疫组化染色技术对MTEC分化情况进行分析。利用胰蛋白酶/乙二胺四乙酸将细胞从小室基底膜上消化、分离,经PBS洗涤后,稀释至特定浓度,在盖玻片上铺板。待盖玻片干燥后,4%多聚甲醛固定细胞,用封闭液封闭细胞上的非特异性抗体,再以抗细胞角蛋白抗体Cytokeratin 18 RabMAb(美国EPITOMICS公司)标记细胞;孵育二抗后,先后用DAB、苏木精染色,在显微镜下观察,细胞质棕色、细胞核紫色的细胞为阳性细胞,细胞质及细胞核未被染色的细胞为阴性细胞。
1.10 气道上皮细胞的鉴定 小鼠近端气道上皮细胞主要由纤毛上皮细胞构成,还包括杯状细胞、基底细胞等,上皮下存在的主要细胞为成纤维细胞等[11]。上皮细胞能特定表达角蛋白,而成纤维细胞中不含有角蛋白,不能被抗细胞角蛋白抗体标记[12]。通过抗细胞角蛋白抗体标记的免疫组化对细胞进行鉴定,阳性细胞鉴定为上皮细胞,阴性细胞为非上皮细胞[13]。将染色细胞置于显微镜下进行观察并计数,随机并独立选取至少20个显微镜下视野,分别计数阳性及阴性细胞数,细胞纯度=阳性细胞数/总细胞数×100%。
1.11 统计学处理 应用SPSS 13.0统计软件。计量资料用表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 链霉蛋白酶消化不同时长获得的细胞数 链霉蛋白酶消化 6、12、18、24h,分别获得细胞(0.57±0.03)、(1.05±0.22)、(1.13±0.22)、(1.28±0.39)×105个,差异有统计学意义(P<0.05)。
2.2 链霉蛋白酶消化不同时长细胞存活率比较 链霉蛋白酶消化 6、12、18、24h,细胞存活率分别为(97.65±2.26)%、(96.83±0.76)%、(93.46±2.32)%、(91.56±2.99)%,差异有统计学意义(P<0.05);进一步两两比较,6h组与12h组比较差异无统计学意义(P>0.05),但均明显高于 18h组、24h组(均P<0.05),见图 1。
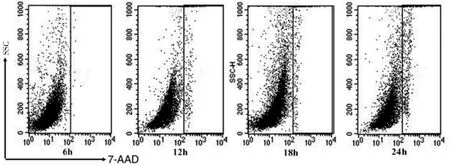
图1 MTEC经链霉蛋白酶消化6、12、18、24h后的流式细胞图

图2 链霉蛋白酶消化6、12、18、24h细胞免疫组化染色结果(×200)
2.2 链霉蛋白酶消化不同时长细胞纯度比较 经抗细胞角蛋白抗体标记后,表现为特殊染色的细胞,即上皮细胞,见图 2(插页)。链霉蛋白酶消化 6、12、18、24h,细胞纯度分别为(69.6±22.6)%、(90.4±5.1)%、(90.3±2.7)%、(88.7±1.9)%,差异有统计学意义(P<0.05);进一步两两比较,12h组、18h组细胞纯度均>90%(满足实验要求[14]),两组比较差异无统计学意义(P>0.05),但均明显高于6h组、24h组(均P<0.05)。
3 讨论
气道上皮为假复层纤毛柱状上皮,主要由纤毛细胞、分泌黏液的杯状细胞、无纤毛和分泌功能的未分化柱状细胞和基底细胞等构成,且仅有一层细胞[15-16]。由于培养原代气道上皮细胞存在取材繁琐、细胞量少、成活率低、细胞纯度低、耗时长、易污染等问题,因此对于原代气道上皮细胞培养的方法仍处于探索阶段。
目前气道上皮细胞主要的培养方法有组织块贴壁法、机械刮刷法及酶消化法[15,17]。组织块贴壁法在国内应用较多,但其对于组织块的形状、贴壁契合度以及培养孔中水分的要求都较高,大大降低了细胞培养的效率。机械刮刷法源自于临床实践中,即对患者行纤支镜操作时取材,但此方法收集到的多为衰老、易脱落的气道上皮细胞,且不适用于体型较小的实验动物,目前应用较少。目前国内外比较推崇的是蛋白酶低温消化法,这一方法对组织块的形状要求不高,对操作者培养过程中的操作熟练度、精细程度的要求较低,培养过程中所要求的酶浓度、消化时长等关键因素都是客观可控的,当掌握关键要素后,短期内可大大提高培养效率。蛋白酶主要作用于气道上皮下的基底膜,使上皮细胞从基底膜上脱落下来,但是低温酶消化法对消化时长要求较高,若消化时长过短,脱落的上皮细胞数量过少;若消化时长过长,一方面会增加上皮细胞下成纤维细胞的脱落数量,另一方面蛋白酶会作用于已脱落的上皮细胞的细胞膜,造成细胞活性降低,减少上皮细胞存活率[18]。因此,确定一个合适的消化时长对能否成功培养原代MTEC具有重要作用。
本实验在You等[7]操作指南的基础上进行了修改,同时通过一系列实验明确最合适的消化时长。本实验结果显示,链霉蛋白酶消化12、18h能达到较好的初始细胞数量和最终细胞纯度,其中12h组的细胞活性更强,且实验所需时间更短。因此,ALI培养原代MTEC时,链霉蛋白酶消化12h是最佳选择。

