丹参酮ⅡA对人膀胱癌J82细胞增殖、凋亡、侵袭及迁移的影响
吴云涛 唐晨野 郭晓 王骁
丹参酮类化合物又称总丹参酮,是从唇形科植物丹参干燥的根和根茎中提取的一大类脂溶性菲醌类化合物。丹参酮ⅡA是其中含量最多的成分,具有抗心律失常、缩小心肌梗死面积、改善心肌耗氧量、改善微循环、抗肝纤维化、保护神经细胞及诱导干细胞分化等作用[1]。近年来研究表明,丹参酮ⅡA对多种肿瘤细胞,如胃癌、前列腺癌、肝癌、肺癌、结肠癌和卵巢癌等,均具有良好的抗肿瘤活性[2-7]。本研究旨在观察丹参酮ⅡA对人膀胱癌J82细胞增殖、凋亡、侵袭及迁移等生物学特性的影响,为丹参酮ⅡA用于膀胱癌治疗提供实验依据。
1 材料和方法
1.1 细胞株及试剂 人膀胱癌J82细胞株(中国科学院上海细胞库),丹参酮ⅡA(T4952-5MG,美国Sigma公司),DMEM 培养基(SH30022.01B,美国Hyclone公司),FBS(S601S-500,德国 Sera&Pro公司),胰蛋白酶(0457,美国 Amresco公司),PBS(GNM-10010,杭州吉诺生物医药技术有限公司),青链霉素双抗(15140-122,美国Gibco公司),细胞计数试剂盒(CCK-8)、膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)/碘化丙锭(PI)凋亡检测试剂盒(日本同仁化学研究所),Matrigel基质胶、Transwell侵袭小室(美国Corning公司),培养瓶、培养皿、离心管、6孔板、96孔板(上海碧云天生物技术有限公司)。
1.2 方法
1.2.1 细胞培养 将人膀胱癌J82细胞体外培养于DMEM(高糖)培养基(含10%FBS+1%双抗),置于37℃、5%CO2培养箱中培养。
1.2.2 细胞增殖抑制率检测 采用CCK-8法。胰蛋白酶消化对数生长期人膀胱癌J82细胞并配制成细胞悬液,每孔加100μl(3 000~5 000个细胞),置于37℃、5%CO2培养箱中培养(过夜贴壁),边缘孔用无菌PBS填充。设置药物浓度分别为 1、2、3、5、8μmol/L 的实验组、阴性对照组(药物浓度为0μmol/L)及空白对照组,每组设5个复孔。在实验组中每孔加入10μl相应浓度药物,空白对照组每孔加入10μl培养基。置于培养箱中培养24、48h后,各取1块板,每孔加入 10μl CCK-8试剂,轻轻敲击培养板混匀,在培养箱中孵育2h。使用酶标仪测定450nm处光密度值(OD值)。增殖抑制率=1-(OD值实验组-OD值空白对照组)/(OD值阴性对照组-OD值空白对照组)×100%。应用Graphpad Prism软件绘图。
1.2.3 细胞凋亡率检测 采用Annexin V-FITC/PI双标记流式检测法。取对数生长期人膀胱癌J82细胞3瓶,弃原培养基,分别加入含有浓度为1、3、5μmol/L药物的培养基,另取1瓶作为对照组给予换液;培养48h后按照Annexin V-FITC/PI凋亡检测试剂盒操作步骤染色、上流式细胞仪检测,应用Flowjo软件进行数据分析。
1.2.4 细胞侵袭能力检测 采用Transwell侵袭实验。用无血清培养基按照1∶5比例稀释Matrigel基质胶,每孔100μl加入上室内,置入37℃培养箱内40min使胶凝固。取对数生长期人膀胱癌J82细胞,胰蛋白酶消化、离心;用无血清培养基及无血清含药物浓度为1、3、5μmol/L的培养基分别悬浮细胞,调整浓度至5×105/ml,每孔100μl接种于上室内,下室加入500μl含20%FBS培养基;分别培养24、48h后取出小室,棉签擦去上室内基质胶及细胞,甲醛固定20min,0.1%结晶紫染色15min,PBS冲洗2次,在倒置显微镜下随机选取5个视野,拍照并计数。
1.2.5 细胞迁移能力检测 采用划痕实验。实验操作前对所用物品进行灭菌,使用直尺、记号笔等物品操作前在超净台内紫外线照射30min。胰蛋白酶消化对数生长期的人膀胱癌J82细胞并配制成细胞悬液,以2ml/孔(约5×105个细胞)接种至6孔板中,分别加入含浓度为1、3、5μmol/L药物的培养基,分为 3组,并设置对照组,培养24h后将6孔板放置在预先设计好的划痕模版(模版上均匀划6条横线,线间距离1cm)上,借助直尺,用200μl移液枪头依照模版在板底对应孔中划直线,用PBS漂洗2次以除去划下的悬浮细胞;继续培养12、24、36h后在倒置显微镜下观察细胞迁移情况。应用Image-Pro Plus 6.0软件测量各个时间点细胞未覆盖的面积。划痕愈合率=1-(各时间点划痕面积/开始的划痕面积×100%)。上述实验步骤重复5次,取平均值。
1.3 统计学处理 应用SAS 8.1统计软件。计量资料用表示,细胞增殖抑制率及细胞侵袭数的比较采用析因设计资料的方差分析,两两比较采用LSD-t检验;划痕愈合率的比较采用单因素方差分析,两两比较采用LSD-t检验。细胞凋亡率的比较采用χ2检验,两两比较采用Bonfferoni校正法。P<0.05为差异有统计学意义。
2 结果
2.1 丹参酮ⅡA对J82细胞增殖的影响 1、2、3、5、8μmol/L丹参酮ⅡA对J82细胞作用24h时的增殖抑制率分别为(1.88±3.07)%、(15.34±4.43)%、(30.24±3.38)%、(42.44±1.98)%、(46.36±2.40)%,差异有统计学意义(P<0.05);作用 48h时的增殖抑制率分别为(3.12±2.73)%、(19.83±4.27)%、(45.41±3.20)%、(62.09±5.04)%、(67.79±1.94)%,差异有统计学意义(P<0.05)。随着给药浓度的增加,J82细胞增殖抑制率随之增加;在相同给药浓度(除1μmol/L外)前提下,丹参酮ⅡA作用48h的细胞增殖抑制率均高于24h(均P<0.05)。提示丹参酮ⅡA对J82细胞有增殖抑制作用,且呈浓度与时间依赖性,见图1。

图1 不同浓度丹参酮ⅡA作用24、48h对J82细胞增殖的影响
2.2 丹参酮ⅡA对J82细胞凋亡的影响 对照组、1μmol/L组、3μmol/L组、5μmol/L组细胞数分别为7 787、10 106、9 502、14 941个;总凋亡率分别为3.36%、12.23%、14.74%、18.40%,差异有统计学意义(P<0.05)。两组间比较发现,3个药物处理组总凋亡率均高于对照组(均P<0.05),3μmol/L组、5μmol/L组均高于 1μmol/L组(均P<0.05),5μmol/L 组高于 3μmol/L 组(P<0.05)。提示丹参酮ⅡA对J82细胞具有诱导凋亡的作用,且呈浓度依赖性,见图2。

图2 不同浓度丹参酮ⅡA作用48h对J82细胞凋亡的影响(Q1:机械损伤;Q2:晚期凋亡;Q3:正常细胞;Q4:早期凋亡;总凋亡率为Q4、Q2之和)
2.3 丹参酮ⅡA对J82细胞侵袭能力的影响 对照组、1μmol/L 组、3μmol/L 组、5μmol/L 组作用 24、48h时 J82细胞侵袭数比较,差异均有统计学意义(均P<0.05);进一步两两比较发现,同一时点任意两浓度组比较,差异均有统计学意义(均P<0.05)。在相同给药浓度的前提下,丹参酮ⅡA作用48h的细胞侵袭数均少于24h(均P<0.05)。提示丹参酮ⅡA能减弱J82细胞的侵袭能力,且呈浓度与时间依赖性,见表1和图3(插页)。
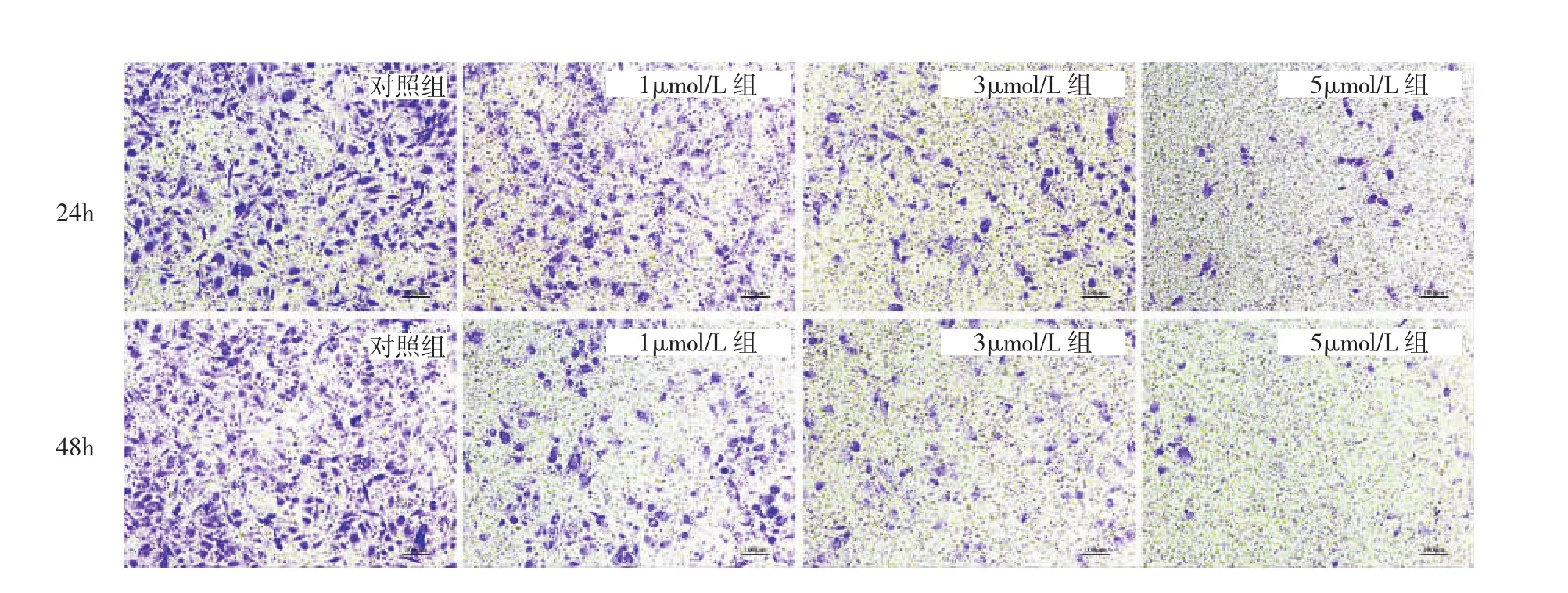
图3 不同浓度丹参酮ⅡA作用24、48h对J82细胞侵袭能力的影响(结晶紫染色,×150)
2.4 丹参酮ⅡA对J82细胞迁移能力的影响 不同浓度丹参酮ⅡA对J82细胞作用24h后进行划痕实验,观察划痕后12、24、26h的J82细胞划痕愈合率。结果发现对照组、1μmol/L 组、3μmol/L 组、5μmol/L 组划痕后 12、24、36h划痕愈合率比较,差异均有统计学意义(均P<0.05)。进一步两两比较发现,3μmol/L组、5μmol/L组与对照组以及1μmol/L组与5μmol/L组划痕后12、24h划痕愈合率比较,差异均有统计学差异(均P<0.05);划痕后36h,任意两浓度组划痕愈合率比较差异均有统计学意义(均P<0.05)。提示丹参酮ⅡA能减弱J82细胞的迁移能力,且呈浓度依赖性,见表2和图4。

表1 丹参酮ⅡA对J82细胞侵袭数的影响(个)

表2 丹参酮ⅡA对J82细胞划痕愈合率的影响(%)
3 讨论
膀胱癌是泌尿系统中发病率最高的恶性肿瘤。新发膀胱癌多数为非肌层浸润性膀胱癌,治疗以手术切除为主,术后联合辅助性膀胱灌注治疗(包括膀胱灌注化疗、膀胱灌注免疫治疗)。膀胱癌患者5年生存率可达90%,但临床上面临较大的问题是其复发率很高(50%~70%),部分患者(10%~15%)甚至进展为肌层浸润性膀胱癌[8],最终全身转移而病死。因此,减少膀胱癌的复发与转移具有重要的现实意义。
近年来,随着对各类中药化学成分的深入研究,发现了一大批具有抗肿瘤活性良好的天然化合物,如丹参酮ⅡA等。已有实验证实,丹参酮ⅡA可抑制肿瘤细胞生长和增殖。Su等[9]证实丹参酮ⅡA处理人胃腺癌AGS细胞后,可以在体外和体内抑制第10号染色体磷酸酶和张力蛋白同源丢失性基因(PTEN)的蛋白表达,通过下调磷脂酰肌醇3-激酶(PI3K)/丝苏氨酸蛋白激酶(Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)级联抑制肿瘤细胞增殖。Zhang等[10]研究发现,丹参酮ⅡA在食管癌Ec109细胞中可通过上调microRNA-122而抑制丙酮酸激酶M2(PKM2)的表达,从而抑制肿瘤细胞增殖。在丹参酮ⅡA诱导肿瘤细胞凋亡的研究中,Jung等[11]发现丹参酮ⅡA可能通过两面神激酶(JAK)/信号转导和转录激活因子3/5(STAT3/5)途径体外诱导慢性粒细胞白血病K562细胞凋亡;而Lin等[12]研究结果表明,经丹参酮ⅡA处理后,人类肝细胞癌HepG2细胞中Fas相关死亡结构域蛋白样白介素-1β转换酶抑制蛋白(FLIPS)表达明显下调,形成半胱天冬酶8的同二聚体并作用于受体相互作用蛋白激酶-1(RIP1)、RIP3和混合系列蛋白激酶样结构域(MLKL),从而诱导细胞凋亡。除了上述抑制肿瘤细胞增殖及诱导其凋亡的作用外,丹参酮ⅡA还被证实具有抑制肿瘤细胞侵袭和迁移的作用。Zhang等[13]研究发现,丹参酮ⅡA可明显降低基质金属蛋白酶-2、基质金属蛋白酶-9的表达水平,从而抑制骨肉瘤MG-63细胞的侵袭和转移。李萍等[14]研究表明,丹参酮ⅡA能明显降低异质性黏附分子CD44V6的表达,同时上调E-钙黏附蛋白的表达,从而减弱胃癌MKN-45细胞黏附侵袭与趋化能力,达到抑制肿瘤细胞侵袭与转移的目的。

图4 不同浓度丹参酮ⅡA作用24h(划痕后0、12、24、36h)对J82细胞迁移能力的影响(×150)
本实验就丹参酮ⅡA是否对膀胱癌具有同样良好的抗肿瘤活性进行了探讨,结果表明丹参酮ⅡA在体外能抑制人膀胱癌J82细胞增殖,诱导其凋亡,还能降低其侵袭与迁移的能力,且在一定程度上呈现出浓度及作用时间依赖效应。但本研究为初步实验,仍存在不足之处,如关于丹参酮ⅡA降低肿瘤细胞侵袭与迁移能力的作用,尚不能判断是药物直接作用,还是由于药物对肿瘤细胞抑制增殖及诱导凋亡的作用过于显著而导致细胞数量明显减少,从而影响了肿瘤细胞的侵袭与迁移能力。下一步笔者将从分子水平进行研究,探讨其相关机制,为丹参酮ⅡA用于膀胱癌治疗提供更可靠的理论依据。

