N-乙酰半胱氨酸对脓毒症大鼠急性肺损伤的影响及其与自噬的关系
蔡江红,杨国辉
(贵州医科大学,贵阳550004)
脓毒症是重症监护室常见的急危重症,病死率极高。脓毒症是一种全身炎症反应综合征,机体对感染反应失调,导致脓毒性休克和多器官功能衰竭。急性肺损伤和急性呼吸窘迫综合征是脓毒症最常见的并发症,约占脓毒症患者的70%[1]。当机体受到饥饿、营养缺乏、微生物入侵等应激刺激时,可发生适应性细胞自噬现象,去除坏死物质和受损细胞器,维持细胞存活,保护机体;但过度自噬也可导致细胞死亡[2,3]。脓毒症引起的炎症反应及缺血、缺氧、氧化应激产生的活性氧簇(ROS)均使肺细胞启动自噬维护内环境的稳态,而持续超负荷的刺激将进一步诱导细胞更高水平的自噬,导致细胞功能紊乱,甚至引发炎症的瀑布性放大作用,导致机体出现肺损伤甚至是多器官功能障碍综合征(MODS)[4,5]。关于抗氧化剂N-乙酰半胱氨酸(NAC)治疗脓毒症的效果,文献报道结果并不一致。Hein等[6]报道,脓毒症患者给予NAC治疗后,肝脏血液灌注量明显增加,乳酸下降,肝功能改善,可能与NAC改善了肝脏的微循环有关。但Spapen等[7]报道,在相同的基础治疗基础上,NAC治疗组与安慰剂治疗组的微量蛋白尿/肌酐值(MACR)、序贯器官衰竭评估(SOFA)评分比较差异无统计学意义,NAC治疗组心血管SOFA评分甚至有所增加。NAC具有抗氧化、清除自由基、抑制炎症反应和调控细胞凋亡、调节细胞代谢的作用,但关于其与自噬关系的报道较少。2017年5月~2018年10月,我们通过制作脓毒症大鼠模型,观察NAC对脓毒症急性肺损伤引起的肺组织炎症和自噬的影响,探讨NAC治疗脓毒症的作用机制,为脓毒症的治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 动物 SPF级健康雄性SD大鼠24只,体质量(200±30)g,购自贵州医科大学实验动物中心。适应环境饲养1周,温度20~29 ℃,湿度40%~70%,自然光照,普通饲料喂养,自由摄食饮水。
1.1.2 药品、试剂与仪器 NAC(德国Sigma公司),自噬抑制剂3-甲基腺嘌呤(3-MA)(美国MCE公司),TNF-α、IL-6 ELISA试剂盒(中国欣博盛公司),Beclin-1、微管相关蛋白1轻链3Ⅱ(LC3Ⅱ)兔源多克隆抗体(英国Abcam公司),鼠源β-actin单克隆抗体、Western blotting辣根过氧化物酶检测试剂盒、BCA蛋白测定试剂盒、ECL高灵敏度化学发光检测试剂盒(康为世纪公司)。主要仪器为电子天平(北京赛多利斯科学仪器有限公司)、光学显微镜(德国卡尔蔡司公司)、多功能酶标仪(美国Bio Tek Instruments)、DYY-64蛋白电泳仪(北京市六一仪器厂)等。
1.2 实验方法
1.2.1 分组与造模 将大鼠随机分为假手术组、模型组、NAC组、3-MA干预组,每组各6只。采用盲肠结扎穿孔(CLP)法制作脓毒症模型:10%水合氯醛30 mg/kg腹腔注射麻醉大鼠,取腹部正中切口,以盲肠盲端1/3处作为结扎点结扎,结扎时保留血管;使用20号针头将盲肠贯通穿孔,轻轻挤出少许粪便后将盲肠还纳腹腔,逐层缝合腹壁切口。假手术组仅取出盲肠,不结扎、穿孔,体外放置6 min后还纳腹腔。
1.2.2 药物干预与标本采集 术后各组均皮下注射生理盐水30 mL/kg。基于NAC半衰期为2.5 h,因此NAC组于术后1、4、8、12、16、20 h分别皮下注射NAC 20 mg/kg。假手术组、模型组于相同时间点皮下注射等量生理盐水。3-MA干预组先于术后1 h腹腔注射3-MA 10 mg/kg,再于术后1、4、8、12、16、20 h分别皮下注射等量生理盐水。于术后24 h麻醉处死大鼠,开胸,分离两侧肺脏,生理盐水清洗。取左上肺测定肺组织湿/干重比(W/D),取右下肺行组织病理学检查,剩余肺组织置于-80 ℃储存,用于ELISA、Western blotting和荧光定量PCR检测。
1.2.3 肺组织W/D测定 取左肺上叶,用滤纸拭干表面水分,称取质量即肺湿质量(W);然后置于75 ℃恒温烤箱中烘烤48 h,称取质量即肺干质量(D)。计算二者比值即W/D,用于了解肺水肿程度。
1.2.4 肺组织病理学检查 取右下肺组织,加入4%甲醛溶液固定,梯度乙醇脱水,二甲苯透明,石蜡包埋,切成4 μm厚薄片。行HE染色,光学显微镜下观察组织病理学变化,按照文献[6]方法进行肺组织病理学损伤评分。评价指标包括组织水肿、渗出、充血、出血、坏死、嗜中性粒细胞浸润和肺不张,根据严重程度分别计0~4分(0分最轻,4分最重),各项评分相加的总和作为肺组织病理学损伤评分。
1.2.5 肺组织炎症因子TNF-α、IL-6检测 采用ELISA法。取肺组织,制成肺组织匀浆,离心取上清液,按说明书进行加样、加抗体、洗板、加酶、洗板、显色、终止反应后,用酶标仪以空白孔调零,在450 nm波长下读取各孔光密度(OD)值。以标准物浓度为横坐标、OD值为纵坐标绘制标准曲线,计算TNF-α、IL-6浓度。
1.2.6 肺组织自噬相关蛋白LC3Ⅱ、Beclin-1检测 采用Western blotting法。取肺组织剪碎匀浆,加入蛋白裂解液,收集上清液,采用BCA法测定蛋白浓度。将蛋白上样后,在电泳槽中进行SDS-PAGE凝胶电泳,将蛋白转移至PVDF膜上。加入5%脱脂奶室温封闭30 min,TBST洗膜5次。分别加入LC3Ⅱ(1∶1 000)、Beclin-1(1∶2 000)及β-actin(1∶5 000)一抗,4 ℃孵育过夜。TBST洗膜,加入相应的IgG二抗(1∶200),室温孵育2 h。ECL化学发光显色,凝胶成像分析系统检测各组相应条带,应用Image J软件测出目的条带的灰度值,以目的条带与内参β-actin条带的灰度值之比计算目的蛋白的相对表达量。
1.2.7 肺组织自噬相关基因LC3Ⅱ、Beclin-1 mRNA检测 采用qRT-PCR法。取肺组织,加入TRIzol液提取肺组织总RNA,测定浓度及纯度,逆转录为cDNA,然后进行实时荧光定量PCR。引物序列:LC3Ⅱ上游引物5′-CCGTCCTGGACAAGACCAAGTTCCTT-3′,下游引物5′-ACACTCACCATGCTGTGCCCATTCA-3′;Beclin-1上游引物5′-GTCTAAGGCGTCCAGCAGCACCAT-3′,下游引物5′-GGTCACTCGGTCCAGGATCTTGAAGC-3′;β-actin上游引物5′-GAAGATCAAGATCATTGCTCCT-3′,下游引物5′-TACTCCTGCTTGCTGATCCA-3′。PCR反应体系(20 μL):SYBR Primix Ex TaqⅡ 10 μL,上、下游引物各0.8 μL,cDNA模2.0 μL,dH2O 6.4 μL。反应条件:95 ℃ 30 s,95 ℃ 5 s,55 ℃ 30 s,72 ℃ 30 s,共45个循环。反应结束后读取各样本的Ct值,应用2-ΔΔCt法计算目的基因的相对表达量。

2 结果
2.1 四组肺组织W/D比较 假手术组、模型组、NAC组、3-MA干预组肺组织W/D分别为4.414±0.326、11.175±0.783、6.228±0.452、6.243±0.363。与假手术组比较,模型组W/D升高;与模型组比较,NAC组W/D降低(P均<0.05);3-MA干预组与NAC组比较差异无统计学意义(P>0.05)。
2.2 四组肺组织病理改变 假手术组肺泡结构正常,肺泡腔大小均一,Ⅰ型和Ⅱ型肺泡上皮细胞形态正常,胞核清晰,胞质染色均匀,肺泡内无明显炎性细胞浸润;与假手术组比较,模型组肺泡增大,体积大小不一,肺泡上皮细胞空泡变性,胞质染色不均,胞内含有大小不等的空泡,相邻肺泡融合,肺泡间质明显增宽,间质内有大量中性粒细胞、淋巴细胞及少量巨噬细胞浸润;与模型组比较,NAC组和3-MA干预组肺泡结构相对完整,大小相对一致,肺间质略有增宽,炎症细胞浸润减少。假手术组、模型组、NAC组、3-MA干预组肺组织病理学损伤评分分别为(3.516±0.415)、(10.227±0.617)、(4.952±0.311)、(4.985±0.659)分,与假手术组比较,模型组评分升高;与模型组比较,NAC组和3-MA干预组评分降低(P均<0.05);3-MA干预组与NAC组比较差异无统计学意义(P>0.05)。
2.3 四组肺组织中TNF-α、IL-6表达比较 见表1。
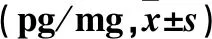
表1 四组肺组织中TNF-α、IL-6水平比较
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05。
2.4 四组肺组织中LC3Ⅱ、Beclin-1蛋白及mRNA表达比较 见表2。

表2 四组肺组织中LC3Ⅱ、Beclin-1蛋白及mRNA表达比较
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05。
3 讨论
脓毒症易诱发多器官功能障碍综合征,病死率高。急性肺损伤和急性呼吸窘迫综合征是脓毒症最常见的并发症,病死率为25%~50%[8]。急性肺损伤可由多种原因引起,关键因素是炎症和氧化应激。TNF-α是脓毒症急性肺损伤炎症反应的重要促炎因子[9]。TNF-α激活细胞因子后形成级联反应,诱发IL-1B、IL-6等炎症介质的合成,形成全身过度炎症瀑布式反应。自噬是针对体内应激反应而产生的细胞包裹、清除入侵病原及受损细胞器等物质的一种保护性反应,自噬可为细胞提供维持其结构、功能和代谢所需要的物质,从而维持细胞正常的生理功能。研究显示,自噬具有双重作用[10]。适度的自噬可保护组织或细胞损伤,而过度的自噬则相反。在脂多糖诱导的急性肺损伤中,自噬水平减弱后,肺损伤程度得到改善[11,12]。据此推测,脓毒症急性肺损伤发生及发展可能与自噬相关,自噬干预可能作为脓毒症急性肺损伤的一个治疗靶点[13]。
Senoglu等[14]报道,NAC预处理可降低盲肠结扎脓毒症大鼠炎症因子TNF-α、IL-6水平。Gurer等[15]报道,在烫伤烧伤面积30%后72 h行CLP导致的二次创伤脓毒症模型中,肺组织病理评分明显下降。张艰等[16]报道,NAC可通过抑制NF-κB激活而减轻LPS诱导的急性肺损伤的炎症程度。本研究以肺组织病理学损伤改变、肺组织W/D及肺组织炎症因子TNF-α、IL-6水平作为判定肺损伤的主要指标。结果显示,与假手术组比较,模型组出现了严重的肺组织病理损伤改变,肺组织TNF-α、IL-6水平升高,提示CLP法成功制备脓毒症肺损伤模型。NAC组经NAC治疗后,肺组织W/D下降,肺组织病理学损伤改善,TNF-α、IL-6水平下降,说明NAC治疗减轻了脓毒症急性肺损伤的炎症反应,肺水肿程度好转,NAC对肺组织具有保护作用。
LC3Ⅱ和Beclin-1均是参与白噬体形成的重要基因,是检测自噬水平的两种标志物。LC3是一种泛素样蛋白,参与吞噬泡的形成,并在吞噬泡的延长和闭合中起重要作用,贯穿自噬体形成的过程[17]。LC3以LC3Ⅰ和LC3Ⅱ两种形式存在于细胞内,LC3Ⅰ在胞质中呈散在分布,而LC3Ⅱ则较稳定地留在自噬体膜上,因此LC3Ⅱ水平能够反映自噬体数量。Beclin-1是自噬过程中的重要蛋白,与Vps34形成多蛋白复合体,调节自噬体膜的延伸过程。本研究结果显示,模型组肺组织LC3Ⅱ、Beclin-1蛋白及mRNA表达增强。这说明模型组损伤的肺组织自噬表达增强。提示自噬可能通过促进炎症反应机制参与并引起了急性肺损伤。NAC组和3-MA干预组LC3Ⅱ、Beclin-1蛋白及mRNA表达下降,且两组比较差异无统计学意义。这说明NAC与3-MA能够下调脓毒症大鼠肺组织自噬水平,提示NAC可能也是通过调节自噬水平减轻肺组织炎症反应,改善肺损伤程度。
综上所述,NAC可能通过抑制脓毒症肺损伤自噬水平,进而抑制肺组织炎症因子TNF-α、IL-6释放,减轻肺组织的炎症反应,从而发挥保护肺组织的作用。

