高效液相色谱 -串联质谱法同时测定人血中8种有毒生物碱Δ
崔佳丽,赵高琼,梅 晶,张光远,李斌杰,蔡华丹,苏 敏,王京昆,刘红斌#
(1.云南省药物研究所药物安全性评价中心,云南 昆明 650111; 2.云南白药集团创新研发中心,云南 昆明 650111; 3.云南省中药和民族药新药创制企业重点实验室药物安全性评价中心,云南 昆明 650111; 4.解放军总医院第五医学中心药学部,北京 100039)
生物碱为含氮的有机碱性化合物,其分子中大多含氮杂环,如吡啶、吲哚、喹啉及嘌呤等,也有部分为胺类化合物,其广泛存在于生物体内,具有高效的药理作用和毒性作用[1-4]。生物碱具有抗恶性肿瘤[5]、抗肿瘤[6]、镇静镇痛[7]、抗炎[4]、抗菌[8-9]、抗病毒[10]以及抗心律失常和治疗高血压病等心血管疾病[3-4]的作用。但是,生物碱治疗窗窄,具有较强毒性,应用不当会导致严重的毒性反应。故临床应用生物碱及相关药物时,应监测生物碱的血药浓度;发生生物碱中毒事故时,需对摄入生物碱进行检测。目前,国内外尚未见文献报道同时监测人血中有毒生物碱雪上一枝蒿乙素、介芬胺、藜芦胺、雪上一枝蒿甲素、雷公藤吉碱、滇乌碱、乌头碱及黄草乌碱甲的方法,本研究拟建立应用高效液相色谱-串联质谱(high performance liquid chromatography-mass spectrometry/mass spectrometry,HPLC-MS/MS)法测定人血浆中上述8种有毒生物碱的方法,报告如下。
1 材料
1.1 仪器
Agilent 1200SL型液相色谱-API3200型三重四级杆质谱仪(美国Agilent公司),Analyte 1.5质谱工作站;DV215CD型电子天平(美国OHAUS公司);Allegra 64R型高速冷冻台式离心机(美国Backman公司);XW-80 A型旋涡混合器(上海精科实业有限公司);MD 200型氮气吹扫仪(杭州奥盛仪器有限公司);ElixTM+Milli-Qsynthesis超纯水机(美国Millipore公司)。
1.2 药品与试剂
雪上一枝蒿乙素(含量>98%,批号N-019-150906,分子量437.57,北京盛世康普化工技术研究院提供);藜芦胺(含量98.90%,批号SBJ150701,分子量409.61,南京森贝伽生物科技有限公司提供);介芬胺(含量98.90%,批号SBJ150625,分子量425.60,南京森贝伽生物科技有限公司提供);雪上一枝蒿甲素(含量100%,批号110895-200404,分子量343.50,中国药品生物制品检定所提供);雷公藤吉碱(含量≥97%,批号150903,分子量857.81,北京盛世康普化工技术研究院提供);滇乌碱(含量≥98%,批号151227,分子量659.76,北京盛世康普化工技术研究院提供);乌头碱(含量>98%,批号W-006-151225,分子量645.74,北京万佳首化生物科技有限公司提供);黄草乌碱甲(含量99%,批号20151225,分子量643.76,云南省药物研究所天然药物化学研究室自制);内标非那西汀(含量98%,分子量179.22,批号76747319,上海迈瑞尔化学技术有限公司提供);甲醇(色谱纯,美国Merck公司提供);乙腈(色谱纯,美国Merck公司提供);异丙醇(色谱纯,美国Merck公司提供);醋酸铵(色谱纯,上海阿拉丁生化科技股份有限公司提供);氨水[分析纯,重庆川东化工(集团)有限公司提供];乙酸乙酯(分析纯,国药集团化学试剂有限公司提供);超纯水。人空白血浆源自云南省昆明市血液中心。
2 方法与结果
2.1 未知浓度血浆样品含量测定
2.1.1 对照品溶液的制备:分别取雪上一枝蒿乙素、介芬胺、藜芦胺、雪上一枝蒿甲素、雷公藤吉碱、滇乌碱、乌头碱和黄草乌碱甲标准品适量,置于10 ml容量瓶中,精密称定,除乌头碱加二氯甲烷-异丙醇(V∶V=1∶1)溶解后定容至刻度外,其他对照品均加甲醇溶解后定容至刻度,摇匀,即得质量浓度约为0.2 mg/ml的对照品储备液,2~8 ℃保存。将此储备液稀释为相应质量浓度的混合对照品工作液,内标非那西汀工作液质量浓度为2.59 μg/ml。
2.1.2 样品预处理:移取内标工作液10 μl,常温(10~30 ℃)条件下以氮气吹干后移取100 μl未知浓度血浆样品,涡旋混合2 min,加入25%氨水40 μl,漩涡混匀后以乙酸乙酯1 ml漩涡混合提取3 min,6 000 r/min离心10 min,取出上清液600 μl,常温条件下以氮气吹干,残渣加甲醇150 μl复溶,离心取上清液。
2.1.3 色谱条件:色谱柱为Agilent ZORBAX Extend C18色谱柱(4.6 mm×50 mm,3.5 μm);流动相为乙腈-10 mmol/L醋酸铵(氨水调pH为8.8),梯度洗脱(0.00~0.20 min,10.0%~10.0%乙腈;0.20~2.00 min,10.0%~90.0%乙腈;2.00~5.00 min,90.0%~90.0%乙腈;5.00~5.10 min,90.0%~10.0%乙腈;5.10~7.50 min,10.0%~10.0%乙腈);流速为0.4 ml/min。
2.1.4 质谱离子化方式:电喷雾离子化(electrospray ionization,ESI),正离子模式。(1)多反应监测(multiple reaction monitor,MRM)定量。雪上一枝蒿乙素定量离子对[M+H]+,m/z=438.20/420.10;介芬胺定量离子对[M+H]+,m/z=426.20/114.10;藜芦胺定量离子对[M+H]+,m/z=410.20/295.20;雪上一枝蒿甲素定量离子对[M+H]+,m/z=344.30/105.00,雷公藤吉碱定量离子对[M+H]+,m/z=858.60/206.20;滇乌碱定量离子对[M+H]+,m/z=660.30/600.30;乌头碱定量离子对[M+H]+,m/z=646.30/586.30;黄草乌碱甲定量离子对[M+H]+,m/z=644.20/584.10;内标内标非那西汀定量离子对[M+H]+,m/z=180.2/110.0。(2)离子源参数。气帘气20.00 psi,喷雾电压5 500.00 V,雾化温度500.0 ℃,雾化气50.0 psi,辅助气50.0 psi,碰撞气适中,接口加热开启;雪上一枝蒿乙素、介芬胺、藜芦胺、雪上一枝蒿甲素、雷公藤吉碱、滇乌碱、乌头碱和黄草乌碱甲质谱检测电压,去簇电压分别为65、75、65、85、85、70、75和80 V,射入电压分别为9、10、9、9、10、9、10和9 V,碰撞室射入电压为30、15、15、16、30、25、29、20 V,碰撞电压分别为50、50、40、70、55、50、50和40 V,碰撞室射出电压分别为6、3、5、3、5、8、5.5和7 V;内标内标非那西汀质谱检测电压,去簇电压为40 V,射入电压为5 V,碰撞室射入电压为180 V,碰撞电压为23 V,碰撞室射出电压为12 V。
2.2 数据处理与统计学方法

2.3 方法学验证
根据国家食品药品监督管理总局《药物非临床药代动力学研究技术指导原则》[11]进行方法学验证。
2.3.1 特异性考察:本试验所建立的HPLC-MS/MS条件下,血浆样品特异性考察结果见图1。可见,雪上一枝蒿乙素、介芬胺、藜芦胺、雪上一枝蒿甲素、雷公藤吉碱、滇乌碱、乌头碱及黄草乌碱甲等8种检测目标物和内标非那西汀在血浆中的特异性良好,无明显干扰峰,8种检测目标物和内标非那西汀的保留时间分别为3.19、3.73、3.74、3.79、3.86、3.88、3.94、4.18和3.26 min,表明血浆中内源性物质不影响8种检测目标物及内标非那西汀的检测。
2.3.2 线性范围及定量限:取人空白血浆,加入不同质量浓度的雪上一枝蒿乙素、介芬胺、藜芦胺、雪上一枝蒿甲素、雷公藤吉碱、滇乌碱、乌头碱和黄草乌碱甲混合标准溶液,按前文所述方法处理后测定。以检测目标物峰面积和内标峰面积的比值为纵坐标Y,以检测目标物质量浓度为横坐标X,采用加权最小二乘法拟合(权重1/X2),获得各检测目标物于空白人血浆中的回归方程、相关系数、最低定量限(S/N≥10)及最低检测限(S/N≥3),结果见表1,表明各检测目标物于血浆中在定量范围内线性关系良好。
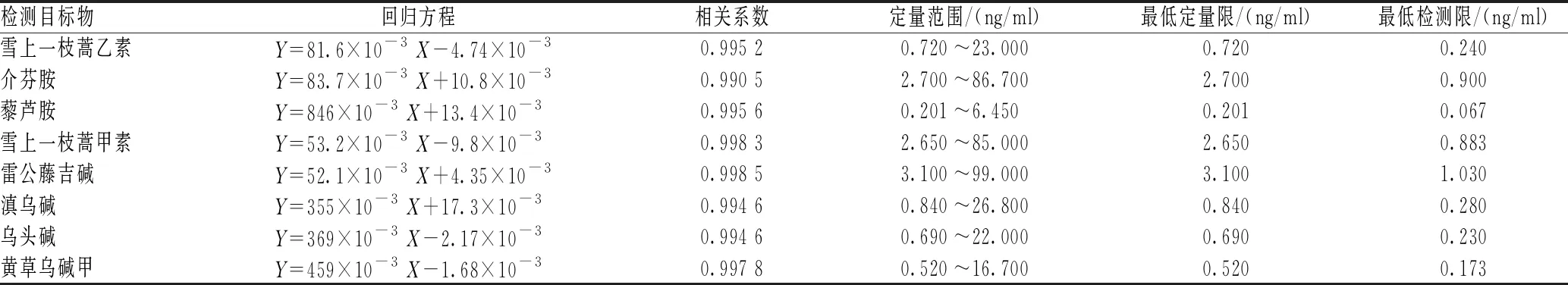
表1 人血浆样品中检测目标物线性回归方程Tab 1 Equation of linear regression of detection targets in human plasma
2.3.3 残留率:以线性最高质量浓度点样品-空白血浆样品顺序交叉进样,计算空白血浆样品中残留峰面积与定量下限样品峰面积的比值,即残留率。结果显示,检测目标物雪上一枝蒿乙素残留率为0.66%~1.21%,介芬胺残留率为0.70%~2.87%,藜芦胺残留率为0.00%~2.43%,雪上一枝蒿甲素残留率为0.90%~1.80%,雷公藤吉碱残留率为0.55%~0.55%,滇乌碱残留率为0.36%~0.72%,乌头碱残留率为0.36%~1.06%,黄草乌碱甲残留率为0.26%~0.54%,内标非那西汀残留率为0.11%~0.19%,表明残留率不影响样品的检测。
2.3.4 精密度和准确度试验:处理检测目标物最低定量限及3个质量浓度血浆质控样本3批,每批每个质量浓度6份,计算日内、日间精密度与准确度,结果见表2。结果表明方法精密度和准确度均满足生物样品定量分析要求。
2.3.5 提取回收率及基质效应:分别处理3个质量浓度的血浆质控样品,每个质量浓度6份,与对应质量浓度标准溶液比较,计算提取回收率。处理低、中和高3个质量浓度的血浆质控基质样品,每个质量浓度6份,与对应质量浓度标准溶液比较,计算归一化基质效应,基质效应=(基质效应样品峰面积/标准溶液峰面积)×100%;归一化基质效应=(目标物基质效应/内标基质效应)×100%,结果见表3。结果表明,该方法的提取回收率较高,回收率及基质效应对不同质量浓度质控样品的分析检测影响一致,故可忽略基质效应对分析检测的影响,提取回收率及基质效应符合生物样本分析检测要求。
2.3.6 稳定性考察:8种生物碱血浆质控样品于待考察条件下的稳定性考察结果显示,处理后血浆质控样品于常温放置5 d后,雪上一枝蒿乙素、介芬胺、藜芦胺、雪上一枝蒿甲素、雷公藤吉碱、滇乌碱、乌头碱及黄草乌碱甲测定浓度与理论浓度的RSD为6.42%~13.15%,测定浓度与理论浓度的RE为-11.29%~9.48%。未处理血浆质控样品于常温存放6 h测定浓度的RSD为3.88%~9.74%,测定浓度与理论浓度的RE为-5.69%~6.60%;-80 ℃存放5 d及-80 ℃存放5 d内反复冻融3次后,测定浓度的RSD为4.09%~14.01%,测定浓度与理论浓度的RE为-12.70%~10.10%。除乌头碱外,其他7种生物碱于-80 ℃存放173 d及-80 ℃存放173 d内反复冻融3次后,测定浓度的RSD为4.42%~12.75%,测定浓度与理论浓度的RE为-9.51%~14.37%;乌头碱于-80 ℃存放173 d及-80 ℃存放173 d内反复冻融3次后,测定浓度与理论浓度的RE分别为(-39.13±4.46)%、(-39.03±2.31)%。结果表明,除乌头碱外,其他7种生物碱血浆质控样品于上述稳定性考察条件下均稳定,符合生物样品测定要求;乌头碱于-80 ℃存放173 d及-80 ℃存放173 d内反复冻融3次不稳定,为避免对其分析检测的准确性造成影响,乌头碱血浆样品不宜长期存储。
3 讨论
因检测目标物均为生物碱类化合物,故血浆样品前处理过程中先采用氨水碱化,分别对加入浓氨水10 μl、25%氨水20 μl和25%氨水40 μl进行考察。结果显示,加入浓氨水10 μl碱化后,雪上一枝蒿甲素、介芬胺、滇乌碱和黄草乌碱甲回收率均为60%~70%,推测为浓氨水沉淀蛋白造成检测目标物被裹挟沉淀;与加入25%氨水20 μl碱化比较,加入25%氨水40 μl碱化后,雪上一枝蒿乙素、滇乌碱的回收率提高约10%,黄草乌碱甲的回收率提高约20%。分别对提取溶剂正己烷-二氯甲烷-异丙醇(V∶V∶V=20∶10∶1)、二氯甲烷-乙酸乙酯(V∶V=1∶5)、二氯甲烷-乙酸乙酯(V∶V=1∶10)、二氯甲烷-乙酸乙酯(V∶V=2∶5)和乙酸乙酯进行考虑,结果显示,各生物碱应用乙酸乙酯提取的回收率最优。另外,采用2倍乙腈沉淀前处理法时各生物碱的回收率与建立方法相近,但乙酸乙酯提取法检测限约为乙腈沉淀法的1/2,为优化检测方法的灵敏度,选用25%氨水碱化、乙酸乙酯提取法。
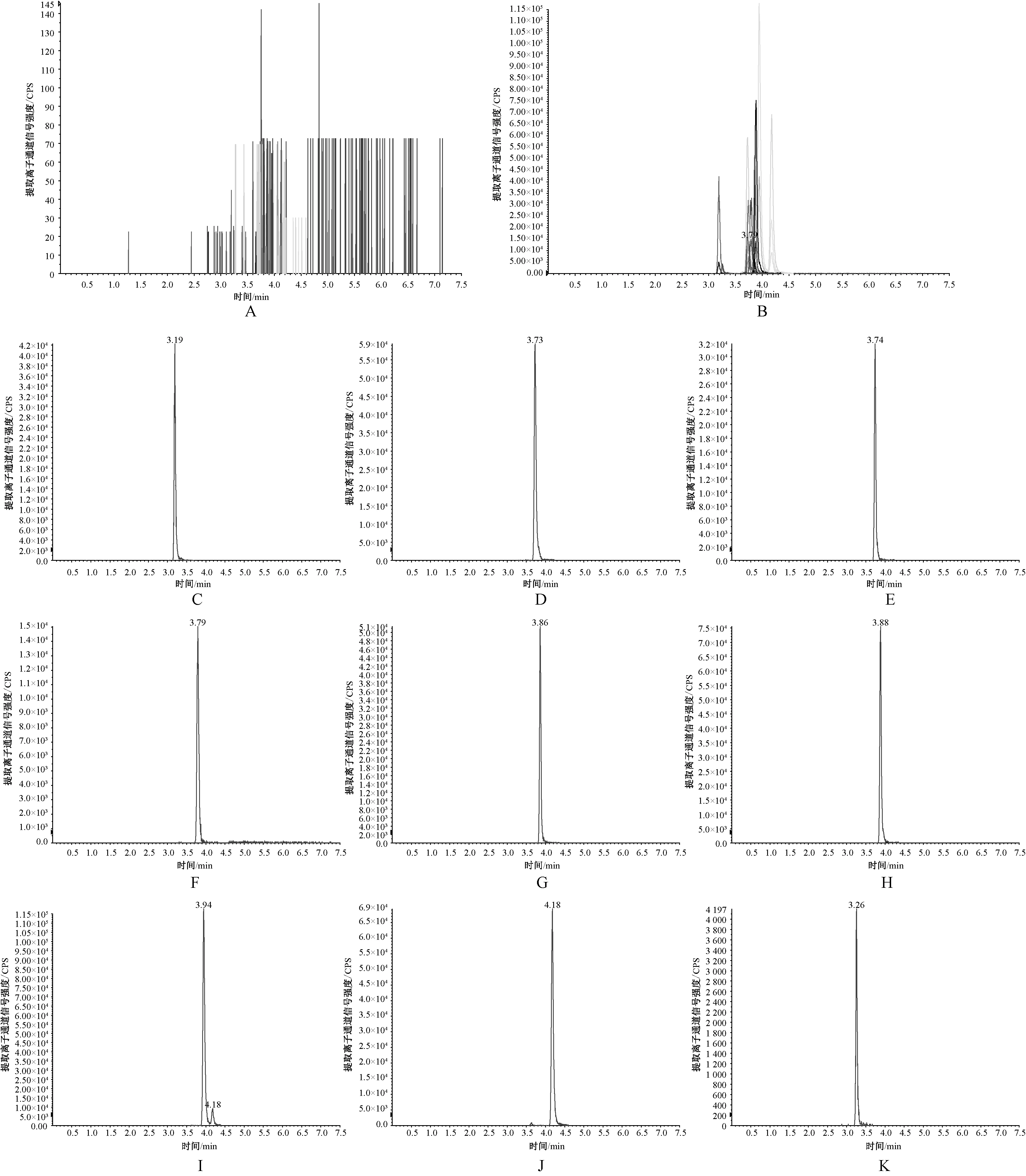
A.空白血浆样品;B.空白血浆加入8种检测目标物与内标非那西汀(2.59 μg/ml);C.雪上一枝蒿乙素;D.介芬胺;E.藜芦胺;F.雪上一枝蒿甲素;G.雷公藤吉碱;H.滇乌碱;I.乌头碱;J.黄草乌碱甲;K.内标非那西汀A.blank plasma sample;B.detection targets and phenacetin(2.59 μg/ml)add to the blank plasma;C.bullatine B;D.jervine;E.veratramine;F.bullatine A;G.wilforgine;H.yunaconitine;I.aconitine;J.vilmorrianine A;K.internal standard article phenacetin图1 血浆样品特异性考察(离子流图)Fig 1 Inspection on specificity of plasma sample
因建立方法同时检测的目标物较多,且出峰时间较为接近,峰宽较窄,均约为0.1~0.2 min,致使全时间段范围扫描所获得色谱图中目标峰扫描点数不足以稳定定量。故分别根据8种检测目标物及内标具体出峰时间,摸索确定分时间段扫描模式,从而使检测方法更为稳定。

表2 精密度和准确度试验结果Tab 2 Results of precision and accuracy tests
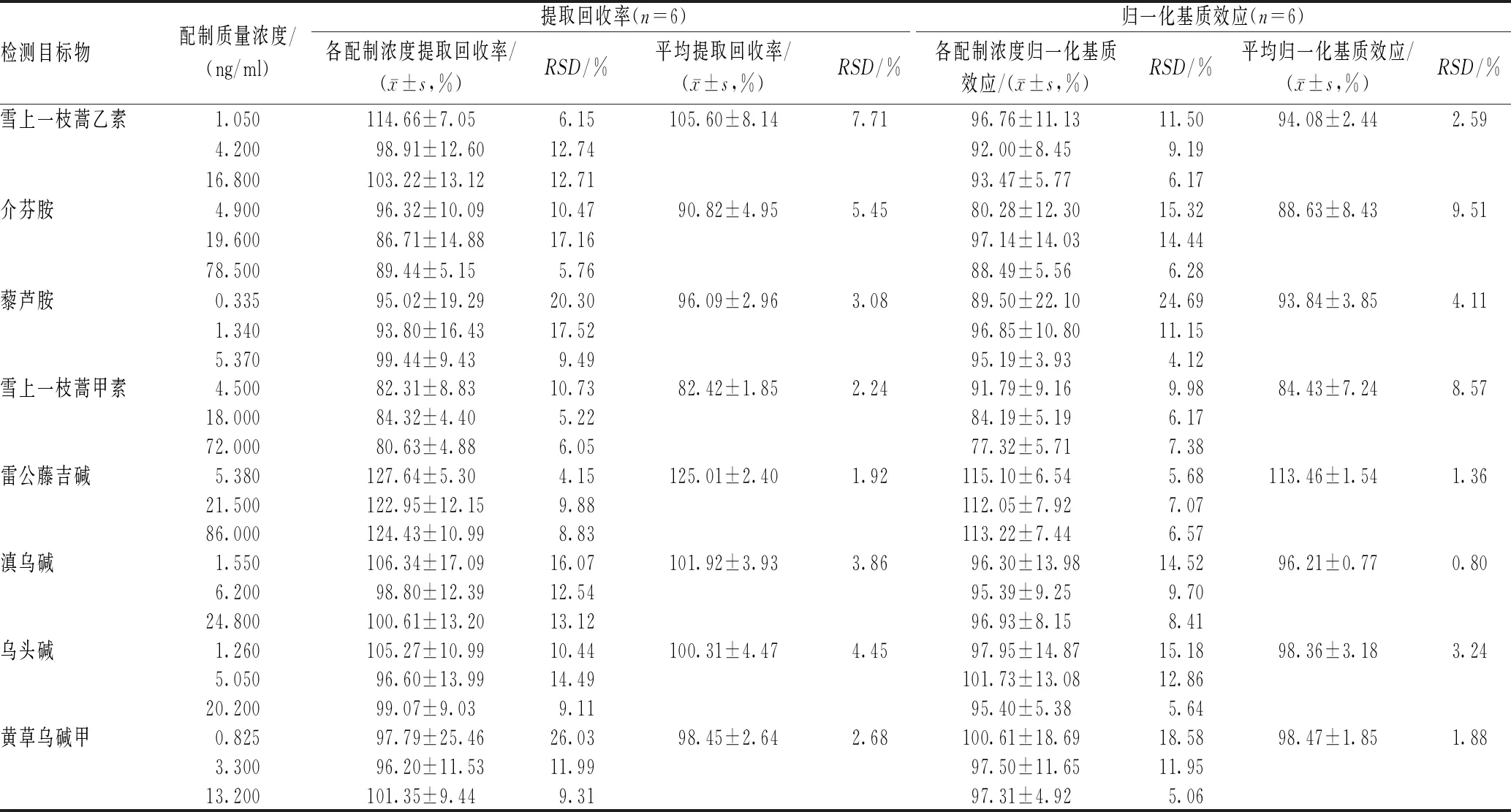
表3 提取回收率和基质效应结果Tab 3 Results of extraction recovery and matrix effect
8种有毒生物碱均采用正离子检测模式。流动相中加入适量酸有利于检测目标物的电离[12]。因此,对流动相中加入0.01%甲酸、0.1%甲酸、1%甲酸、0.01%甲酸和2 mmol/L醋酸铵进行考察。结果显示,上述流动相条件下,仅见雷公藤吉碱、滇乌碱色谱峰,其他化合物响应极低或未见,表明流动相酸性条件下无法实现8种检测目标物的同时检测。以0.04%氨水(pH=8.0~9.0)、2 mmol/L醋酸铵(氨水调pH=9.0)为水相,各生物碱均有响应,但滇乌碱出现双峰,黄草乌碱甲拖尾严重;变更流动相为乙腈-10 mmol/L醋酸铵(氨水调pH=8.8),各生物碱峰形较优,且响应较前述流动相均有提高。
综上所述,本研究建立的HPLC-MS/MS测定人血浆中8种有毒生物碱的方法,可灵敏、准确和稳定地测定人血浆中微量/痕量8种有毒生物碱的浓度,可达到生物样品检测的要求,可为临床8种有毒生物碱及相关药物的药物浓度监测及毒性检测判断提供技术支撑。

