正确认识联合用药治疗耐药菌感染
喻玮,肖永红
(1.浙江大学医学院附属第一医院传染病诊治国家重点实验室,感染性疾病诊治协同创新中心,杭州 310003;2.浙江省人民医院, 杭州医学院附属人民医院感染病科,杭州 310003)
世界卫生组织(WHO)发布的最新全球抗微生物监测系统数据显示,在22个国家50万例细菌感染的人口中,细菌耐药现象广泛存在[1],但新型抗菌药物的研发却进展缓慢。为解决泛耐药菌临床治疗的棘手问题,抗菌药物联合应用引起关注。
抗菌药物联合应用的目的是增强疗效,扩大抗菌谱,减少耐药发生,减少药物不良反应。然而,不合理的联合用药不仅不能达到上述目的,反而导致不良反应发生率增加,易导致二重感染,诱导细菌耐药,延误诊断和治疗等不良后果。目前,临床抗菌药物联合用药日益增多,但由于缺乏全面的科学研究,且体外联合药敏试验方法与体内状况存在较大差异,导致联合用药缺乏高质量的循证医学证据,且不同联合给药方案也给临床医生的选择造成困扰。因此,笔者在本文主要就目前抗菌药物联合用药治疗泛耐药菌感染进行客观分析,以期为临床治疗耐药菌感染提供参考。
1 联合用药指征
药物-药物相互作用(drug-drug interactions,DDIs)是指一种药物对另一种药物产生药动学或药效学影响,进而改变单种药物的预期效果。DDIs作用加强包括疗效提高和毒性增加,作用减弱包括疗效降低和毒性减少[2]。因此,抗菌药物联合使用应权衡利弊,明确用药指征,当感染可用单一抗菌药物有效控制时,无需进行联合用药。然而,以下几种情况下可考虑经验性联合应用抗菌药物,之后再根据病原学结果调整针对性用药[3-4]:①病原菌尚未查明的严重感染,特别是严重的脓毒症,尤其对于中性粒细胞减少症的患者和具有感染多重耐药菌风险的患者;②单一抗菌药物不能控制的严重混合感染、多重耐药菌或泛耐药菌感染;③需长疗程治疗,但病原菌易对某些抗菌药物产生耐药性的感染,或病原菌含有不同生长特点的菌群,需要应用不同抗菌机制的药物联合使用;④毒性较大的抗菌药物,联合用药时剂量可适当减少,但需有临床资料证明其同样有效。
2 联合用药的影响因素
抗菌药物DDIs包括药动学、药效学和药剂学3个方面。药动学影响主要包括药物在体内的吸收、分布、代谢和排泄;药效学包括协同、相加、无关、拮抗4种作用;药剂学主要包括物理和化学相互作用。
体外抗菌药物联合应用的评价方法主要包括棋盘稀释法、时间-杀菌曲线、E-test法、中空纤维柱模型等,但联合给药剂量、菌株、培养条件等都会对结果产生不同影响。值得注意的是,抗菌药物选择压力的强度会影响细菌进化的演变。研究表明,即使是较弱的选择压力也可能导致高水平耐药发生[5]。
由于宿主存在免疫系统,与体外实验相比,抗菌药物在体内发挥活性时,其抗菌机制往往更复杂[6]。不仅直接作用于病原微生物,还可触发体液及细胞免疫反应,参与免疫调节,抑制参与免疫逃避的细菌毒力因子和减少炎症反应[7]。同时,在临床抗菌药物联合使用过程中,除抗菌药物本身相互作用外,还受到患者病情严重程度、实验室检查可靠度等多种因素影响(图1)。因此,临床医师不仅需要了解体外及动物实验结果,也需结合临床实际情况选用联合给药方案。
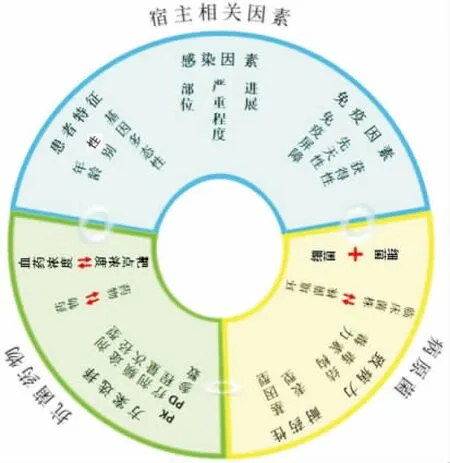
图1 抗菌药物药效学影响因素
Fig.1Influencingfactorsofthepharmacodynamicsofantibiotics
有研究将抗菌药物分为杀菌剂及抑菌剂,其中杀菌剂包括氨基苷类、β-内酰胺类、喹诺酮类、糖肽类、脂肽类、硝基咪唑类和硝基呋喃类;抑菌剂包括甘氨酰环素类、林可酰胺类、大环内酯类、唑烷酮类、链霉素类、磺胺类[8]。有研究据此进行抗菌药物联用推荐(图2)[9],然而,并没有临床证据支持杀菌剂及抑菌剂的概念。NEMETH等[10]通过荟萃分析发现,在腹部感染、皮肤和软组织感染及肺炎感染患者中,使用抑菌剂及杀菌剂概念来预测评估抗菌药物的疗效非常有限。近年来有学者提出了基于药动学/药效学(pharmacokinetics/pharmacodynamics,PK/PD)理论的抗菌药物合理使用,该理论在平衡策略性给药与毒性风险中发挥了重要作用。因此,在联合给药中,需要综合考虑两药联合后药物在体内的PK特点以及联合给药后是否能到达目标PK/PD参数,充分做到优化合理给药。

图2 抗菌药物联合用药方案
抗菌药物药效学受宿主因素、抗菌药物及病原菌三种因素影响,三者之间也可发生相关影响。
3 临床常见泛耐药菌感染的联合用药方案
3.1多重耐药肠杆菌科细菌感染 碳青霉烯类耐药肠杆菌(carbapenem-resistantEnterobacteriaceae,CRE)在全球范围内流行,由于CRE呈多重耐药,且患者病死率高,给临床治疗造成了严重威胁[11]。WHO把CRE列为需要优先开发治疗药物的耐药菌之一[12]。
在CRE临床治疗过程中,抗菌药物不合理使用的风险极高。虽然一些新型抗菌药物,如头孢他啶/阿维巴坦、美罗培南/法硼巴坦、氨曲南/阿维巴坦和头孢地尔治疗CRE有效,但目前很多国家仍未上市。因此,抗菌药物联合使用仍是治疗CRE感染的主要手段。现有联合治疗方案主要分为两类,一是以碳青霉烯类为基础的联合治疗;另一类是以非碳青霉烯类为基础的联合治疗,多数研究推荐粘菌素联合替加环素、氨基苷类或磷霉素,以及磷霉素联合氨基苷类[13-15]。
体外两药联合方案较多,不同联合方案对于不同酶型的不同菌种所产生的协同效应存在差异[16]。DUNDAR等[17]通过棋盘法评价亚胺培南-粘菌素、亚胺培南-替加环素、替加环素-粘菌素对CRE的协同效果,发现替加环素-粘菌素对耐碳青霉烯肺炎克雷伯菌的协同率达70%,而对耐碳青霉烯大肠埃希菌,则亚胺培南-粘菌素的协同效果最佳,协同率达75%。值得注意的是,BAND等[18]通过动物感染模型发现粘菌素由于存在异质性耐药,可导致治疗失败。目前临床检验并未常规检测粘菌素的异质性耐药,因此,当临床医师把粘菌素作为CRE治疗的“最后防线”时,需要警惕治疗失败的可能性。
TUMBARELLO等[19]通过Meta分析发现,联合给药后患者死亡率明显低于单药(分别为34%和54%),且对碳青霉烯类抗菌药最低抑菌浓度(minum inhibitory concentration,MIC)<8 mg·L-1的产KPC酶肺炎克雷伯菌,联合碳青霉烯类抗菌药物的生存率有所增加。因此,多项研究建议当碳青霉烯类抗菌药物MIC<4 mg·L-1时,给予以碳青霉烯类为基础的联合治疗[20],包括碳青霉烯类抗菌药物联合粘菌素或替加环素,甚至三药联合。Cochrane一项研究指出,广谱β-内酰胺类联合氨基苷类抗菌药物并不能降低革兰阴性菌败血症的总死亡率,且不良事件发生率有所增加,因此,不推荐此联合给药方案用于治疗CRE[21]。并且在以非碳青霉烯类为基础的联合治疗中,需考虑粘菌素、磷霉素单药容易诱导耐药,且粘菌素存在异质性耐药的可能,尽量使用联合给药。而使用替加环素仍存在争议,对于败血症及重症感染患者,需要结合临床表现调整给药剂量。
3.2耐甲氧西林金黄色葡萄球菌感染 在过去的几十年里,耐甲氧西林金黄色葡萄球菌(Methicillin-resistantStaphylococcusaureus, MRSA)的新克隆已出现散发流行,与院内MRSA不同,新型克隆复合体可感染社区人群,且常无特殊诱发因素[22]。目前万古霉素仍是治疗MRSA的首选药物,但最近也有关于万古霉素治疗失败的报道,甚至是对万古霉素敏感的MRSA感染[23-24]。2002年,耐万古霉素金黄色葡萄球菌(vancomycin-resistantS.aureus,VRSA)首次在美国被报道。为应对MRSA对万古霉素的敏感性减低,美国抗感染学会(Infectious Diseases Society of America,IDSA)于2011年制定了MRSA感染指南[25]。其中,对于大多数MRSA菌血症病例,推荐使用万古霉素或达托霉素[26]。另有一些研究评估了头孢洛林、利奈唑胺和喹奴普汀/达福普汀作为替代治疗方案的效果,但目前未批准用于MRSA菌血症[26]。
针对MRSA的联合治疗目前仍处于探索阶段。在体外实验中,SHAFIQ等[27]证实,达托霉素联合头孢洛林对于达托霉素不敏感的MRSA体外仍有杀菌作用。DHAND等[28]通过病例研究发现达托霉素联合β-内酰胺类抗菌药物可成功治疗持续性MRSA菌血症。而DAVIS等[29]也通过比较万古霉素联合氟氯西林与万古霉素单药治疗MRSA菌血症发现,联合给药可减少菌血症持续时间。值得注意的是,对于人工瓣膜患者,建议万古霉素短期联合庆大霉素或利福平[25]。而对于MRSA菌血症无人工瓣膜置入患者,目前临床实验发现万古霉素与庆大霉素或利福平联用后并未明显改善临床结局,且有增加肾毒性及药物不良反应风险[30-31]。因此,对于病情危重的患者,考虑减少MRSA菌血症持续时间时,可考虑使用万古霉素或达托霉素联合β-内酰胺类抗菌药物。
3.3多重耐药鲍曼不动杆菌感染 近十年来,不动杆菌分离率上升明显,其中以鲍曼不动杆菌最常见,且多重耐药与泛耐药不动杆菌也越来越常见[32]。部分国家耐碳青霉烯类鲍曼不动杆菌检出率已高达90%[33]。
对于泛耐药鲍曼不动杆菌感染,目前国际上推荐用于治疗的药物包括粘菌素、舒巴坦、替加环素及部分氨基苷类抗菌药物。其中粘菌素被认为是治疗鲍曼不动杆菌感染的“最后防线”[34]。尽管粘菌素对鲍曼不动杆菌具有较高敏感性,但由于异质性耐药常影响治疗效果[35]。目前β-内酰胺类和β-内酰胺酶抑制剂的最新组合(头孢他啶/阿维巴坦、头孢洛扎/他唑巴坦、美罗培南/法硼巴坦、亚胺培南/瑞来巴坦)及新型氨基苷类抗菌药物普拉米星对部分碳青霉烯类耐药鲍曼不动杆菌具有抗菌活性,但目前尚缺乏针对此类新型药物的联合给药试验数据。
《中国鲍曼不动杆菌感染诊治和防控专家共识》推荐鲍曼不动杆菌的联合给药方案包括以舒巴坦为基础的两药联合及三药联合(舒巴坦+多西环素+碳青霉烯)[36]。有研究认为高剂量氨苄西林/舒巴坦(24/12 g)对于治疗多重耐药鲍曼不动杆菌感染的呼吸机相关性肺炎具有较好临床和微生物疗效[37-38]。目前尚无临床证据证明针对耐碳青霉烯类鲍曼不动杆菌的联合用药较单药可减少耐药发生及改善临床预后,但联合给药的微生物清除率较单药增加[39]。
在体外研究或动物研究中证实,对多重耐药或泛耐药的鲍曼不动杆菌具有良好抗菌效果的联合给药方案包括碳青霉烯类+粘菌素、替加环素+粘菌素、万古霉素+粘菌素、米诺环素+粘菌素、美罗培南+磷霉素+粘菌素、粘菌素+利福平等[40-44]。然而,并没有充足的临床研究数据进一步证实。在一项纳入210例仅对粘菌素敏感的不动杆菌感染的多中心临床实验中,通过随机将患者分配到粘菌素单药组及粘菌素联合利福平治疗组,发现两药联合后并未明显降低死亡率,但两药联合后增加了微生物清除率(44.8% VS 60.6%)[45]。另外多项Meta分析研究发现,对于成人多重耐药鲍曼不动杆菌感染,粘菌素与氨苄西林/舒巴坦及替加环素的临床治愈效果差异无统计学意义,且肾毒性发生率明显增加,但以粘菌素为基础的联合治疗,特别是与舒巴坦联合,微生物清除率增加,且肾毒性发生率降低[39,46]。因此,对于对粘菌素敏感但对其他药物耐药的鲍曼不动杆菌感染患者,静脉给予基于粘菌素的联合给药方案仍是一种有效的选择。
替加环素推荐治疗剂量由于药动学特征限制难以达到理想的抗菌效果,且对于呼吸机相关性肺炎患者,替加环素的死亡率更高[47-49]。因此,当有其他有效抗菌药物可供选择或鲍曼不动杆菌菌血症时,不推荐使用替加环素。此外,在临床选择经验性治疗时,需考虑既往不动杆菌定植和感染情况,以及近期使用抗菌药物,动态监测药物敏感性变化,及时调整用药方案。
3.4多重耐药铜绿假单胞菌感染 铜绿假单胞菌在我国临床分离率有所增加,目前已成为临床分离的第二位革兰阴性菌,并以重症监护病房最为常见,且多重耐药及泛耐药较为常见,其固有耐药和获得性耐药限制了抗菌药物的选择[32]。有研究证实,有效抗菌药物延迟使用会增加患者死亡率[50]。但铜绿假单胞菌所致的严重感染究竟是采用联合治疗还是单药治疗目前仍存在争议。通常仅在已知或疑似铜绿假单胞菌引起的脓毒症和严重感染,且相应死亡率较高或耐药风险较高时,采用经验性联合给药治疗。然而,既往研究并未发现联合用药可明显改善患者死亡率[51]。
最新研究证实,4种新型抗菌药物(头孢他啶/阿维巴坦、头孢洛扎/他唑巴坦、头孢地尔、亚胺培南/瑞来巴坦)对多重耐药铜绿假单胞菌具有较好的抗菌活性,但也有耐药菌的报道[52],因此目前迫切需要针对新型抗菌药物对铜绿假单胞菌感染预后真正影响进行评价的临床试验。
联合给药的最大益处在于经验性治疗过程中增加了选择有效药物的可能性,并不是确定在治疗期间可以防止耐药发生[53]。体外实验证实对多重耐药铜绿假单胞菌两药联合后抗菌活性增强的方案有:替卡西林+妥布霉素+利福平、亚胺培南+妥布霉素、粘菌素+利福平、氟喹诺酮类+头孢他啶/头孢吡肟、粘菌素+妥布霉素、克拉霉素+妥布霉素、粘菌素+利福平、磷霉素+碳青霉烯类等[54-56]。YAMAGISHI等[57]使用棋盘法评价了24种联合给药方案对15株多重耐药铜绿假单胞菌的抗菌活性,并通过动物实验证实粘菌素联合氨曲南的抗菌活性最佳。目前临床研究较多关注肺囊性纤维化患者感染铜绿假单胞菌。研究证实,吸入妥布霉素联合口服环丙沙星与吸入粘菌素联合口服环丙沙星相比,病原微生物清除率并无明显差异[58]。目前尚缺乏联合治疗对多重耐药铜绿假单胞菌感染的前瞻性临床研究。
结合目前有限的数据,对于重症感染患者,在权衡早期使用有效抗菌药物和减少耐药性筛选风险后,推荐早期使用联合给药方案。一般而言,在无禁忌证的情况下,通常使用抗铜绿假单胞菌β-内酰胺类(哌拉西林/他唑巴坦、头孢他啶、头孢吡肟或碳青霉烯类)联合氨基苷类。但当患者肾功能不全或当地医疗机构耐氨基苷类铜绿假单胞菌比例较高时,可考虑抗铜绿假单胞菌β-内酰胺类联合氟喹诺酮类[59]。近年来,以粘菌素为基础的联合给药方案使用率增加,但在临床使用过程中,由于美国和欧洲的剂型不同,需要注意不同的推荐剂量[53,60]。
3.5耐万古霉素肠球菌感染 近年来,由于各种侵入性操作、长期广谱抗菌药物广泛使用以及免疫抑制剂使用增加等因素,院内肠球菌感染率不断升高。2014年,我国肠球菌检出率8.7%,是仅次于葡萄球菌的第二位院内感染革兰阳性菌[61]。有报道指出,肠球菌血流感染患者的死亡率高达43%[62]。其中,菌血症患者感染性心内膜炎发生率8%~32%,可能与肠球菌逃避宿主防御有关[63]。
YIM等[64]报道,约35.5%医院获得性肠球菌对万古霉素耐药。目前治疗万古霉素耐药肠球菌感染的选择有限,主要包括利奈唑胺、喹奴普汀/达福普汀、替加环素、达托霉素,以及近期上市的泰地唑胺和奥利万星,然而,肠球菌对这些药物的耐药性也有报道,因此,最佳治疗方案尚不明确。
美国心脏协会对于肠球菌性心内膜炎推荐联合给药[65]。目前体外及动物实验基于敏感性的联合给药方案包括:达托霉素+庆大霉素或链霉素或氨苄西林或者头孢洛林、达托霉素+替加环素、达托霉素+庆大霉素+利福平、氨苄西林+喹奴普汀/达福普汀、喹奴普汀/达福普汀+多西环素+利福平、喹奴普汀/达福普汀+米诺环素、氨苄西林+氟喹诺酮类药物、米诺环素+氯霉素等[66-70]。其中,关于达托霉素联合庆大霉素的体外试验结果并不一致,部分研究证实两药联合后具有相加作用[71]。但由于庆大霉素治疗可能引起毒性风险增加,一般情况下不主张达托霉素联合庆大霉素。临床研究发现,对于万古霉素及达托霉素耐药的肠球菌所致血流感染患者,达托霉素联合氨苄西林具有较好的临床疗效[72]。但BRITT等[73-74]却发现,达托霉素单药及与β-内酰胺联合后的临床治愈率无明显差异,而大剂量达托霉素(10 mg·kg-1·d-1)与β-内酰胺联合的临床预后较好。另外,当达托霉素联合β-内酰胺类抗菌药物治疗无效时,可进行包括利奈唑胺、喹奴普汀/达福普汀、替加环素的联合补救方案[64]。
临床治疗过程中,需要考虑肠球菌定植的可能性,在存在侵袭性感染(心内膜炎、脑膜炎、菌血症)的情况下,可考虑基于敏感性的联合用药。如果考虑联合氨基苷类抗菌药物时,应检测肠球菌是否对庆大霉素及链霉素具有高水平耐药,减少治疗失败的发生率。
4 总结
抗菌药物联合给药过程中存在发生拮抗作用、增加肾毒性、导致二重感染及其他无法预期的风险,特别对于儿童、老年人、肝肾功能减退的特殊人群,临床用药时要特别注意药物的相互作用。临床实践中,联合用药需要具有明确的指征,临床医师要熟悉抗菌药物的PK/PD特点,参考体外联合药敏实验结果,结合高质量临床研究报告,充分考虑患者疾病的状态,确定联合抗菌治疗的适用人群、使用时机、起始联合给药方案,并及时调整治疗方案,不断优化联合给药方案,在细菌与抗菌药物的博弈中真正实现抗菌药物治疗的个体化。

